一株奶山羊伪结核棒状杆菌的分离与鉴定
2017-05-18朱伟英猴银行霍宁宁桑锋锋张洪杰李言言陈德坤
朱伟英,猴银行,霍宁宁,桑锋锋,张洪杰,高 洋,李言言,王 毅,陈德坤*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.陕西省富平县动物疫病预防控制中心,陕西富平 711700)
一株奶山羊伪结核棒状杆菌的分离与鉴定
朱伟英1,猴银行2,霍宁宁1,桑锋锋1,张洪杰1,高 洋1,李言言1,王 毅1,陈德坤1*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.陕西省富平县动物疫病预防控制中心,陕西富平 711700)
为获得陕西某羊场病羊脓包中的病原菌,以无菌采集的病羊颈部脓汁为材料,进行细菌分离培养,鉴定分离菌株的形态特征、培养特性、生化特性,挑取分离菌株进行协同溶血试验(cAMP)和16S rRNA 基因的PCR 扩增,并对序列进行分析,NJ法构建系统发育树;用分离菌株分别接种Balb/c小鼠和奶山羊;药敏试验鉴定分离株的耐药性。结果显示,分离菌株的形态特征、培养特性、生化特性与伯杰细菌鉴定手册所述伪结核棒状杆菌特性一致;测序显示分离菌株与GenBank中已收录伪结核棒状杆菌相似性达97%以上;Balb/c小鼠致病性试验和奶山羊动物回归试验表明分离株有强致病性;药敏试验表明分离菌株对红霉素、环丙沙星、克拉霉素、强力霉素、四环素、头孢唑啉、新霉素、氧氟沙星等多种抗生素敏感,对复方新诺明耐药。
山羊;伪结核棒状杆菌;分离;鉴定
伪结核棒状杆菌(Corynebacteriumpseudotuberculosis,CP)是引起山羊和绵羊干酪性淋巴结炎(Caseous lymphadenitis,CLA)的病原菌,能使山羊、绵羊、骆驼、马、牛和小鼠等多种动物致病[1-4],以山羊体表或内脏组织形成干酪性脓肿为主要特征[2,5]。该菌可致病羊消瘦、生产性能低下和繁殖功能障碍。由于发病迟缓,致死率低,故常常为人所忽视[5-6];而常规外科处理复发率较高,且药物治疗效果不佳,因此很难彻底清除,是兽医界公认的难以防治的动物传染病之一[7-10]。
近期陕西某奶山羊养殖基地的一些泌乳羊于下颌部、肩胛部和腹股沟等处淋巴结鼓起较大脓包,羊群触诊发现呈坚硬感或波动感,甚至破溃流脓,疑似伪结核棒状杆菌感染症状。为进一步确诊该病,无菌采集病羊脓包中的脓汁进行细菌分离鉴定、动物致病性试验和药敏试验,证明分离鉴定出一株山羊伪结核棒状杆菌,为今后该养殖地区本病防控提供重要依据。
1 材料与方法
1.1 材料
1.1.1 病料 陕西省某羊场疑似山羊伪结核病羊脓包的脓汁样品。
1.1.2 菌株 马红球菌(Rhodococcusequi),购自中国兽医微生物菌种保藏管理中心。
1.1.3 培养基及试剂TaqDNA聚合酶、dNTPs,北京全式金生物技术有限公司产品;DNA Marker DL 2 000、宝生物工程(大连)有限公司产品;生化鉴定管、药敏纸片,杭州天和微生物试剂有限公司产品;酵母提取物、胰蛋白胨、琼脂粉、异硫氰酸胍、二硫苏糖醇、Na2EDTA、NaCl、二氧化硅、异丙醇、无水乙醇、结晶紫、碘化钾、碘、番红、溴化乙锭等为进口或者国产分析纯;各种培养基及平板西北农林科技大学动物医学院免疫学实验室自行配制。
1.1.4 试验动物 Balb/c 小鼠4只,雌性,6周龄,购自第四军医大学;关中奶山羊1头,雄性,8月龄,正常饲喂于西北农林科技大学动物医学院实验动物中心。
1.2 方法
1.2.1 分离纯化 无菌操作取适量脓汁稀释液接种50 mL/L绵羊鲜血琼脂平板,37℃培养24 h ~ 48 h,选取单个菌落,涂片、革兰染色、镜检后,接种于鲜血琼脂平板、普通琼脂平板、麦康凯琼脂平板,37℃培养48 h观察结果[11];并分别接种LB培养基和10 mL/L犊牛血清LB培养基,37℃纯化培养,观察培养特性,并涂片染色镜检[12]。
1.2.2 生化特性 取上述纯化培养后菌落,常规方法接种一套生化反应培养管,37℃培养24 h ~ 48 h 后观察结果[13]。
1.2.3 协同溶血试验 先接种R.equi单菌落于绵羊鲜血琼脂平板,接种针灭菌后,垂直方向接种分离菌株单菌落使两者呈T字分布,37℃培养24 h后观察协同溶血现象,记录试验结果[14]。
1.2.4 分子生物学鉴定 参照文献[10]设计的伪结核棒状杆菌16S rRNA 基因设计引物如下,上游引物(P1):5′-ACCGCACTTTAGTGTGTGTG-3′;下游引物(P2):5′-TCTCTACGCCGATCTTGTAT-3′。 由南京金斯瑞生物科技有限公司合成。二氧化硅法提取细菌基因组DNA进行PCR扩增[10]。PCR扩增产物进行琼脂糖凝胶电泳检测,将阳性结果送至南京金斯瑞生物科技有限公司测序,测序结果用NCBI Blast比对,NJ法构建系统发育树进行遗传进化分析[15]。
1.2.5 小白鼠致病性试验 Balb/c小鼠随机分成2组,每组3只,每只腹股沟皮下接种0.2 mL;试验组接种1.8×108CFU/ mL菌液,对照组接种LB培养基;每日常规饲养观察小鼠发病情况并记录结果[1]。1.2.6 动物回归试验 关中奶山羊颈部皮下一侧接种1.8×108CFU/mL 菌液2.0 mL,另一侧接种LB培养基2.0 mL作为对照;每日常规饲养观察山羊发病情况并记录结果[12]。
1.2.7 药敏试验 常规纸片法对上述分离株进行药敏试验。参照美国CLSI标准,根据抑菌环直径大小判定细菌对相应抗菌药物的敏感程度
2 结果
2.1 分离培养及镜检
脓汁涂片镜检革兰染色阳性,有时易脱色,多呈棒状或球杆状,无荚膜,无芽胞,不能运动;多单在、成双或栅栏状排列(图1)。纯培养物涂片中,多数为球状,酷似葡萄球菌,少数为杆状。
脓汁在鲜血琼脂平板上初分离时,可见培养基表面呈密集的棉絮状(图2)。挑取单个菌落接种,在含血液、血清的培养基上生长良好;普通培养基上生长缓慢、贫瘠;麦康凯琼脂上不生长。鲜血琼脂平板24 h 可见针尖状小菌落,随后菌落逐渐增大;48 h 后菌落变成干燥、不透明、灰白色、同心圆状、边缘不齐、中央突出,周围有狭窄β溶血环,传代后溶血现象消失(图3)。普通琼脂平板48 h 可见灰白色、圆形、较干燥的小菌落(图4)。菌落易推动、破碎,酒精灯火焰灼烧时有区别于其他菌株的噼啪声。LB液体培养基24 h 微混,至48 h 表面形成白色菌膜,震荡后菌膜破碎,管底存在颗粒状、絮状沉淀;加入血清可明显加速沉淀物形成。分离株从菌落形态和染色特性上与山羊伪结核棒状杆菌相似。
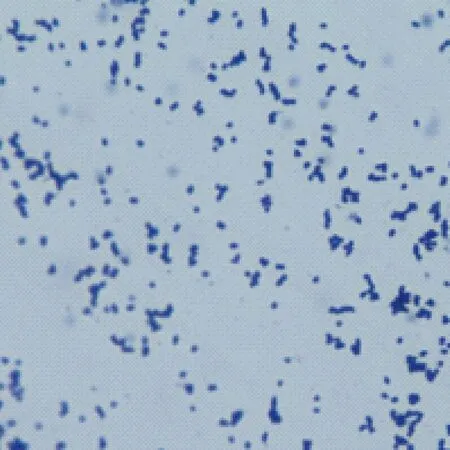
图1 分离菌株革兰染色100×

图2 脓汁血平板照片

图3 分离菌株(血板)

图4 分离菌株(白板)
2.2 生化特性
分离株可发酵甘露糖、果糖、葡萄糖产酸,能够水解七叶苷,分解尿素,与伯杰细菌鉴定手册所述伪结核棒状杆菌特性基本一致(表1)。
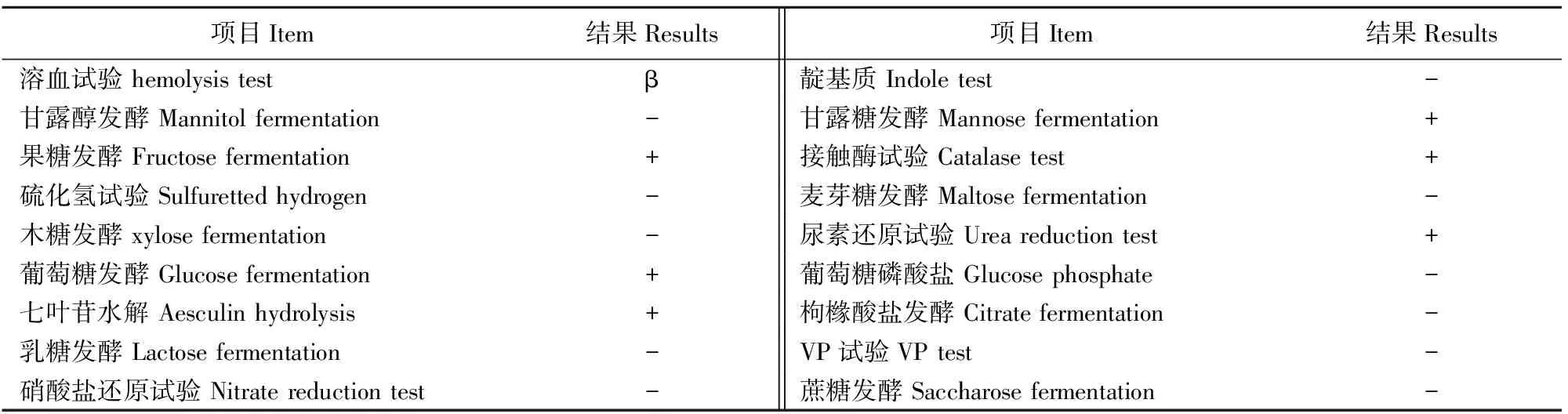
表1 生化试验鉴定结果
注:“+”代表阳性;“-”代表阴性。
Note: "+" means positive ; "-" means negative.
2.3 协同溶血试验
绵羊鲜血平板37℃培养 24 h 后,可见在两者的T形相交部位显著溶血现象(图5),说明两者的相互作用可促进红细胞溶解;这与山羊伪结核棒状杆菌协同溶血特性存在相似性[14]。

1.马红球菌;2.分离菌株1.R.equi; 2.The isolate
2.4 分子生物学鉴定
PCR产物的电泳结果显示扩增片段约为800 bp左右,与预期的816 bp 相一致(图6)。经NCBI Blast分析,测序结果与GenBank中已收录的伪结核棒状杆菌参考株(登录号CP013698.1)16srRNA序列同源性达97%以上,通过系统发育树分析,分离株与伪结核棒状杆菌亲缘关系达97%(图7),进一步确定该分离株为伪结核棒状杆菌。
2.5 小鼠致病性试验
Balb/c小鼠人工感染7 d后试验组接种部位皮下逐渐肿大至绿豆粒样,继而化脓破溃,并流出血清样脓汁(图8),逐渐变为黄绿色干酪样黏稠脓汁,之后慢慢结痂并自行痊愈;对照组小鼠无肉眼可见病变。无菌采集病变部位脓液经病原形态学、培养特性和PCR 鉴定与原分离株一致;从而证实原分离菌株对Balb/c小鼠有致病性。

1.DNA标准DL 2 000;2.阴性对照;3.分离菌株1.DNA Marker DL 2 000;2.Negative control;3.Isolate
2.6 动物回归试验
奶山羊人工感染15 d后试验组接种部位及附近逐渐出现鸽蛋大小的鼓起脓包,慢慢肿大至乒乓球到拳头大小,由于瘙痒摩擦等机械作用逐渐化脓破溃,先流出血色脓液,继而变黏稠,分泌淡黄绿色牙膏状脓汁,接着破溃处形成瘘管或结痂慢慢愈合[16];但由于应激等因素,一段时间又在原处或周围出现新发脓肿,如此反复迁延直至数月(图9)[17]。未接菌对照无肉眼可见病变。由此证明该分离株可使奶山羊发病,产生相应临床症状和病理变化,对其有很强致病性。无菌采集脓液分离鉴定,结果与原分离菌株一致。依据科赫三原则,再次证实该分离菌株确为致病性伪结核棒状杆菌。
2.7 药敏试验结果
药敏试验结果依照美国CLSI标准进行判定,结果显示该分离株对环丙沙星、红霉素、克拉霉素、强力霉素、四环素、头孢唑啉、新霉素、氧氟沙星等多种抗生素敏感,对复方新诺明具有耐药性(表2)[17]。

图7 分离菌株16S rRNA序列系统发育树

图8 Balb/c小鼠致病性试验
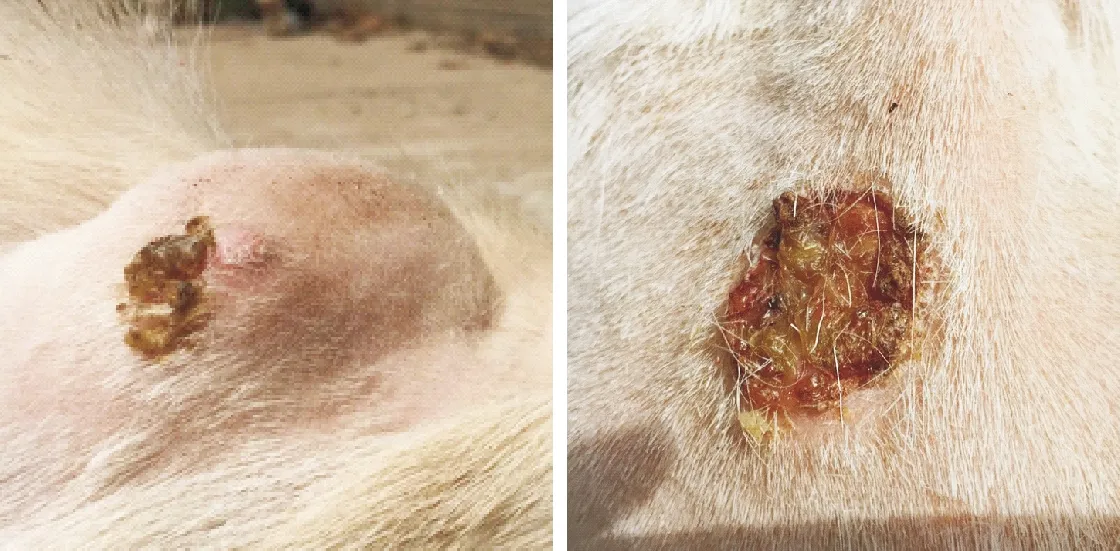
图9 动物回归试验
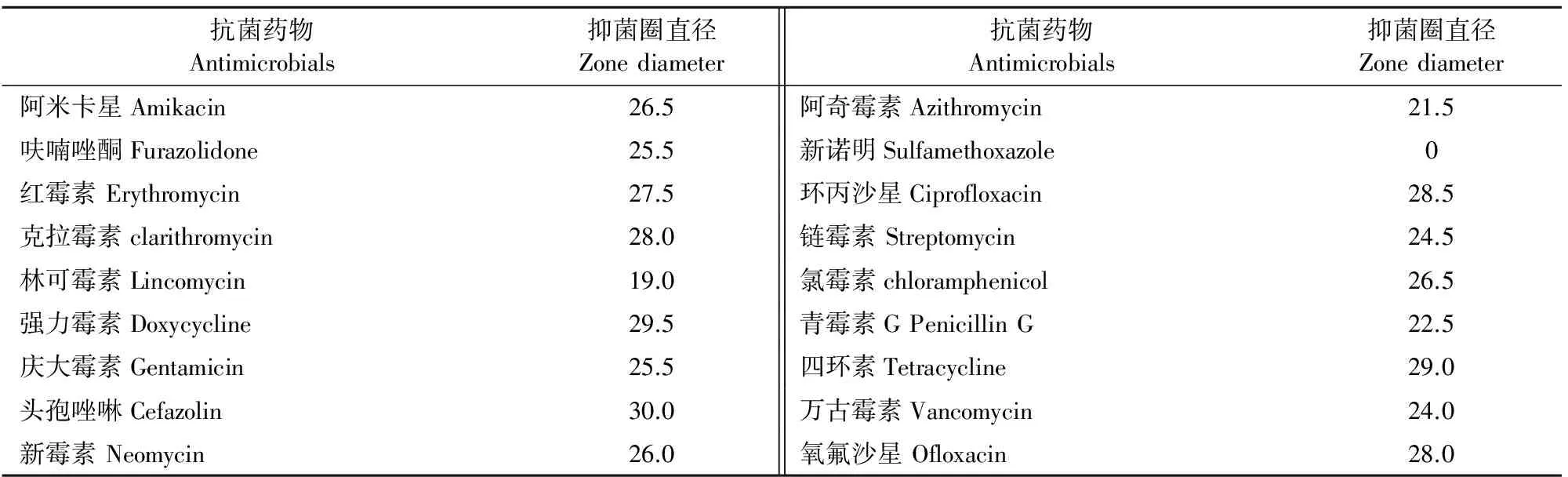
表2 分离菌株药敏试验结果
注: “S”代表敏感;“R”代表耐药。
Note:"S" means sensitive;"R" means resistance.
3 讨论
山羊伪结核棒状杆菌是引起多种动物与人感染的一种人兽共患传染病病原,多侵害皮下及淋巴结,形成局灶性脓肿,导致羊干酪性淋巴结炎[18-19]。该病存在于世界各地养的羊地区均,我国养羊大省内蒙古、陕西、甘肃、新疆、云南、贵州等地都有该病报道。由于该病致死率不高,常常未能引起广大养殖户高度重视[7,20]。很多养殖场发病时,一般都不做任何处理等待其自行痊愈,严重时多用抗生素治疗或是外科手术排脓处理,但往往治疗效果不佳;破溃的脓汁易将病原扩散给周围环境,导致本地区年年发病,继而使该病的检出率和发病率呈上升趋势,严重影响养殖户的经济效益;与此同时该病对人存在致病性,对食品公共卫生安全生产带来潜在的危害,因此对其防治不容忽视[21]。本研究根据分离菌形态特征、培养特性、生化特性与《伯杰细菌鉴定手册》描述的伪结核棒状杆菌特征基本一致特性、协同溶血现象、分子生物学鉴定以及致病性,可确定该分离菌为伪结核棒状杆菌。
研究人员曾先后研制伪结核棒状杆菌菌苗,进行CLA 的免疫试验,并且获得了一定的效果,但仍不够理想。究其原因主要是该病与结核病相似,难以产生有效免疫保护,需要细胞免疫和体液免疫协同发挥免疫效应。由于临床药物防治羊伪结核棒状杆菌不理想,目前也无有效防治该病的疫苗。因此,亟需制定出防治该病的有效方法。本研究将分离菌株接种Balb/c小鼠后与患病羊特性相一致的;因此,今后试验中可应用Balb/c小鼠作为动物模型,为研究该病提供一种更为经济、有效的手段。与此同时,我们将此分离株人工感染关中奶山羊进行动物回归试验证实其具有较强的致病性。后续试验中,我们将此毒株为试验菌株,研究伪结核棒状杆菌的毒力基因及其作用机制,深入研究该病的发病机理、免疫机制、防治手段,并拟用物理、化学和分子生物学方法使其毒力致弱[9,22],以期激发机体产生针对该菌的体液和细胞保护性免疫反应而又不会致机体发病,达到防治该病[23]。
基于当前该病的研究现状,应采取综合性的预防措施以防治该病[2-3,7,16,20]。首先,严格禁止从有伪结核棒状杆菌存在的羊群引种,新引进羊经隔离饲养确定无病原体检出时方可合群[24];其次,一旦发现疑似病羊隔离饲养并及时治疗发病羊,采取严格的消毒措施,妥善处理病羊排出物,避免病原体扩散[3]。若效果不佳应及时淘汰病羊以净化羊群[18]。同时,鼠类是伪结核棒状杆菌的保存宿主,应加强养殖场周边的灭鼠工作。最后,应做好该病的实时动态监测,以防其暴发。总之,早预防、早发现、早治疗、早淘汰,才能有效防止该病发生,以降低养殖户们的经济损耗。
[1] Droppa-Almeida D,Vivas W L P,Silva K K O,et al.Recombinant CP40 fromCorynebacteriumpseudotuberculosisconfers protection in mice after challenge with a virulent strain[J].Vaccine,2016,34(8):1091-1096.
[2] 朱志雄,梁文娟.浅谈山羊伪结核病的防治[J].广西畜牧兽医,2015(01):32-46.
[3] 刘国财,潘君香,李晓杰,等.羊伪结核病的防治[J].兽医导刊,2015(23):88-90.
[4] Araujo C L,Dias L M,Veras A A,et al.Whole-genome sequence ofCorynebacteriumpseudotuberculosis262 biovarequiisolated from cow milk[J].Genome Announc,2016,4(2):5718-5719.
[5] Abebe D,Sisay Tessema T.Determination ofCorynebacteriumpseudotuberculosisprevalence and antimicrobial susceptibility pattern of isolates from lymph nodes of sheep and goats at an organic export abattoir,Modjo,Ethiopia[J].Let Appl Microbiol,2015,61(5):469-476.
[6] Alves J T,Veras A A,Cavalcante A L,et al.Complete genome sequence ofCorynebacteriumpseudotuberculosisstrain PA01,isolated from sheep in Para,Brazil[J].Genome Announc,2016,4(2):7025-7026.
[7] 廖 雄,文正常,王 璇,等.山羊伪结核病的诊断与防治[J].中国畜禽种业,2013(8):105-106.
[8] Latif N A,Abdullah F F,Othman A M,et al.Isolation and detection ofCorynebacteriumpseudotuberculosisin the reproductive organs and associated lymph nodes of non-pregnant does experimentally inoculated through intradermal route in chronic form[J].Vet World,2015,8(7):924-927.
[9] Almeida S,Tiwari S,Mariano D,et al.The genome anatomy ofCorynebacteriumpseudotuberculosisVD57 a highly virulent strain causing caseous lymphadenitis[J].Standards Genomic Sci,2016,11(1).
[10] 曾 泽,韦雷飞,黄秀君,等.一起山羊伪结核棒状杆菌感染的诊断[J].动物医学进展,2014(3):131-133.
[11] 张梦思,李和贤,周作勇.四川达州地区山羊伪结核棒状杆菌病的诊断及药敏试验[J].中国兽医杂志,2015,51(12):54-56.
[12] 李文杨,刘 远,张晓佩,等.福清山羊伪结核棒状杆菌病的诊治[J].中国畜牧兽医文摘,2014(11):102-103.
[13] 蓝显利,闭炳芬,陶 立,等.马山县黑山羊伪结核病流行病学调查与诊治[J].广西畜牧兽医,2015(2):82-84.
[14] Syame S M,Hakim A S,Hedia R H,et al.Characterization of virulence genes present inCorynebacteriumpseudotuberculosisisolated from buffaloes[J].Global Vet,2013,10(5):585-591.
[15] 蔡俊波,王爱玲,李海敏,等.陕南白山羊伪结核棒状杆菌分离鉴定及灭活铝胶疫苗研制[J].动物医学进展,2016(7):49-52.
[16] 张 胜.山羊伪结核棒状杆菌病的诊断与治疗[J].中国畜牧兽医文摘,2015(12):164.
[17] 李文杨,刘 远,张晓佩,等.山羊伪结核棒状杆菌的分离鉴定[J].中国草食动物科学,2014,34(5):49-51.
[18] 马正忠,毛航平.绵羊干酪性淋巴结炎的发生与防治[J].现代畜牧科技,2015(9):141.
[19] Jeber Z K H,Mohdjin Z,Jesse F F,et al.Influence ofCorynebacteriumpseudotuberculosisinfection on level of acute phase proteins in goats[J].BMC Vet Res,2016,12(1):1130-1138.
[20] 宋先利.山羊伪结核病的诊治要点[J].中国畜牧兽医文摘,2013(6):143-144.
[21] 刘永霞.探析羊伪结核病的防治[J].中国畜禽种业,2015,11(9):109.
[22] Mariano D C B,Sousa T D J,Pereira F L,et al.Whole-genome optical mapping reveals a mis-assembly between two rRNA operons ofCorynebacteriumpseudotuberculosisstrain 1002[J].BMC Genomics,2016,17(1):5585-5591.
[23] Jorge K T O S,Santos T M,Tartaglia N R,et al.Putative virulence factors ofCorynebacteriumpseudotuberculosisFRC41:vaccine potential and protein expression[J].BMC Microbial Cell Factories,2016.doi: 10.1186/1471-2164-11-728.
[24] 侯万天,刘界强.羊伪结核病的防治[J].畜牧与饲料科学,2014,35(9):116-117.
Isolation and Identification ofCorynebacteriumpseudotuberculosisfrom Goats
ZHU Wei-ying,HOU Yin-hang,HUO Ning-ning,SANG Feng-feng,ZHANG Hong-jie,GAO Yang, LI Yan-yan,WANG Yi ,CHEN De-kun
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
In order to search for the pathogenic bacteria of the abscess from a caprine farm in Shaanxi province,abscess from the infected goats was obtained sterilely for routine bacterial isolation and identification.The pathogen was identified asCorynebacteriumpseudotuberculosisbased on its morphology,culture characteristics,biochemical characteristics and synergistic hemolytic test.16S rRNA gene PCR results and sequence alignments indicated that 16S rRNA gene from the isolate shared 97% identity with theCorynebacteriumpseudotuberculosisin GenBank.Animal pathogenicity experiment in Balb/c mice and goats confirmed that the isolate was strongly pathogenic.The result of antimicrobial susceptibility test indicated that the strain was highly sensitive to erythromycin,ciprofloxacin,clarithromycin,doxycycline,tetracycline,cefazolin,neomycin and ofloxacin,but resistant to sulfamethoxazole.The results could provide a certain basis for prevention and treatment of the disease in the farm.
goat;Corynebacteriumpseudotuberculosis; isolation; identification
2016-09-14
陕西省科技统筹创新工程计划项目(K3320215115)。
朱伟英(1990-),女,陕西宝鸡人,硕士研究生,主要从事分子病原学与免疫学研究。*通讯作者
S858.27
B
1007-5038(2017)05-0127-06
