微波协同复合酶法提取猴头菇多糖工艺研究
2017-05-18周小伟陈勇辉叶若松熊艳刘惠欣叶晓瑜钟瑞敏
周小伟,陈勇辉,叶若松,熊艳,刘惠欣,叶晓瑜,钟瑞敏,*
(1.韶关学院英东食品科学与工程学院,广东韶关512005;2.江西生物科技职业学院,江西南昌330200;3.江西科技师范大学生命科学学院,江西南昌330013;4.江西省农业科学院质量安全与标准研究所,江西南昌330200)
微波协同复合酶法提取猴头菇多糖工艺研究
周小伟1,陈勇辉2,叶若松3,熊艳4,刘惠欣1,叶晓瑜1,钟瑞敏1,*
(1.韶关学院英东食品科学与工程学院,广东韶关512005;2.江西生物科技职业学院,江西南昌330200;3.江西科技师范大学生命科学学院,江西南昌330013;4.江西省农业科学院质量安全与标准研究所,江西南昌330200)
以猴头菇子实体为原料,研究微波协同复合酶法提取猴头菇多糖的工艺,并将复合酶法与微波协同复合酶法提取猴头菇多糖的得率进行对比。微波协同复合酶法提取猴头菇多糖的最佳工艺条件为酶添加量2.0%,酶解pH4.5,酶解时间150 min,酶解温度50℃,微波功率119 W,料液比1∶15(g/mL),微波时间150 s,该条件下猴头菇多糖提取率达到19.13%。
猴头菇;多糖;复合酶;微波酶法
猴头菇又名猴头蘑、猴头菌等,是著名的药食两用菌,因其子实体形状神似猴子头部而得名。猴头菌中最主要的活性物质即为猴头菇多糖,它是生命有机体内非常重要的组成部分。猴头菇多糖不仅具有合成高分子所不具备的特殊生物活性,还具有各种各样的生物学功能[1]。研究表明,猴头菇多糖具有降低血脂、防止衰老、抑制肿瘤、提高免疫力等特殊生理功能,可普遍应用在医药范畴及保健食品领域。
目前报道的对猴头菇多糖提取的方法主要有热水浸提法[2-4]、酶法[5-6]、超声波提取法[7-8]、超声酶法[9]等。但是热水浸提法所需时间较长,提取率较低。近年来,酶制剂由于其独特的安全性及高效性,越来越多的被应用于食用菌的功能活性提取方面。本文以猴头菇为原料,采用微波协同复合酶,利用正交试验方法对提取工艺进行优化,并和复合酶提取多糖对比,分析两种方法对于猴头菇多糖得率的影响。
1 材料与方法
1.1 材料与试剂
干猴头菇:购自韶关五马寨菌业有限公司;葡萄糖、蒸馏水、无水乙醇、苯酚、氯仿、正丁醇、浓硫酸、柠檬酸、柠檬酸钠等试剂均为国产分析纯;纤维素酶(100 000 U/g)和果胶酶(100 000 U/g)为食品级。
1.2 仪器设备
主要仪器与设备见表1。

表1 仪器与设备Table 1 Instruments and equipments
1.3 方法
1.3.1 样品前处理
将猴头菇子实体切成小块,放入电热恒温鼓风干燥箱中,在60℃条件下干燥24 h,至恒重后放入高速粉碎机中粉碎,过30目筛,备用。
1.3.2 提取方法
猴头菇粉→精确称重→加复合酶—纤维素酶/果胶酶=1∶1(质量比)→按料液比1∶15(g/mL)加入一定量蒸馏水→过滤→乙醇沉淀→复溶→除蛋白→醇沉→冷冻干燥→猴头菇多糖→测定。
1.3.3 标准曲线建立
准确称取无水葡萄糖1.25 g定容至250 mL,再从中吸取5 mL样液至250 mL的容量瓶,稀释至刻度,配得浓度为100 mg/L标准葡萄糖样液。往5支试管中分别加入0.2、0.4、0.6、0.8、1.0 mL的标准样液,再向试管依次加入蒸馏水,使最终体积均为1 mL。另取蒸馏水1 mL作空白试验。用移液管向每支试管各加1 mL质量分数为5%的苯酚溶液,摇晃至均匀;紧接着向每支试管内用移液管缓慢加入5 mL浓硫酸,摇匀待测样品,温度冷却至室温[4]。
在490 nm下,测定不同质量浓度葡萄糖样品的吸光度。最后,以所测样品吸光度为纵坐标,以葡萄糖浓度为横坐标,绘制葡萄糖标准曲线[4],如图1所示。葡萄糖标准曲线的线性回归方程:y=0.998 6x+0.081 4,R2=0.998 8。

图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
1.3.4 猴头菇多糖含量测定
以苯酚-硫酸法测定猴头菇多糖含量[10],以葡萄糖作为标准样品。猴头菇多糖的得率以式(1)表示。

式中:W为猴头菇多糖提取率,%;Y为标准曲线所得多糖浓度,mg/mL;n为猴头菇多糖溶液的稀释倍数;V为样品的体积,mL;m为原料质量,mg。
2 结果分析
2.1 复合酶法
2.1.1 酶添加量对猴头菇多糖提取率的影响
不同酶添加量对猴头菇多糖提取率的影响见图2。

图2 复合酶添加量对多糖提取率的影响Fig.2 The effect of the amount of combined-enzyme on the yield of polysaccharide
由图2可知,随着酶添加量的增多,猴头菇多糖的得率呈不断上升的趋势,当酶添加量为2%时,猴头菇多糖得率最高。之后得率呈略微下降趋势,这是因为猴头菇的细胞壁结构主要为纤维素和果胶,当纤维素酶和果胶酶含量适当时,能够裂解纤维素和果胶,反之,当酶添加量过多时,溶质和溶剂比值也相应升高,从而降低酶解效果。
2.1.2 酶解时间对猴头菇多糖提取率的影响
酶解时间对猴头菇多糖提取率的影响见图3。

图3 酶解时间对多糖提取率的影响Fig.3 The effect of enzymolysis time on the yield of polysaccharide
从图3可知,猴头菇多糖得率随着酶解时间的延长不断增加,当酶解时间达到120 min时,可以达到14%的得率,但是随着酶解时间继续延长,猴头菇多糖的得率没有得到多少提高,这是因为酶解所需的酶消耗的原因。
2.1.3 酶解pH值对猴头菇多糖提取率的影响
在设定复合酶添加量2%,酶解温度50℃,酶解时间90 min的前提下,探究不同的酶解pH值对猴头菇多糖提取率的影响,试验结果见图4。

图4 酶解pH对多糖提取率的影响Fig.4 The effect of pH value on the yield of polysaccharide
由图4可知,当溶液pH值为4时,酶解效果最好,得到的猴头菇多糖得率也最高,pH值过低或过高均对酶解效果产生不利影响。这充分说明复合酶的最佳酶活pH条件为4。
2.1.4 酶解温度对猴头菇多糖提取率的影响
在设定复合酶添加量2%,复合酶酶解pH 4.0,酶解时间90 min的前提下[11],探究不同的酶解温度对猴头菇多糖提取率的影响,试验结果见图5。
由图5可知,45℃为复合酶的最适作用温度,此时猴头菇的多糖提取率达最大值。当酶解温度低于45℃,复合酶的活性会受到抑制,致使猴头菇多糖的提取率偏低;随着酶解温度的升高,复合酶又容易受热发生变性,从而降低酶活,导致多糖的提取率也偏低。因此,当酶解温度在45℃~60℃的范围内时,温度越高,猴头菇多糖提取率越低。试验确定40℃~50℃为复合酶适宜的酶解温度。

图5 酶解温度对多糖提取率的影响Fig.5 The effect of enzymolysis temperature on the yield of polysaccharide
2.1.5 正交试验
在复合酶法单因素试验的基础上设计正交试验,优化复合酶法提取猴头菇多糖的工艺,从而确定最佳提取工艺参数,并且考察各因素对猴头菇多糖提取率影响的主次顺序。选择对多糖得率影响较大的4个因素(酶添加量、酶解时间、酶解pH值、酶解温度)设计L9(34)的正交试验,所有试验均重复3次,所测多糖得率取平均值。复合酶法正交试验结果见表2。

表2 复合酶法正交试验结果Table 2 Orthogonal experiment results of complex protease method
极差Rj分析表明,4个因素影响猴头菇多糖提取率的主次关系为:酶解温度(D)>酶解时间(B)>酶解pH值(C)>酶添加量(A)。正交试验结果显示复合酶法最佳工艺条件为A2B3C3D3,在最佳工艺条件下进行验证试验,测得猴头菇多糖提取率为15.62%,高于正交试验中的最大值。即此次正交试验确定采用复合酶法提取猴头菇多糖的最佳工艺参数为酶添加量2.0%,酶解时间150 min,酶解pH4.5,酶解温度50℃。
2.2 微波协同复合酶法
在复合酶添加量为2.0%(纤维素酶与果胶酶质量比为1∶1),酶解pH值为4.5,酶解温度50℃条件下水浴酶解150 min,之后进行微波协同复合酶法的单因素及正交试验。
2.2.1 微波功率对猴头菇多糖提取率的影响
微波功率对提取率影响见图6。

图6 微波功率对提取率的影响Fig.6 The effect of microwave power on the yield of polysaccharide
由图6可知,当微波功率在119 W~231 W范围内,猴头菇多糖提取率随着微波功率的增大而增大;当微波功率为231 W时,多糖的提取率到达最大值;而后,多糖提取率随着微波功率的继续增大而降低。微波功率过大,容易使猴头菇多糖发生降解,从而降低多糖提取率。试验确定119 W~385 W为微波功率的考察范围。
2.2.2 料液比对猴头菇多糖提取率的影响
料液比对提取率的影响见图7。

图7 料液比对多糖提取率的影响Fig.7 The effect of the ratio of raw materials to water on the yield of polysaccharide
由图7可知,用蒸馏水作为提取猴头菇多糖的溶剂,当料液比为1∶20(g/mL)时,猴头菇多糖提取率最高。随着增大溶剂用量,猴头菇的多糖提取率呈降低趋势。为了节约成本,试验确定1∶15(g/mL)~1∶25(g/ mL)为料液比的考察范围。
2.2.3 微波时间对猴头菇多糖提取率的影响
微波时间对提取率影响见图8。

图8 微波时间对多糖提取率的影响Fig.8 The effect of the microwave time on the yield of polysaccharide
由图8可知,当微波时间在90 s~150 s范围内时,猴头菇多糖提取率随着微波时间的延长而升高;当微波时间为150 s时,多糖提取率最高;而后,多糖提取率随着微波时间的延长而下降。因此,确定微波时间的考察范围为120 s~180 s。
2.2.4 正交试验
微波协同复合酶正交试验设计见表3。

表3 微波协同复合酶正交试验设计Table 3 Orthogonal experiment design of microwave-enzyme synergistic
在微波协同复合酶法的单因素试验基础上,对微波功率、料液比、微波时间这3个因素开展正交试验,从而确定最佳提取工艺参数,并考察各因素对猴头菇多糖提取率影响的主次顺序。所有试验均重复3次,所测多糖得率取平均值微波协同复合酶法正交试验结果见表4。
极差Rj分析表明,3个因素影响猴头菇多糖提取率的主次关系为:料液比(B)>微波时间(C)>微波功率(A)。正交试验结果显示微波协同复合酶法最佳工艺条件为A1B1C2。即此次正交试验确定了采用微波协同复合酶法提取猴头菇多糖的最佳工艺参数为微波功率119 W,料液比1∶15(g/mL),微波时间150 s。
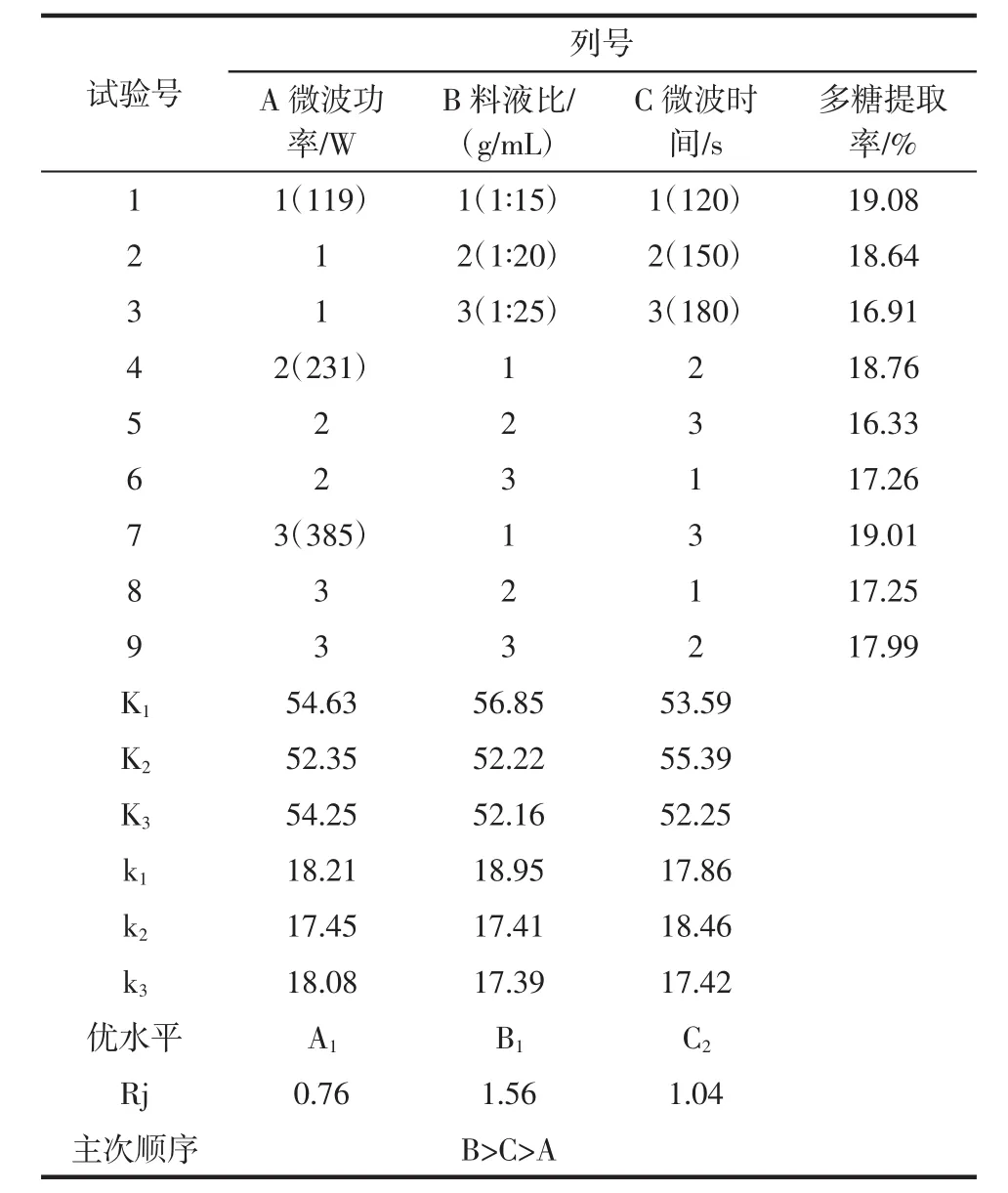
表4 微波协同复合酶法正交试验结果Table 4 Orthogonal experiment results of microwave-enzyme synergistic
2.2.5 验证性试验
为了考察工艺的稳定性,按微波协同复合酶法的最佳工艺条件A1B1C2进行重复性试验3次,多糖平均提取率为19.13%,高于按正交试验中的最高值19.08%。该工艺重复性、稳定性良好。
3 结论
本试验以猴头菇子实体为原料,通过单因素试验和正交试验,对微波协同复合酶法和复合酶法提取猴头菇多糖得率进行比较,确定了微波协同复合酶法提取猴头菇多糖最佳工艺条件。确定微波协同复合酶法的最佳工艺条件为:微波功率119 W,微波时间150 s,料液比1∶15(g/mL)。复合酶提取猴头菇多糖的最佳工艺条件为:酶添加量2%,酶解时间150 min,酶解pH为4.5,酶解温度50℃。影响复合酶提取猴头菇多糖得率的因素大小依次为酶解温度>酶解时间>酶解pH值>酶添加量。微波协同复合酶法最佳工艺条件下可得到19.13%的猴头菇多糖得率,比单独复合酶条件下所得多糖得率提高12.5%。复合酶法最佳工艺条件下可得到15.62%的猴头菇多糖得率。
通过微波辅助,可以明显加快猴头菇子实体颗粒物质的振动,同时,微波对猴头菇浸提液的加热和破坏细胞的双重作用,促使猴头菇多糖溶出效率更高。
该研究在实验室条件下通过正交试验设计为规模提取猴头菇多糖提供了一定的支撑依据。但是关于微波对复合酶的影响及底物的复合作用机制仍缺乏认知。
[1] 张素斌,黄劲峥.猴头菇多糖提取方法的比较[J].食品与发酵工业,2014,40(4):233-237
[2] 吴志明,李公斌,辛秀兰,等.猴头菇多糖的提取工艺[J].食品研究与开发,2011,32(7):36-38
[3]张树海.猴头菇多糖提取及纯化的研究[J].食品研究与开发, 2006,27(11):103-106
[4]梁华,李雪林,陆亚春.猴头菇多糖提取工艺研究[J].食品与机械, 2006,22(1):35-38
[5]赵洪梅,孙君,谢春阳.响应面优化超声波提取猴头菇多糖工艺的研究[J].农产品加工(创新版),2011(11):73-77
[6] 胡斌杰,师兆忠.超声法提取猴头菇多糖最佳工艺优化研究[J].化学世界,2009(9):557-560
[7]吴美媛,周英,何慧明,等.猴头菇多糖复合酶法提取及重金属去除工艺研究[J].食品研究与开发,2013,34(16):15-17
[8] 张帅,沈楚燕,董基.酶法提取猴头菇多糖的研究[J].河南工业大学学报(自然科学版),2010,31(2):76-79
[9] Chen S,Chen H,Tian J,et al.Enzymolysis-ultrasonic assisted extraction,chemical characteristics and bioactivities of polysaccharides from corn silk[J].Carbohydrate polymers,2014,101:332-341
[10]Zhu C,Liu X.Optimization of extraction process of crude polysaccharides from Pomegranate peel by response surface methodology[J]. Carbohydrate polymers,2013,92(2):1197-1202
[11]陈瑞平,陈瑞战,张敏,等.复合酶法提取大蒜多糖及其抗氧化活性研究[J].分子科学学报,2012,28(1):47-52
Study on Hericium erinaceus Polysaccharide Extraction by Combined-enzyme Assistant with Microwave
ZHOU Xiao-wei1,CHEN Yong-hui2,YE Ruo-song3,XIONG Yan4,LIU Hui-xin1,YE Xiao-yu1,ZHONG Rui-min1,*
(1.Yingdong College of Food Science and Technology,Shaoguan University,Shaoguan 512005,Guangdong,China;2.Jiangxi Biotech Vocational College,Nanchang 330200,Jiangxi,China;3.School of Life Science,Jiangxi Science&Technology Normal University,Nanchang 330013,Jiangxi,China;4.Institute for Quality Safety and Standards of Agricultural Products,Jiangxi Academy of Agricultural Sciences,Nanchang 330200,Jiangxi,China)
In order to achieve the promoted method of extracting Hericium erinaceus,combined-enzyme and microwave-enzymatic method was used in the technique of extracting polysaccharide from Hericium erinaceus. The results was revealed that the optimal extraction condition were:2.0%amount of enzyme,4.5 of pH value,150 min of enzymatic hydrolysis time;50℃of enzymatic hydrolysis temperature,119 W of microwave power,1∶15(g/mL)of material-liquid ratio and 150 s of microwave time,which the content of polysaccharide could reach 19.13%.
Hericium erinaceus;polysaccharide;combined-enzyme;microwave-enzymatic method
10.3969/j.issn.1005-6521.2017.10.011
2016-09-04
广东省公益研究与能力建设专项(2015A010107018);韶关学院科研项目(SY2014KJ16);韶关学院大学生创新创业训练项目(Sycxcy2016-007)
周小伟(1986—),男(汉),讲师,在读博士,研究方向:食品中天然活性成分开发及工艺研究。
*通信作者:钟瑞敏,男,教授,博士,研究方向:食品中天然产物及工艺研究。
