古尼虫草菌丝体多糖降解及体外抗氧化活性研究
2017-05-18朱振元董海燕王腾月
朱振元,董海燕,王腾月
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
古尼虫草菌丝体多糖降解及体外抗氧化活性研究
朱振元,董海燕,王腾月
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
研究了古尼虫草菌丝体多糖的提取、降解及其抗氧化活性。分别用氧化降解法、酶解法和超声降解法处理古尼虫草菌丝多糖,分析测定菌丝多糖及3种不同降解产物清除1,2-二苯代苦味肼基自由基(DPPH·)、超氧阴离子()、羟自由基(·OH)的能力,结果表明该多糖清除DPPH·、·OH能力良好。超声降解法对原糖清除DPPH·、·OH能力损失最小,且对清除DPPH·有促进作用。
古尼虫草;多糖;降解;抗氧化活性
古尼虫草[Cordyceps Gunnii(Berk.)BerK.]为麦角科(Clavicipiraceae)虫草属(Cordyceps)真菌。研究表明,虫草具有十分广泛的生理作用,包括抗病毒、抗炎、抗肿瘤、抗菌,调节免疫、降血糖、保肝护肾、影响系统性红斑狼疮及DNA酶活性[1],治疗锥虫病[2]、风湿病[3],白血病[4]、调节呼吸系统[5]、抗氧化[6-8]等。
虫草多糖是古尼虫草的重要药理成分。多糖构效关系的研究表明,多糖分子大小与其抗肿瘤活性、抗血栓活性的作用之间有显著的相关性。而且只有在一定的分子量范围内才有较高的活性。由于未降解的多糖分子量大、分子体积大、水溶性差,不利于生物吸收人体内发挥生物活性,而且若直接注人体内也有较大毒性,极大的限制了多糖的应用[9]。有关研究显示通过化学法或物理法对多糖降解,所获的一些寡糖片断仍具有生物活性,甚至生物活性明显增强[10]。降解分子量过大的多糖,增强其生物活性,是一种有效的方法,这为多糖类生物制品研发开辟了一条新途径。同时,多糖“活性片段”的研究,不仅有利于研究复杂的多糖结构及揭示结构和功能的关系,而且对多糖生物制品的药代动力学、作用机制和质量控制标准都起到重要促进作用,并在化学合成方面也有积极的借鉴作用。因此,研究多糖的降解具有十分重要的意义。目前多糖降解主要有化学降解、物理降解和酶降解法。3种降解方法各有优缺点,本文旨在寻找一种适合古尼虫草菌丝多糖降解的降解方法在力求不损伤古尼虫草菌丝多糖生物活性的前提下降低其分子量,以扩展古尼虫草菌丝多糖的应用。
1 材料与方法
1.1 材料
古尼虫草[Cordyceps gunnii(Berk.)Berk.]菌丝粉:由天津科技大学生物资源与功能食品研究室提供。
1.2 试剂与仪器
无水乙醇(分析纯)、氯仿、乙酸乙酯:天津市北方天医化学试剂厂;正丁醇、丙三醇:天津化学试剂有限公司;苯酚:天津市科密欧化学试剂开发中心;硫酸、过硫酸铵、盐酸(优级纯):天津市化学试剂三厂;丙烯酰胺、N,N-甲叉双丙烯酰胺、β-巯基乙醇、TEMED、DPPH·:Sigma Co.Ltd;溴酚蓝指示剂、冰乙酸:天津市凯通化学试剂有限公司;甘氨酸:Amresco;过氧化氢(化学纯):天津市天大化工实验厂;水杨酸、硫酸亚铁:天津市化学试剂四厂;十二烷基硫酸钠:天津市天新精细化工开发中心;甲醇:天津市四通化工厂;高温淀粉酶(20 000 U/mL):天津诺奥科技发展有限公司;邻苯三酚:贵州遵义佳宏化工有限责任公司;SephadexG-75:鼎国生物。
TGL-16C台式离心机:上海安亭科学仪器厂;SHB-Ⅲ循环水式多用真空泵:郑州长城科工贸有限公司;RE-52A旋转蒸发器:上海亚荣生化仪器厂;DZF6020型真空干燥箱:上海一恒科技有限公司;SP-2120型紫外可见分光光度计:上海光谱仪器有限公司;SHB88循环水式多用真空泵:郑州长城科工贸有限公司;LG J-0.5型台式冷冻干燥机:军事医学科学院实验仪器厂;酶标仪:Thermo Electron U.S.A旋;NDJ-1型转粘度计:上海精密科学仪器厂。
1.3 方法
1.3.1 多糖提取纯化及测定
1)多糖提取纯化流程:抽提→浓缩→乙醇静置→离心→洗涤→沉淀→干燥→虫草多糖。
2)将冻干后的粉末状多糖收集于棕色小药瓶中,命名为MPCG-50。
3)用苯酚-硫酸法分别测定上述两样品的多糖含量。
1.3.2 多糖降解产物的制备
1.3.2.1 氧化降解法
取质量分数为30%H2O2溶液2 mL于小烧杯中,加入0.4 g多糖MPCG-50,加蒸馏水定容至20 mL,在38℃条件下水浴反应3 h。反应结束后旋蒸浓缩后冻干得多糖降解产物。
1.3.2.2 酶解法
将20 000 U/mL的高温淀粉酶稀释至2 U/mL,取2mL于小烧杯中,将0.1 g多糖MPCG-50溶解在18 mL蒸馏水中,倒入小烧杯中,混合均匀在90℃条件下水浴反应40 min。反应结束后旋蒸浓缩后冻干得多糖降解产物。
1.3.2.3 超声降解法
将0.1 g多糖MPCG-50在小烧杯中溶解于50 mL蒸馏水中,制成糖液,放在超声清洗机中,功率设为49%,25℃条件下反应4 min。反应结束后旋蒸浓缩后冻干得多糖降解产物[11]。
1.3.3 多糖降解结果分析
1.3.3.1 多糖黏度的测定
准确称取不同组分多糖0.010 g,配制成50 mL溶液,即浓度为0.2 mg/mL,室温下用旋转黏度计测定其黏度。
1.3.3.2 多糖降解产物Sephadex G-75凝胶色谱柱分析
将溶胀、脱气、平衡处理后的凝胶装柱,以三蒸水作为洗脱液平衡3个~5个柱床体积,将0.1 g粗多糖溶液溶解在2 mL蒸馏水中,配制成50 mg/mL的多糖液,并上样,三蒸水洗脱,每管收集2 mL,直至将多糖全部洗脱下来。苯酚硫酸法测定各管中多糖浓度,以试管编号为横坐标,吸光度值为纵坐标做洗脱曲线,将各个峰的试管分别合并,冷冻干燥,得不同组分虫草多糖。
1.3.4 多糖降解产物抗氧化活性的研究
1.3.4.1 清除超氧阴离子
采用邻苯三酚法[12]。邻苯三酚在碱性的溶液中易发生氧化反应,生成有色中间物质和超氧阴离子,随着时间的进行,有色产物得到积累,同时超氧阴离子清除剂能减小反应体系在320 nm处的吸光度。取2.25 mL Tris-HCl缓冲液(0.05 mol/L,pH 8.2),于25℃下预热20 min,加入0.5 mL不同浓度的古尼虫草菌丝体多糖溶液和0.2 mL 25 mmol/L邻苯三酚溶液,迅速混匀后于25℃下反应,反应30 s后,于320 nm波长处测定溶液的吸光度。

1.3.4.2 清除羟自由基
本试验以Smironff[13]等的方法为基础加以改进。
在1.5 mL的离心管中分别加入6 mmol/L的FeSO4溶于100 μL,6 mmol/L的H2O2溶液100 μL,不同浓度的样品溶液100 μL,摇匀静置10 min后,分别向其中加入6 mmol/L的水杨酸溶液100 μL,摇匀静置30 min后用酶标仪于510 nm下测定各自的吸光度值Ai;扣底物组以蒸馏水代替底物水杨酸测得Aj;对照组以蒸馏水代替样品测A0。
1.3.4.3 清除1,2-二苯代苦味肼基自由基(DPPH·)[14-15]
在200 μL的5 μmol/L的DPPH·无水乙醇溶液中加入70 μL不同浓度的样品溶液,封闭,反应60 min后在517 nm波长下测吸光度Ai;以200 μL的无水乙醇与70 μL蒸馏水的混合液为空白,测其吸光度值为A0;Aj为底物吸光度值:

式中:Ai为加样反应后反应液的吸光度;Aj为以乙醇代替DPPH·反应后的吸光度(扣除底物);A0为以三蒸水代替样品的空白吸光度。
2 结果与分析
2.1 多糖及其降解产物制备与分析
2.1.1 多糖降解前的的分离纯化及分析
2.1.1.1 绘制葡萄糖标准曲线
以无水葡萄糖为标样绘制标准曲线。采用苯酚-硫酸法。用100 μg/mL标准葡萄糖作标样,蒸馏水作空白对照。

图1 葡萄糖标准曲线Fig.1 Standard curvilinear of glucose
回归方程为y=0.012 74x+0.011 58,R2=0.999 05,标准葡萄糖含量在20 μg~100 μg之间成良好的线性关系。
2.1.1.2 多糖制备
通过对100 g古尼虫草菌丝粉进行蒸馏水两次过夜浸提、去蛋白、去脂、50%和70%乙醇终浓度沉淀、冷冻干燥若干步操作后,得到浅褐色多糖MPCG-50 11.714 1 g,经全波长扫描,在280 nm处无蛋白吸收峰。根据葡萄糖标准曲线(图1)测得MPCG-50的糖含量分别为69.24%。
2.1.2 多糖降解产物的制备
2.1.2.1 氧化降解法
H2O2浓度为30 mg/mL,多糖浓度为30 mg/mL,在38℃条件下水浴反应3 h。1.2 g多糖降解后旋蒸浓缩,冻干得到多糖降解产物1.141 6 g,得率如表1所示。
2.1.2.2 酶解法
多糖溶液浓度为0.005 g/mL,加酶量为40 U/g,在90℃条件下水浴反应40 min,0.3 g多糖降解后旋蒸浓缩,冻干得到多糖降解产物0.201 0 g,得率如表1所示。
2.1.2.3 超声降解法
① 生活往往喜欢与我们开玩笑,甜美的果实有乱人心神的毒性,平坦的大道上从不缺少美丽的陷阱。② 一旦我们双眼被假象蒙蔽,沉醉在外界滥加的动听的修饰语中不可自拔,我们便会毫无例外地走向沉沦,不管你曾经有多大能耐。③ 纵横天下的西楚霸王,没几年便落得乌江自刎;自诩为上邦天国的清王朝,在一片鸦片的云雾中被人轰开大门。④ 更何况我们大多是普通人,更加难以承受生活的重压,没有几个回合便会败下阵来。⑤ 因此,始终保持谨慎是幸福人生的重要保证。⑥ 逆境中不气馁,顺境中不骄傲,还生活一个本来面目。
多糖溶液浓度为0.01 g/mL,超声功率设为49%,25℃条件下反应4 min,0.3 g多糖降解后旋蒸浓缩,冻干得到多糖降解产物0.234 9 g,得率如表1所示。
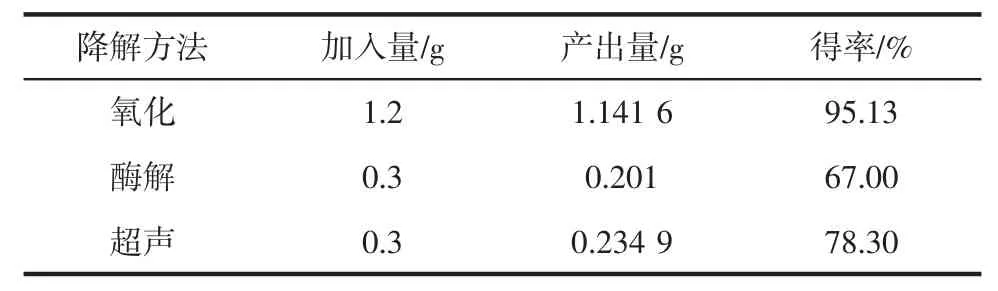
表1 不同降解方法得率Table 1 Yield of different degradation
2.1.3 多糖降解结果分析
2.1.3.1 多糖黏度的测定
黏度测定结果如表2所示。

表2 多糖的黏度Table 2 Viscosity of polysaccharide
由表2可知,与原糖相比,3种降解产物的黏度均有所降低,反映出3种降解产物的分子量有所降低,降解基本成功。
2.1.3.2 粗多糖降解产物的Sephadex G-75凝胶色谱柱分析
由图2可知,可以看出3种粗多糖降解产物的洗脱曲线出峰时间比原糖的出峰时间向后推迟。根据Sephadex G-75柱层析的原理,我们可以得知原多糖经过降解后分子量有所降低,降解基本成功。
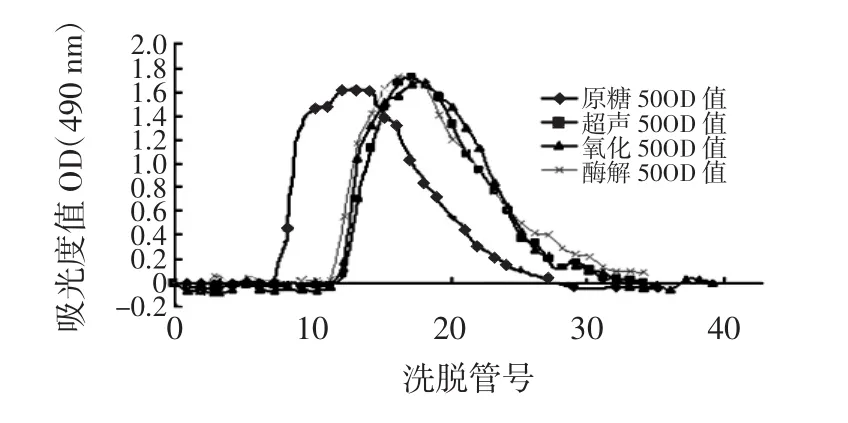
图2 多糖Sephadex G-75柱层析洗脱曲线Fig.2 The elusion carve of polysaccharide by Sephadex G-75
2.2 多糖降解产物抗氧化活性的研究
2.2.1 清除羟自由基
羟自由基的化学性质极为活泼,也是毒性最大的自由基,可以与多种有机物或无机物反应,试验结果如图3所示。

图3 MPCG-50降解前后对·OH的清除作用Fig.3 Scavenging ability of Cordyceps gunnii polysaccharide and its degraded products on·OH
由图3可知,古尼虫草多糖MPCG-50及其降解产物对羟自由的清除能力都较强,而且还均呈现出随浓度的增加而增大,达到一定浓度以后清除能力达到平衡的趋势。通过与VC进行比较,当其浓度为2 mg/mL时,清除率均在80%上下,到达6 mg/mL时,清除率均接近了100%,大于6 mg/mL后基本趋于平衡,说明大分子的MPCG-50及其较小分子的降解产物已经表现出很好的清除羟自由基能力,四者差别不大。
2.2.2 清除超氧阴离子
超氧阴离子是所有氧自由基中的第一个自由基,可以经过一系列反应生成其他氧自由基,与许多疾病有密切的联系,因此测定多糖对超氧阴离子自由基的清除作用具有重要的意义。试验结果如图4所示。
由图4所示,古尼虫草多糖MPCG-50及其降解产物对超氧阴离子的清除能力均呈现出随浓度的增加而减小的趋势。通过与VC进行比较,MPCG-50及其降解产物清除超氧阴离子自由基能力较弱,MPCG-50及其3种不同方法得到的降解产物相比较差别较大,用氧化和超声降解方法得到的降解产物几乎表现不出对超氧阴离子自由基的清除能力,酶解法获得的降解产物的清楚能力相对MPCG-50原糖稍强。

图4 MPCG-50降解前后对的清除作用Fig.4 Scavenging ability of Cordyceps gunnii polysaccharide and its degraded products on
2.2.3 清除1,2-二苯代苦味肼基自由基(DPPH·)
大多数自由基化学性质极为活泼,寿命极短。然而也有少数的自由基如二苯代苦味肼基自由基(DPPH·)的化学性质十分稳定[16]。因此其常用来检验物质的抗氧化性。试验结果如图5所示。

图5 MPCG-50降解前后对DPPH·的清除作用Fig.5 Scavenging ability of Cordyceps gunnii polysaccharide and its degraded products on DPPH·
由图5所示,MPCG-50原糖、氧化降解法和超声降解法获得的降解产物对DPPH·的清除能力在一定浓度范围内随着多糖浓度的增加而增大,达到一定浓度以后清除能力开始下降。其中酶解法和氧化法所得降解产物清除DPPH·的能力在大于8 mg/mL的高浓度区域内又有所回升,但其清除能力均小于原糖。综合来看,超声降解产物对DPPH·的清除活性比原糖要高;当MPCG-50原糖浓度为8 mg/mL时,清除率达到了69.3%,大于8 mg/mL后开始下降;当超声降解产物浓度到达10 mg/mL时,清除率达到了87.5%,大于10 mg/mL后开始有所下降。
3 结论
比较MPCG-50原糖及其用3种不同方法获得的降解产物清除DPPH·、O2-·、·OH的能力,可以看出该多糖具有很好的抗氧化效果,清除DPPH·、·OH能力显著。对DPPH·的清除能力方面,超声降解法所得降解产物的清除效果最为显著,与原糖相比有所提高。由于超声降解多糖产物与MPCG-50原糖及其他方法降解产物相比黏度明显降低,可认为该产物分子量与其他降解产物相比较小。因此,采用超声法降解古尼虫草菌丝多糖效果比较理想,既能达到降低MPCG-50原糖分子量的目的,又可以最大程度的保持原糖的抗氧化活性。
[1] R Russell M Paterson.Cordyceps-a traditional Chinese medicine and another fungal therapeutic biofactory[J].Phytochemistry,2008,69 (7):1469-1495
[2] Vodnala S K,Ferella M,Lunden-Miguel H,et al.Preclinical assessment of thetreatment of second-stage African trypanosomiasis with cordycepin and deoxycoformycin[J].PLoS NeglectedTropical Diseases,2009,3(8):e495
[3] Noh E M,Kim J S,Hur H,et al.Cordycepin inhibits IL-1β-induced MMP-1 and MMP-3expression in rheumatoid arthritis synovial fibroblasts[J].Rheumatology,2009,48:45-48
[4] 康冀川,康超,文庭池,等.虫草菌素药理学研究进展[J].菌物学报, 2011,30(2):191-197
[5] Tuli H S,Sandhu S S,Sharma A K.Pharmacological and therapeutic potential of Cordyceps with special reference to Cordycepin[J].3 Biotech,2014,4(1):1-12
[6] Zhu Z Y,Si C L,Zhong Y R.The purification and antioxidative activities inD-galactose-induced aging mice of a water-solublepolysaccharide from Cordyceps gunnii(berk.)Berk.mycelium[J].Journal of Food Biochemistry,2011,35(1):303-322
[7] Zhu Z Y,Yuan J,Li S F,et al.Preparation of sulfured polysaccharides from Cordyceps gunnii and itsanti-oxidation activity[J].Modern Food Science andTechnology,2011,27(1):1-5
[8] Zhu Z Y,Si C L,Zhang Y M.Purification and antioxidative activities of a water-soluble polysaccharide isolated from Cordyceps gunnii (berk.)Berk[J].mycelium Planta Medica,2009,75(9):PC15
[9] 陈蕾,吴皓.多糖降解方法的研究进展[J].中华中医药学刊,2008, 26(1):133-135
[10]肖建辉,梁宗琦,胡锡阶,等.古尼虫草多糖及其解聚物的免疫活性[J].免疫学杂志,2005,21(1):51-53,58
[11]刘梅,陈必链,陈伟平.超声波降解紫球藻胞外多糖研究[J].亚热带植物科学,2008,37(l):48-50
[12]LI S P,SU Z R,DONG T T X,et al.The fruiting body and its host of Cordyceps sinensis show close resemblance in main constituents and anti-oxidation activity[J].Phytomedicine,2002(9):319-324
[13]Smirnoff N,Cumbes Q J.Hyroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060
[14]成兰英,梁书凤,张治强.DPPH法研究麦冬提取物抗氧化活性[J].精细化工,2012,29(9):870-874
[15]Joan H Y,Hsiu C L,Jeng L M.Antioxidant properties of several commercial mushrooms[J].Food Chemistry,2002,77:229-235
[16]韦献雅,殷丽琴,钟成,等.DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322
Degradation of Cordyceps gunnii Polysaccharide and Antioxidation of Its Degraded Products
ZHU Zhen-yuan,DONG Hai-yan,WANG Teng-yue
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Science and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China)
The polysaccharide from Cordyceps gunnii mycelia was separated and purified,and the preparation and antioxidant activity of its degraded products were discussed.Polysaccharides from Cordyceps gunnii mycelia prolifera were prepared in our laboratory and degraded with three different ways.The polysaccharides from Cordyceps gunnii mycelia prolifera was named MPCG-50.The ability of removing DPPH·,,·OH of MPCG-50 and degraded products which were obtained by three different methods was determined.The results showed that the polysaccharide had a good antioxidant ability.But the ability of removing DPPH·,was changed compared with MPCG-50.The degraded products of ultrasonic degradation changed a little and it′s positive.
Cordyceps gunnii;polysaccharide;degradation;antioxidant activity
10.3969/j.issn.1005-6521.2017.10.001
2016-08-23
国家星火计划重点项目(2015GA610001);天津市自然科学基金重点项目(16JCZDJC34100)
朱振元(1969—),男(汉),教授,博士,研究方向:生物资源与功能食品。
