合并脑微出血的脑梗死病人出血转化的风险性研究
2017-05-18鲁建华
鲁建华
合并脑微出血的脑梗死病人出血转化的风险性研究
鲁建华
目的 探讨合并脑微出血(cerebral microbleed,CMB)的脑梗死病人急性期和恢复期出血转化的风险及可能原因。 方法 收集我院合并脑CMB的脑梗死病人160例(有CMB组),以及无CMB的脑梗死病人180例(无CMB组),通过比较2组急性期和恢复期出现脑出血的不同发生率,探讨CMB对脑梗死出血转化的影响。 结果 在脑梗死急性期病人中,2组出血的发生率差异无统计学意义(P>0.05);而对于恢复期的病人,有CMB组病人出血的发生率较高(P<0.05)。恢复期服用阿司匹林病人中,合并CMB病人脑出血的发生率明显高于无CMB组(16.3%比6.7%,P<0.05) 结论 CMB可增加脑梗死恢复期病人出血的发生率,尤其是那些服用阿司匹林的病人。CMB可能是一种逐渐进展的脑微血管病。
脑梗死; 脑微出血; 出血转化
脑微出血(cerebral microbleed,CMB)是一种独特的脑微小血管病变,常见于脑出血病人,也存在于缺血性脑血管病病人。近年来,随着磁敏感加权成像(SWI)的应用,CMB的检出率大大提高,特别是在脑梗死病人中[1]。随之而来的问题是这部分缺血性脑卒中病人今后是否更容易出现脑出血转化,溶栓、抗血小板、抗凝药物治疗是否会增加CMB病人出血转化的风险。脑梗死出血转化主要发生在急性期,而恢复期也有很大一部分病人并发脑出血。本研究旨在探讨脑梗死不同时期并发出血与CMB的相关性,为卒中的诊治及预防提供更多的临床依据。
1 资料及方法
1.1 一般资料 收集2012年1月至2014年6月在咸宁市中心医院神经内科住院,经头颅MRI+SWI证实合并CMB的脑梗死病人160例(有CMB组),年龄61~75岁,平均(70.7±3.6)岁;未合并CMB的脑梗死病人180例(无CMB组),年龄60~72岁,平均(65.2±4.4)岁,所有病人均排除脑外伤、脑肿瘤、脑血管畸形等疾病。急性脑梗死分为动脉粥样硬化性血栓形成(90例)、心源性脑栓塞(76例)、小动脉性脑梗死(174例),其他原因脑梗死未列入本次研究。
1.2 研究方法
1.2.1 记录病人一般临床资料:年龄、性别、高血压、糖尿病、高血脂、房颤病史、吸烟史、饮酒史,并记录症状、体征、影像学资料、口服药物。对2组病人均分为急性期(发病3周内)和恢复期(发病3周后至1年半)两阶段研究。急性期内,采取静脉溶栓及常规药物治疗。恢复期主要采用口服药物治疗,所有病人随访12~18月,记录经CT证实颅内并发出血病人,排除随访期间存在脑外伤、脑肿瘤、血液病、酗酒以及失访和死亡的病人。
1.2.2 影像学检查:美国GE公司1.5T SingaHDx MRI,常规行MRI+SWI,由一位经验丰富的影像科医生阅片。CMB在SWI序列上定义为质地均一、直径2~10 mm类圆形低信号缺失,排除血管流空、海绵状血管瘤等。根据CMB所在部位分为皮质-皮质下区、基底节/丘脑区、幕下区,并分别予以计数。按照CMB数目的多少,通常将CMB分为4级:1级(无CMB);2级,轻度(CMB 1~2个);3级,中度(CMB 3~10个);4级,重度(CMB>10个)。

2 结果
2.1 2组脑梗死病人相关临床资料比较 与无CMB组病人比较,有CMB组病人以腔隙性脑梗死(腔梗)居多(P<0.05),年龄较大,合并高血压的比例更高(P<0.05),而2组在性别、糖尿病、高血脂及饮酒史方面差异无统计学意义(P>0.05)。见表1。
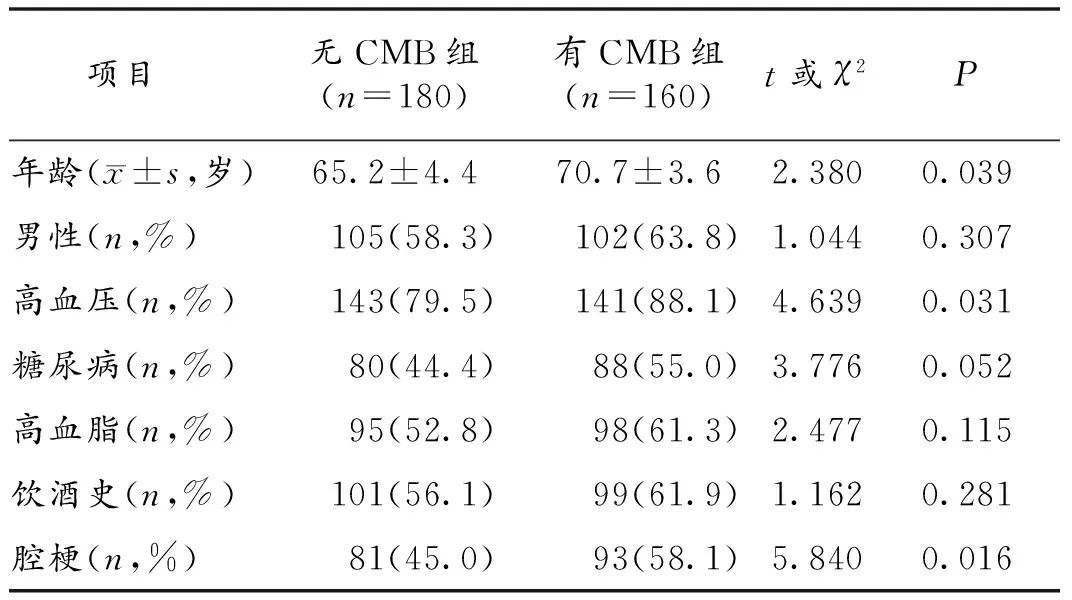
表1 2组脑梗死病人相关临床资料比较
2.2 2组病人急性期出血转化的比较 对于脑梗死急性期病人,无CMB组出血率为10.0%(18/180),有CMB组出血率为15.0%(24/160),2组出血率差异无统计学意义(P>0.05)。脑梗死急性期脑出血主要见于静脉溶栓后出血以及房颤病人并发的出血转化,无论是在无CMB组还是在有CMB组,2组间比较差异均有统计学意义(P<0.05)。见表2。
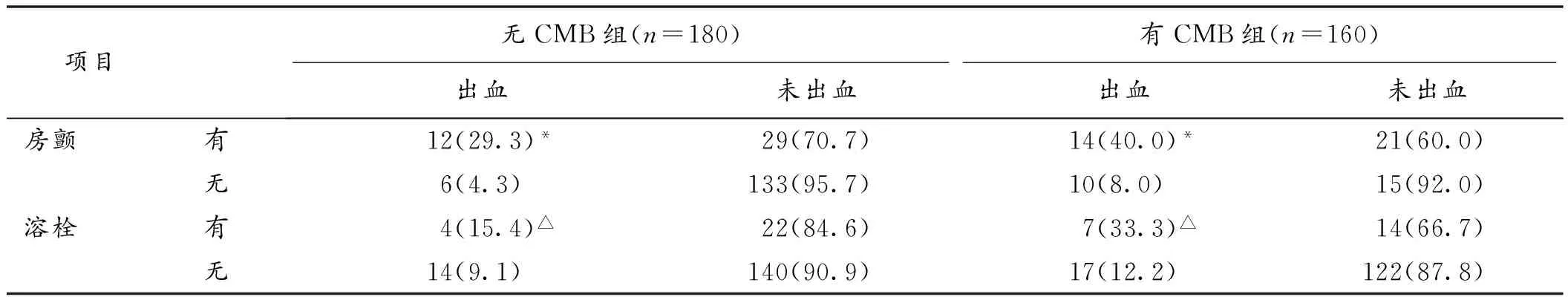
表2 2组脑梗死急性期并发脑出血概率的比较(n,%)
注:与无房颤者比较,*P<0.05;与无溶栓者比较,△P<0.05
2.3 2组病人恢复期出血转化的比较 对于脑梗死恢复期病人,无CMB组出血率为6.1%(11/180),有CMB组出血率为11.9%(19/160),有CMB组病人脑出血发生率较高(P<0.05),尤其是那些服用阿司匹林的病人(P<0.05),而在使用抗凝药物的病人之中,2组间比较差异均无统计学意义(P>0.05)。见表3。

表3 2组脑梗死病人恢复期并发脑出血率的比较(n,%)
注:亚组内比较,*P<0.05
3 讨论
CMB是一种有出血倾向的微小血管病变,与脑梗死及脑出血间的复杂关系目前尚未完全明确,特别是CMB与脑梗死不同时期出血转化方面的研究甚少。
既往的临床研究资料显示,CMB与高龄、高血压、腔隙性脑梗死及脑白质病变密切相关[2]。我们在对一般临床资料的研究中发现,存在CMB脑梗死病人以小动脉性脑梗死居多,高龄、高血压的病人比例显著高于无CMB组(P<0.05),而男性、糖尿病、高血脂等卒中危险因素与CMB关系不大(P>0.05)。这进一步证实了高龄、高血压、腔隙性脑梗死可能是CMB发生的常见原因,而高龄、高血压也是卒中常见的危险因素。高血压和高龄病人易出现微小血管病变及腔隙性脑梗死,而CMB可能是严重小血管病变的标志[3]。CMB主要分布在皮质-皮质下和基底节等小血管分布丰富的区域,其发病率随着年龄增加而增长[4]。本研究中,CMB主要分布在皮质-皮质下及基底节区,并发出血病人CMB分级多在3级及以上,出血部位亦多在皮质及基底节区。对于老年病人,特别是高龄和高血压病人,易出现高血压动脉病和脑淀粉样血管病,在皮质-皮质下区血管可发生不同程度的淀粉样变性或纤维玻璃样变性,而基底节区由于高血压性动脉病变,可形成细小的动脉瘤或者囊状的动脉壁扩张,最终血管壁的完整性遭到破坏,增加了其渗透性,易发生血管渗漏现象,这可能是CMB和脑梗死出血转化共同的病理生理基础[3]。
CMB与脑出血高度相关,两者间存在一个出血体积转化阈值,当CMB体积达到一定的程度,就会向脑出血方向转变[5]。对于存在CMB的急性脑梗死病人能否进行溶栓目前还没有公认的指南。本研究中,静脉溶栓和房颤是急性脑梗死出血转化的常见原因,由于缺血后血管壁损伤、血脑屏障破坏以及再灌注损伤,易发生出血转化。然而,我们的观察结果发现,在脑梗死急性期,有CMB组和无CMB组病人出血率无明显差异,无论是溶栓后并发的出血,还是房颤病人并发的出血。这表明,CMB并没有增加急性脑梗死出血转化的风险。因此,对于合并CMB的急性脑梗死病人,我们不必过多担心其出血风险而放弃静脉溶栓以及抗凝治疗。
我们对所有脑梗死病人随访了1~1.5年,发现一部分无CMB脑梗死病人出现CMB,大部分有CMB脑梗死病人的CMB病灶较前有所增加,CMB分级达到中重度者居多,合并CMB的病人出现再出血的比例较高(P<0.05),尤其是那些坚持服用阿司匹林的病人(P<0.05),而在使用抗凝药物的病人之中,没有发现和CMB有相关性(P>0.05)。这表明CMB可能是一种逐渐进展的脑微血管病。最新的一项荟萃分析显示,合并CMB脑梗死病人继发颅内出血的危险性随着CMB病灶数目的增多而增加,特别是当CMB病灶≥5个时尤为明显[6]。对于脑梗死病人应用抗血小板药物治疗是否会增加CMB风险,到目前还没有一个定论。我们的观察结果表明,抗血小板治疗增加了CMB的发病率,对于有CMB脑梗死病人,阿司匹林有可能参与或影响了CMB的进一步病理生理变化,进而导致脑梗死出血转化风险增加,华法林在这方面的作用则不明显。这也提示我们,对于合并CMB的脑梗死病人,特别是CMB分级中度以上的高龄病人,在抗血小板治疗方面应予以密切观察。
不过由于本研究的病例数和区域限制,此研究结果仍需要大规模的前瞻性研究,对CMB和脑梗死出血转化间的关系有待进一步的深入探讨。对合并CMB的急性脑梗死病人,特别是老年病人应予以高度重视,并加强脑梗死恢复期的随访和监控。
[1] 王秀玲,汪泓,沈为林,等.MR磁敏感成像在脑卒中病人脑微出血诊断中的价值[J].实用老年医学,2010,24(6):489-492.
[2] 张斌,张淑玲,付胜奇,等.急性脑梗死合并脑微出血的危险因素分析[J].中国实用神经疾病杂志,2016,19(14): 67-69.
[3] Jia Z, Mohammed W, Qiu Y,et al.Hypertension increases the risk of cerebral microbleed in the territory of posterior cerebral artery: a study of the association of microbleeds categorized on a basis of vascular territories and cardiovascular risk factors[J]. J Stroke Cerebrovasc Dis,2014,23(1):e5-11.
[4] Yang Q, Yang Y, Li C, et al. Quantitative assessment and correlation analysis of cerebral microbleed distribution and leukoaraiosis in stroke outpatients[J].Neurol Res, 2015,37(5):403-409.
[5] Greenberg SM,Nandigam RN,Delgado P,et al.Microbleeds versus macrobleeds:evidence for distinct entities[J].Stroke,2009,40(7):2382-2386.
[6] Wilson D, Charidimou A, Ambler G,et al. Recurrent stroke risk and cerebral microbleed burden in ischemic stroke and TIA: A meta-analysis[J]. Neurology, 2016,87(14):1501-1510.
Relationship between hemorrhagic transformation after acute cerebral infarction and cerebral microbleed
LUJian-hua.
DepartmentofNeurology,XianningCentralHospital,theFirstHospitalAffiliatedtoHubeiUniversityofScienceandTechnology,Xianning437000,China
Objective To investigate the incidence rate and risk factors of hemorrhagic transformation after acute cerebral infarction during acute phase and convalescence phase. Methods 180 patients without cerebral microbleed(CMB) were enrolled as non-CMB group, and 160 patients with CMB were selected as CMB group.The incidence rate in different stage were compared between two groups, and the effect of CMB on hemorrhage transformation in patients with cerebral infarction was observed. Results There was no significant difference in the incidence rate of hemorrhagic transformation at acute phase between two groups(P>0.05).But at convalescence phase, the incidence rate of hemorrhagic transformation in CMB group was significantly higher than that in non-CMB group(P<0.05). Conclusions CMB may increase the incidence rate of hemorrhagic transformation in patients with cerebral infarction during convalescence phase,especially for those patients who are taking aspirin. CMB is likely to be a gradual progress of cerebral microvascular disease.
ischemic infarction; cerebral microbleed; hemorrhage transformation
437100湖北省咸宁市,咸宁市中心医院 湖北科技学院附属第一医院神经内科
R 743.3
A
10.3969/j.issn.1003-9198.2017.04.023
2016-05-26)
