结直肠癌组织中Gα蛋白i亚基的表达及临床意义
2017-05-18严君君胡瑶曾晓宁周希乔
严君君 胡瑶 曾晓宁 周希乔
结直肠癌组织中Gα蛋白i亚基的表达及临床意义
严君君 胡瑶 曾晓宁 周希乔
目的 研究Gα蛋白i亚基(Gαi)在结直肠癌组织中的表达及其临床意义。 方法 50例结直肠癌肿瘤及对应切缘正常组织标本,采用定量即时聚合酶链式反应(QRT-PCR)法检测肿瘤及切缘正常组织中Gαi1、Gαi2、Gαi3 mRNA表达水平差异;蛋白印迹(Western blot)法以及免疫组化法对蛋白表达情况进行检测,分析与Gαi1、Gαi2、Gαi3表达情况相关的因素,并探讨其表达与病理组织分型及预后之间的相关性。 结果 结直肠癌组织Gαi1、Gαi2、Gαi3 mRNA 及蛋白的表达均明显低于配对的切缘正常组织(P<0.05)。免疫组化检测结果显示,与配对的癌旁正常组织比较,结直肠癌组织中Gαi1、Gαi2、Gαi3表达明显下调(P<0.05)。单因素分析显示,肿瘤T分级越差(χ2=4.919,P=0.027),TNM分期越高(χ2=7.284,P=0.007),肿瘤分化程度越差(χ2=6.826,P=0.033),伴淋巴结转移的病人(χ2=4.468,P=0.035),其癌组织Gαi2的表达水平越低。 结论 结直肠癌组织中Gαi表达下调,其中Gαi2的表达与肿瘤T分级、TNM分期、淋巴结转移呈负相关,与肿瘤分化程度呈正相关,而与年龄、性别以及神经转移与否无关。
结直肠癌; Gα蛋白i亚基; 表达
结直肠癌是全球最常见恶性肿瘤之一,占新发肿瘤病例的8%,仅次于肺癌及生殖系统恶性肿瘤[1]。随着对其高危因素的不断认识及结直肠内镜筛查技术的逐渐普及,结直肠癌病人5年生存率稍有升高,但其死亡率仍高达8.3%。研究表明异三聚体鸟苷酸调节蛋白(G蛋白)信号通路在肿瘤的发生发展中起重要作用[2-3]。Gα蛋白i亚基的功能缺失与突变可影响上皮细胞的代谢与生长[4-5]。本研究利用定量即时聚合酶链式反应(QRT-PCR)、免疫组织化学染色及Western blot 等方法,检测肠癌及配对切缘正常组织中Gα蛋白i亚基的表达,进一步分析临床病理与Gα蛋白i亚基表达的相关性及其对预后的影响。
1 资料和方法
1.1 临床资料 收集50例南京医科大学附属第一临床医学院于2010年1月至2016年10月期间行结直肠癌切除术病人新鲜肿瘤及对应切缘正常组织标本,术前未经过任何放疗和化疗,且经病理科检验证实。新鲜标本收集后部分经-80 ℃液氮迅速冻存,剩余部分标本立即经10%福尔马林固定以备后期检测。标本来源的病人中,男27例,女23例,平均年龄(61.00±14.48)岁。
1.2 方法
1.2.1 QRT-PCR:应用TaKaRa试剂盒提取肿瘤组织总RNA,测定RNA浓度及纯度。反转录扩增反应体系中, 20 μl含总RNA 1000 ng、5×PrimeScript RT Master Mix以及RNase Free H2O,冰上配置,混匀,37 ℃反应15 min,85 ℃反应5 s,最后4 ℃取出。目的基因Gαi1、Gαi2、Gαi3及内参照GAPDH引物(HQP007747、HQP007748、HQP007749、HQP006940)均由广州复能基因有限公司合成并提供。以cDNA为模板扩增目的基因和内参照, 10 μl体系中含2×SYBR® Premix Ex Taq 5 μl,cDNA模板1 μl,上下游混合引物1 μl,RNase Free H2O 3 μl。反应条件:预变性(1个循环)95 ℃ 30 s;PCR 反应(40个循环)95 ℃ 5 s,60 ℃ 30~34 s。2^-ΔΔCT法比较mRNA表达差异。
1.2.2 免疫组化染色:兔抗人 Gαi1、Gαi2、Gαi3多克隆抗体(sc-391 、sc-7276 、sc-262)购自美国 santa cruz公司。氨基联苯胺(DAB)显色试剂盒购自DAKO公司。取石蜡包埋标本,切片,二甲苯脱蜡、梯度酒精脱水。EDTA抗原修复缓冲液(pH 9.0)进行抗原修复,PBS冲洗;3%过氧化氢处理,室温避光孵育25 min,PBS冲洗;滴加正常封闭血清,室温孵育30 min,倾去多余液体,滴加相应的第一抗体工作液(阴性对照采用PBS),湿盒内4 ℃孵育过夜;PBS冲洗,倾去多余液体,滴加生物素标记的第二抗体室温孵育50 min, PBS冲洗;滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色;苏木素轻度复染3 min,梯度酒精脱水,二甲苯透明,中性树胶封固。苏木素复染核为蓝色,DAB显出的阳性表达为棕黄色。Gαi低表达指着色深度低于正常组织,Gαi高表达指着色深度高于正常组织。
1.2.3 Western-blot:取10 mg组织,液氮研磨,加入含PMSF的RIPA裂解液200 μl,冰上超声破碎组织若干次,4 ℃,12 000 r/min,离心2 min,吸取上清,BCA法测蛋白浓度,取等量蛋白,加入5×SDS上样缓冲液混匀,100 ℃变性5 min。配制10%的分离胶和5%的积层胶,蛋白上样30 μg,SDS-PAGE垂直凝胶电泳,PVDF膜横流250 mA湿转110 min,5%脱脂牛奶封闭1 h,一抗4 ℃孵育过夜。取出PVDF膜,TBST清洗3次,每次5 min;辣过氧化物酶标记Ig-G二抗,室温孵育1 h,洗膜,ECL化学发光试剂盒检测蛋白表达,应用Image Lab软件半定量分析特异性条带灰度值。

2 结果
2.1 结直肠癌及切缘正常组织中Gαi的表达 QRT-PCR法检测结果显示,结直肠癌组织中Gαi1(t=4.400,P<0.05)、Gαi2(t=4.726,P<0.01)、Gαi3(t=6.556,P<0.01)mRNA水平相对于配对切缘正常组织表达明显下调,且差异有统计学意义,见图1。
2.2 免疫组化检测结果 结直肠癌组织中Gαi的表达明显低于配对切缘正常组织,Gαi阳性表达最明显区域位于细胞膜及细胞质中,呈现为棕黄或棕褐色。相对于配对切缘正常组织,结直肠癌组织中仅有少量表达。见图2。

注:与正常切缘比较,*P<0.05,**P<0.01图1 2种组织中Gαi mRNA的表达(n=50)
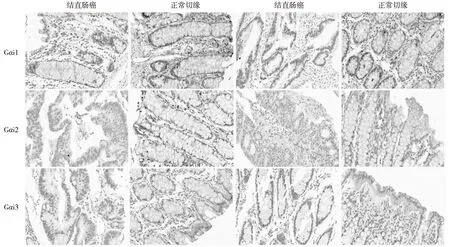
图2 2种组织中Gαi的免疫组化染色(×400)
2.3 蛋白质印迹检测结果 24例(48%)病人肿瘤组织中Gαi1表达低于正常切缘;30例(60%)病人肿瘤组织中Gαi2表达低于正常切缘;31例(62%)病人肿瘤组织中Gαi3表达低于正常切缘;结直肠癌组织中Gαi2和Gαi3蛋白相对于Gαi1下降比例更高,与QRT-PCR结果略有差异,但大体趋势一致,可能与病人基因翻译个体差异有关,见图3。
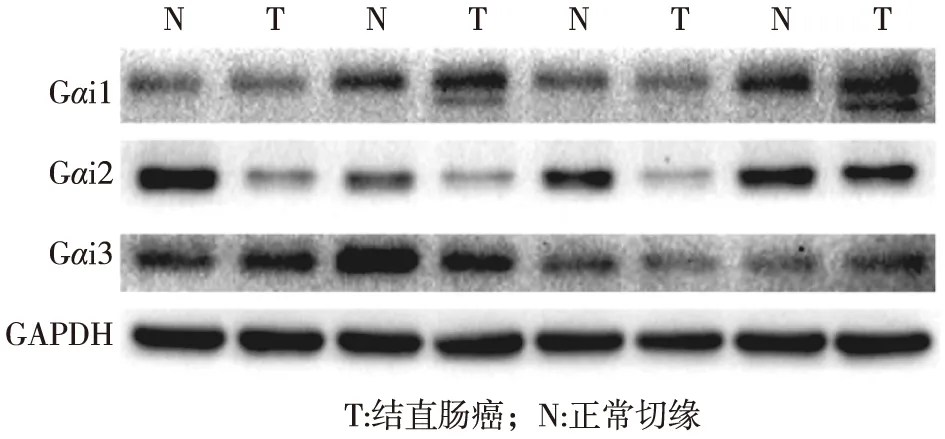
图3 蛋白印迹法检测结直肠癌中Gαi的表达
2.4 Gαi2表达与临床病理参数的关系 肿瘤T分级越差,TNM分期越高,肿瘤分化程度越差,淋巴结转移的病人,其Gαi2的表达水平越低,而与年龄、性别以及神经转移与否无关。见表1。
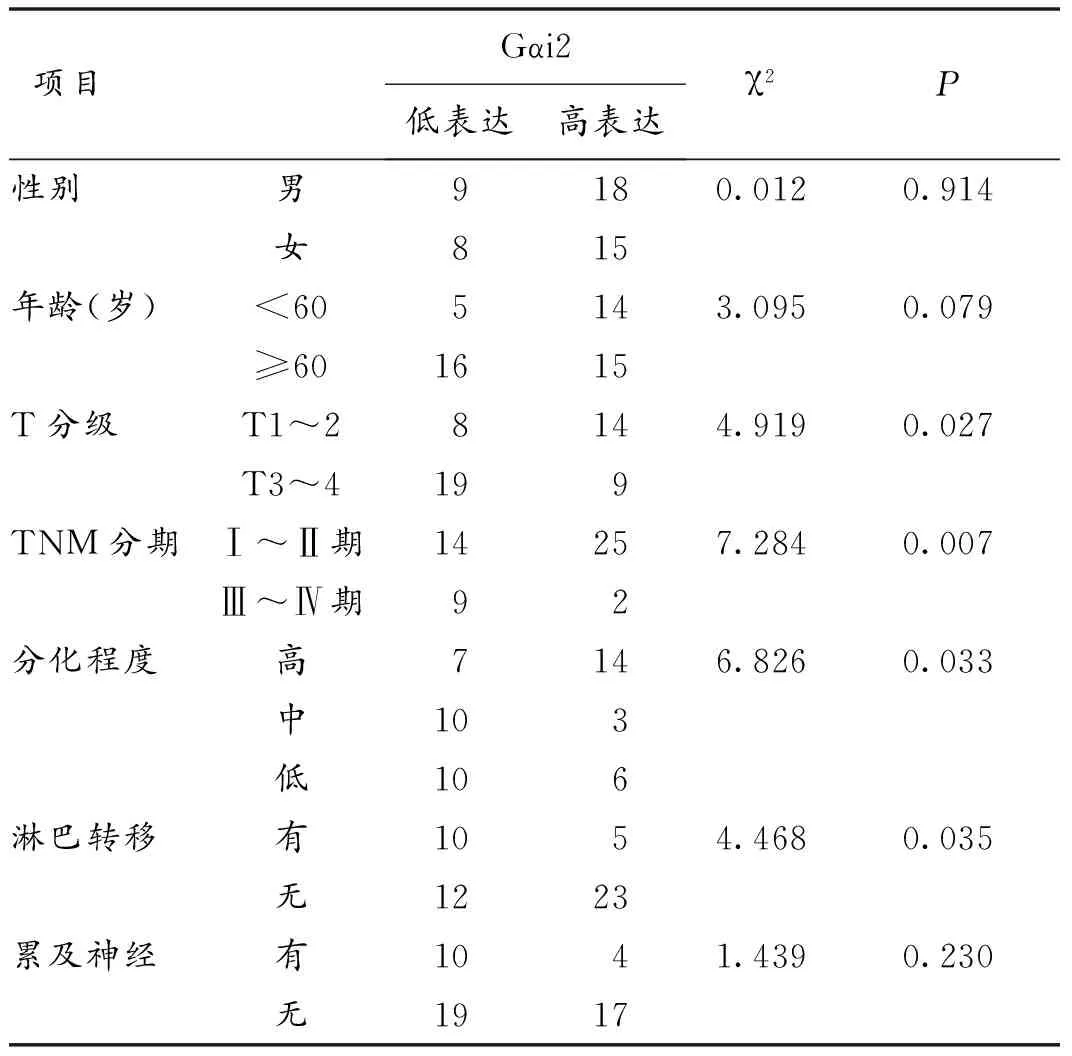
表1 Gαi2的表达与病人临床病理参数间的关系(n,n=50)
3 讨论
G蛋白偶联受体(GPCR)广泛表达于哺乳动物细胞表面,与配体结合后,偶联下游异三聚体G蛋白发生变构,从而活化胞内特异性信号通路调控细胞各项生命活动[6]。G蛋白位于细胞膜内表面,是GPCR与胞内效应器链接的重要桥梁。Gαi自发现以来不断受到人们的关注, Gαi最初被称为抑制性G蛋白,包括Gαi1、Gαi2、Gαi3 3种密切相关的成员,活化后能够抑制腺苷酸环化酶活性[7]。Gαi缺陷或基因突变能够影响上皮顶突凋亡、调节细胞免疫自噬及细胞骨架重构等多种生物学行为[5, 8-9]。Gαi与循环、神经及肿瘤等多种疾病的发生发展关系密切[3],然而在肿瘤领域,尤其是结直肠癌领域目前仍处于初步探索阶段[10]。Edwards等[11]、Gotlind等[12]研究发现,抑制小鼠Gαi2基因可诱发肠炎甚至可进展为相关性肠癌。在结直肠癌病人中可能存在Gαi亚基的功能缺失或表达,且很有可能影响肿瘤的进展及病人的预后[13]。
为进一步确认Gαi表达与老年结直肠癌的关系,此研究首先利用QRT-PCR、Western blot及免疫组化等方法,分别从mRNA水平、蛋白质水平综合全面地分析和评估Gαi亚基的表达水平。QRT-PCR结果显示,在mRNA水平上,正常切缘主要表达Gαi2、Gαi3基因及少量Gαi1,肿瘤组织中Gαi1、Gαi2、Gαi3显著下调。在一定程度上反映了Gαi在肠癌中的表达情况。然而作为胞内重要的信号转导分子,Gαi亚基以蛋白的形式发挥其生物学功能。为进一步探究Gαi亚基在肠癌中的表达情况,此研究应用Western blot检测蛋白水平上Gαi亚基的表达差异。结果显示,蛋白质水平上肿瘤组织中Gαi2、Gαi3下调的病人占总数60%或以上,而相对而言,在肿瘤组织中Gαi1下调的例数并不明显,提示肿瘤病人体内主要表现为Gαi2、Gαi3亚基的下调。
随后通过对50例病人临床资料的进一步采集,并结合免疫组化染色结果进行相关分析,结果显示Gαi2的表达在老年人群中表达无明显统计学差异(P=0.079),肿瘤T分期越差,TNM分期越高,肿瘤分化程度越差,淋巴结转移的病人,其Gαi2的表达水平越低。Gαi2的下调可能通过影响T分级、TNM分期、分化程度及淋巴转移进而影响病人预后及生存期。
在此后的研究中将需要扩大样本例数,完善细胞及动物实验以明确Gαi在结直肠癌发生发展中的具体作用及机制。
[1] Hayat MJ, Howlader N, Reichman ME, et al. Cancer statistics, trends, and multiple primary cancer analyses from the Surveillance, Epidemiology, and End Results (SEER) Program[J]. Oncologist, 2007,12(1):20-37.
[2] 曹静, 王涛. G蛋白信号传导调控因子17在肝癌细胞中的表达及意义[J]. 山东医药, 2012,52(7):43-44.
[3] 彭云, 崔磊, 史坚强, 等. G蛋白信号调节蛋白2在胰腺癌组织中的表达及临床意义[J]. 江苏大学学报:医学版, 2016,26(3):231-234, 239.
[4] Rudolph U, Finegold M, Rich SS, et al. Ulcerative colitis and adenocarcinoma of the colon in Galphai2-deficient mice[J]. Nat Genet, 1995,10(2):143-150.
[5] Villanueva H, Visbal AP, Obeid NF, et al. An essential role for Galpha(i2) in Smoothened-stimulated epithelial cell proliferation in the mammary gland[J]. Sci Signal, 2015,8(394): 449-452.
[6] Syrovatkina V, Alegre KO, Dey R, et al. Regulation, signaling, and physiological functions of g-proteins[J]. J Mol Biol, 2016,428(19):3850-3868.
[7] Carpenter B, Tate CG. Engineering a minimal G protein to facilitate crystallisation of G protein-coupled receptors in their active conformation[J]. Protein Engineering Design & Selection Peds, 2016,29(12):583-594.
[8] Alvarez-Curto E, Inoue A, Jenkins L, et al. Targeted elimination of G proteins and arrestins defines their specific contributions to both intensity and Duration of G protein-coupled receptor signalling[J]. J Biol Chem, 2016,291(53):27147-27159.
[9] Hamada N, Negishi Y, Mizuno M, et al. Role of a heterotrimeric G-protein, Gi2, in the corticogenesis: Possible involvement in periventricular nodular heterotopia and intellectual disability[J]. J Neurochem, 2016,140(1):82-95.
[10]刘敏, 董卫国, 王静, 等. G蛋白偶联受体56在结肠癌组织中的表达及临床意义[J]. 武汉大学学报:医学版, 2014,35(2):255-258.
[11]Edwards RA, Witherspoon M, Wang K, et al. Epigenetic repression of DNA mismatch repair by inflammation and hypoxia in inflammatory bowel disease-associated colorectal cancer[J]. Cancer Res, 2009,69(16):6423-6429.
[12]Gotlind YY, Fritsch FM, Kumawat AK, et al. Interplay between T(h)1 and T(h)17 effector T-cell pathways in the pathogenesis of spontaneous colitis and colon cancer in the Galphai2-deficient mouse[J]. Int Immunol, 2013,25(1):35-44.
[13]Corre I, Hermouet S. Regulation of colony-stimulating factor 1-induced proliferation by heterotrimeric Gi2 proteins[J]. Blood, 1995,86(5):1776-1783.
Expression and clinical significance of Gαi protein in human colon carcinoma
YANJun-jun,ZHOUXi-qiao.DepartmentofGastroenterology;HUYao.
CenterofPET/CT;ZENGXiao-ning.DepartmentofRespiratory&CriticalCareMedicine,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China
Objective To investigate the expression of Gαi in human colon carcinoma and to determine its clinical significance. Methods QRT-PCR was used to detect the Gαi1、Gαi2、Gαi3 mRNA in 50 colon carcinoma and pared adjacent non-cancerous tissue, western blot was used to detect the expression of Gαi1、Gαi2、Gαi3 protein. The relationship between the expression of Gαi1、Gαi2、Gαi3 and the clinicopathological parameter and prognosis of these patients were analyzed by immunohistochemistry. Results The expression levels of Gαi1、Gαi2、Gαi3 mRNA and protein in colon carcinoma were lower than those in normal tissue (P<0.05). Immunohistochemistry results showed that Gαi1、Gαi2、Gαi3 expression was significant down-regulated in colon carcinoma tissue (P<0.05). Low expression Gαi2 was associated with larger tumor size(χ2=4.919,P=0.027), TNM stage(χ2=7.284,P=0.007)and lymphatic metastasis(χ2=4.468,P=0.035), as well as poor tumor differentiation(χ2=6.826,P=0.033). Conclusions The down-regulated expression of Gαi1、Gαi2、Gαi3 in colon carcinoma tissue is closely relate to T stage, TNM stage and poor tumor differentiation.
colon carcinoma; Gαi; expression
国家自然科学基金项目(81570522,81100274)
210029江苏省南京市,南京医科大学附属第一临床医学院消化科(严君君,周希乔);PET/CT科(胡瑶);呼吸与重症医学科(曾晓宁)
周希乔,Email: Xiqiao_Zhou@126.com
R 735.35
A
10.3969/j.issn.1003-9198.2017.05.007
2016-11-25)
