老年与中青年病人金黄色葡萄球菌的分布及耐药性对比分析
2017-05-18于波心黄婷婷刘丹王佳贺
于波心 黄婷婷 刘丹 王佳贺
老年与中青年病人金黄色葡萄球菌的分布及耐药性对比分析
于波心 黄婷婷 刘丹 王佳贺
目的 探讨老年与中青年病人金黄色葡萄球菌(SAU)和耐甲氧西林金黄色葡萄球菌(MRSA)的分布及耐药性,为临床合理抗感染治疗提供实验室依据。 方法 采用回顾性分析方法,选取我院2015年1~12月住院的老年和中青年病人,对其感染的SAU和MRSA进行培养及耐药性分析,并对2组结果进行比较。 结果 老年组中SAU和MRSA主要分布在神经外科,分别占18.97%和30.95%;中青年组SAU主要分布在普通外科(21.29%),MRSA主要分布在重症监护病房(30.95%)。老年组MRSA检出率为36.21%;中青年组MRSA检出率为27.10%。 老年组和中青年组病人SAU对青霉素G的耐药率最高,均>90%。2组SAU对复方新诺明以及MRSA对克林霉素的耐药率差异有统计学意义(P<0.05)。2组SAU和MRSA均对呋喃妥因、喹努普汀/达福普汀、利奈唑胺、替加环素、万古霉素敏感,耐药率为0。 结论 定期SAU进行耐药性检测和分析,对有效控制院内感染有重要意义。
老年人; 中青年; 金黄色葡萄球菌; 耐甲氧西林金黄色葡萄球菌; 耐药性; 病原菌
金黄色葡萄球菌(SAU)是临床上常见的病原菌,属葡萄球菌属,可引起多种医院内和社区感染性疾病,如皮肤和软组织感染、异物感染、肺炎、化脓性关节炎、心内膜炎、骨髓炎、败血症等[1-2]。近年来,耐甲氧西林金黄色葡萄球菌(MRSA)发生率呈现逐渐增高趋势,并且和临床发病率和死亡率密切相关[3-4]。国内各地区均对MRSA的出现及耐药率变迁进行了相关报道[5-9]。本研究对中国医科大学附属盛京医院2015年1~12月分离自老年和中青年住院病人的271株SAU标本的临床分布和耐药情况进行分析和对比,为指导临床治疗提供依据。
1 资料与方法
1.1 一般资料 回顾性收集2015年1~12月在我院住院的老年病人(年龄≥60岁)与中青年病人(年龄18~59岁)的各类临床感染标本,SAU标本共271例,其中老年人116例,男66例,女50例,平均(71.99±8.45)岁;中青年人155例,男89例,女66例,平均(43.35±11.81)岁。
1.2 细菌学鉴定及药敏试验 按照《全国临床检验操作规程》的要求对标本进行接种、培养、分离,采用全 自 动 细 菌 鉴 定 和 药 敏 分 析 系 统 VITEK-2 Compact 和VITEK MS方法对SAU进行鉴定和药敏试验。操作方法和判断标准严格按照美国临床和实验室标准协会(clinical and laboratory standards institute, CLSI) (2014版) 标准执行。
1.3 统计分析 菌株来源、科室分布及药敏结果采用Excel软件进行数据统计与整理,2组间科室分布差异及耐药率差异比较采用SPSS 19.0统计软件进行卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 标本分布 老年病人SAU主要来源于痰液,占45.69%;中青年病人SAU来源主要为分泌物,占26.45%。2组SAU标本在痰液、分泌物、尿液中的分布差异有统计学意义 (P<0.05)。老年和中青年MRSA标本均主要来源于痰液,分别占71.43%和45.24%。2组MRSA标本在痰液、分泌物、全血的分布差异有统计学意义 (P<0.05)。见表1。

表1 老年与中青年病人SAU和MRSA标本分布构成比(%)
2.2 科室分布 老年病人SAU主要来源于神经外科(18.97%);中青年病人SAU主要分布在普通外科(21.29%)。老年病人和中青年病人在神经外科SAU的分布差异有统计学意义(P<0.05)。老年病人MRSA主要来源于神经外科(30.95%);中青年病人MRSA主要来源于重症监护病房(ICU)(30.95%)。见表2。
2.3 耐药率 老年和中青年病人SAU均对青霉素G耐药率最高;2组SAU和MRSA对呋喃妥因、喹努普汀/达福普汀、利奈唑胺、替加环素、万古霉素敏感率均为100%。2组SAU对复方新诺明的耐药率差异有统计学意义(P<0.01)。老年病人MRSA对青霉素G、苯唑西林、红霉素、环丙沙星、四环素、克林霉素、庆大霉素、左氧氟沙星、利福平、莫西沙星、复方新诺明的耐药率依次下降,分别为:100.00%、100.00%、80.95%、80.95%、80.95%、64.29%、54.76%、37.50%、35.71%、29.17%、2.44%;中青年病人SAU和MRSA对红霉素、克林霉素、庆大霉素、左氧氟沙星、复方新诺明的耐药率均大于老年组。2组MRSA对克林霉素的耐药率差异有统计学意义 (P<0.05)。见表3。
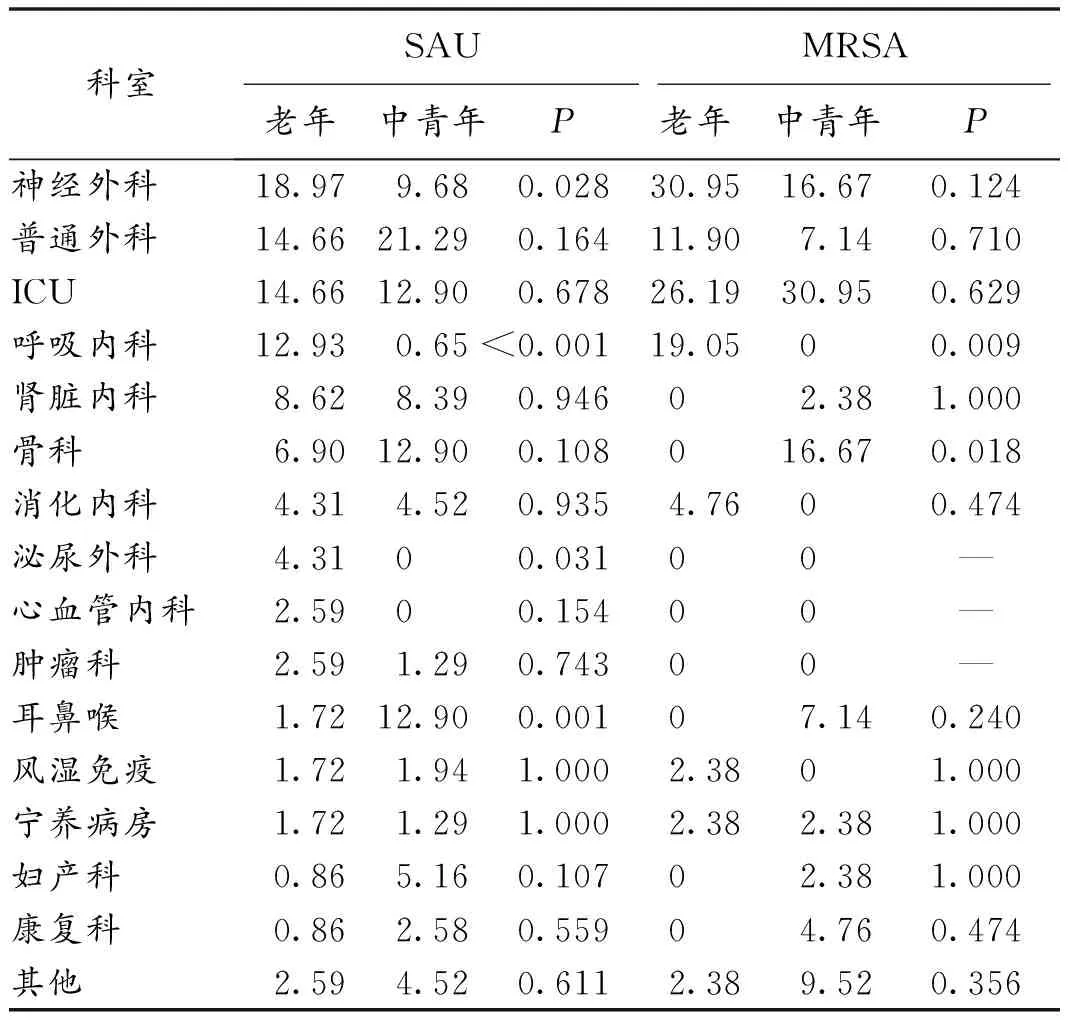
表2 老年和中青年病人SAU和MRSA科室分布构成比(%)
表3 老年与中青年病人SAU和MRSA对常用抗菌药物的耐药率(%)
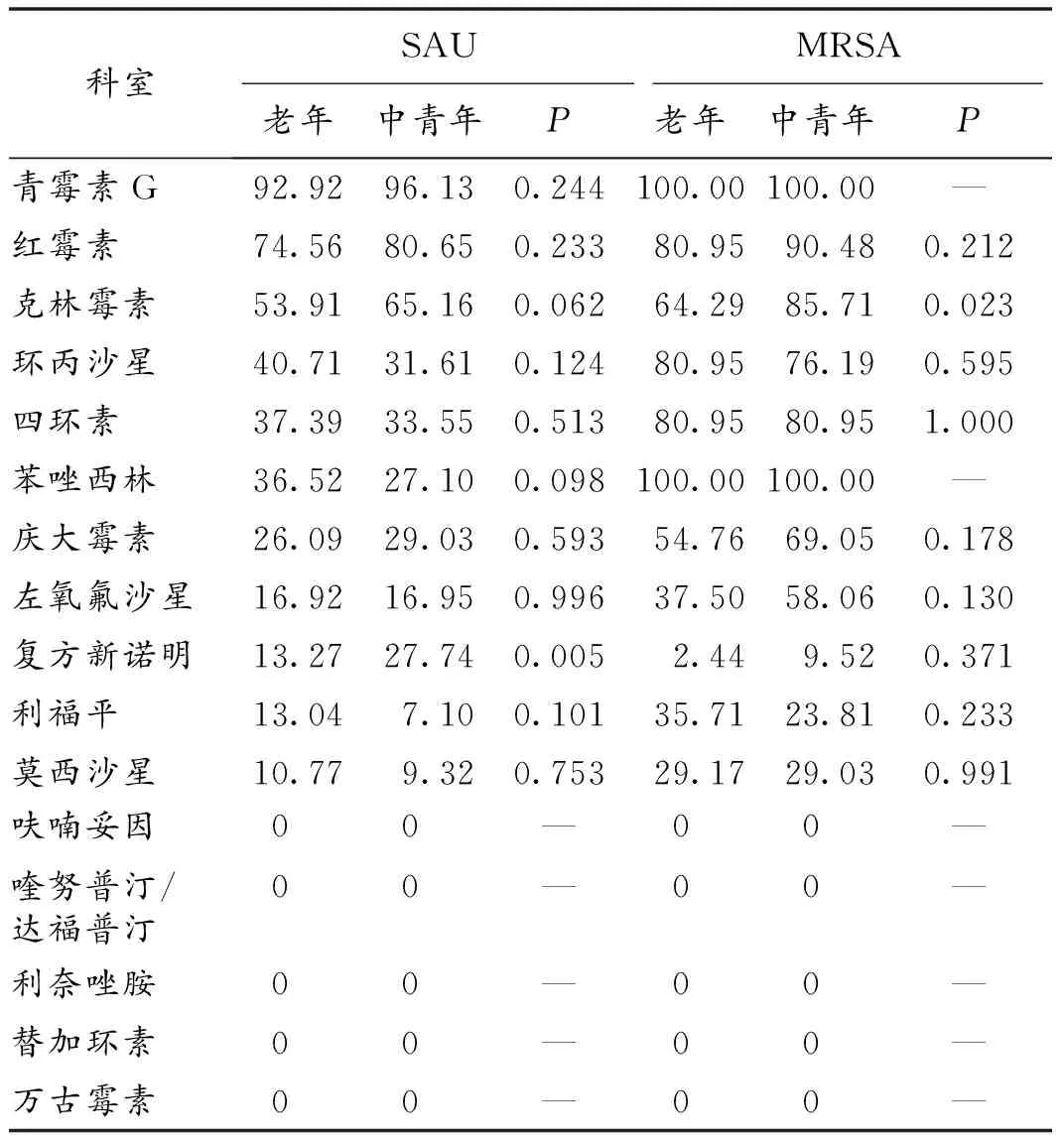
科室SAUMRSA老年中青年P老年中青年P青霉素G92.9296.130.244100.00100.00—红霉素74.5680.650.23380.9590.480.212克林霉素53.9165.160.06264.2985.710.023环丙沙星40.7131.610.12480.9576.190.595四环素37.3933.550.51380.9580.951.000苯唑西林36.5227.100.098100.00100.00—庆大霉素26.0929.030.59354.7669.050.178左氧氟沙星16.9216.950.99637.5058.060.130复方新诺明13.2727.740.0052.449.520.371利福平13.047.100.10135.7123.810.233莫西沙星10.779.320.75329.1729.030.991呋喃妥因00—00—喹努普汀/达福普汀00—00—利奈唑胺00—00—替加环素00—00—万古霉素00—00—
3 讨论
美国疾病控制中心报告,由SAU引起的感染占第2位,仅次于大肠杆菌。很多因素能导致SAU的感染,如不良的手卫生会习惯导致SAU的传播率高达40%[10],伤口不恰当的处理也会导致SAU的定植等[11]。 MRSA作为临床最常见的多重耐药细菌之一,检出率逐年上升,其感染给临床治疗带来极大困难[12]。
中青年组SAU在分泌物中检出最多,占26.45%,说明SAU在中青年病人中最常引起伤口创面感染和皮肤软组织感染,这与 Sisirak等[13]和Stevens等[14]报道一致。老年病人SAU和MRSA来源均以痰液为主,分别占45.69%和71.43%,与呼吸内科SAU感染老年病人多有关。有文献报道,老年病人下呼吸道感染病原菌中,SAU占革兰阳性菌感染的53%[15],以上结果说明老年病人中,SAU主要感染部位为呼吸道,这可能与老年病人各脏器功能减退和机体免疫功能低下,使用人工气道、呼吸机、吸痰等医源性因素有关[16]。
科室分布中,2组病人SAU在神经外科、呼吸内科、泌尿外科、耳鼻喉科的分布差异有统计学意义(P<0.05)。这可能与不同年龄段的常见病构成有关,有文献报道,SAU在鼻腔的定植与年龄有关[17]。ICU的病人以重病为主,长期卧床,基础情况差,免疫力低下,各种侵入性操作较多,常大量使用抗生素和激素,因此ICU老年和中青年病人发生MRSA感染概率均较高。
SAU 由于产生大量β-内酰胺酶及青霉素结合蛋白2a, 造成对 β-内酰胺类药物的耐药率很高。老年和中青年病人SAU均对青霉素G的耐药率均>90%。老年和中青年病人SAU对复方新诺明耐药率的差异有统计学意义(P<0.05)。 中青年病人SAU对复方新诺明(SXT)的耐药率较高,为27.81%,而老年病人SAU对SXT耐药率为13.27%。这可能与老年人的葡萄球菌染色体mec基因盒(staphylococcal cassette chromosome mec, SCCmec)分型与中青年人不同有关[18]。2组SAU对利福平的耐药率正好相反,老年病人较高。这可能与利福平对复方新诺明耐药(SXT-R)的SAU有强大的抗菌活性有关[19]。
结果中还发现,无论是老年还是中青年病人,MRSA对大部分抗菌药的耐药率都要高于SAU,而MRSA对复方新诺明的耐药率低于SAU,说明复方新诺明对MRSA仍有较好的抗菌活性,与文献[19]报道的一致。
老年病人MRSA检出率 (36.21%) 高于中青年病人 (27.10%),这可能与老年病人住院时间长,合并糖尿病、脑卒中等疾病,长期使用广谱抗生素有关。老年病人SAU和MRSA对环丙沙星、莫西沙星、利福平的耐药率均高于中青年病人,可能这些抗生素在老年病人中使用率较高,导致其耐药率上升。
2组SAU和MRSA对呋喃妥因、喹努普汀/达福普汀、利奈唑胺、替加环素、万古霉素的敏感率均为100%,说明这些药物可以作为临床有效的抗感染治疗药物。
综上所述,SAU存在于各临床科室以及各年龄段人群中。在临床工作中,医师应及时检测细菌的耐药性,依据药敏结果选用合适的抗菌药物,防止多重耐药金黄色葡萄球菌的流行。
[1] Yu F, Liu Y, Lv J, et al. Antimicrobial susceptibility, virulence determinant carriage and molecular characteristics of Staphylococcus aureus isolates associated with skin and soft tissue infections[J]. Braz J Infect Dis,2015, 19(6):614-622.
[2] Lee GC, Hall RG, Boyd NK, et al. A prospective observational cohort study in primary care practices to identify factors associated with treatment failure in Staphylococcus aureus skin and soft tissue infections[J]. Ann Clin Microbiol Antimicrob, 2016, 15(1): 58-64.
[3] Cooper BS, Kypraios T, Batra R, et al. Quantifying type-specific reproduction numbers for nosocomial pathogens: evidence for heightened transmission of an Asian sequence type 239 MRSA clone[J]. PLoS ONE,2012,8(4):e1002454.
[4] Qiu JZ, Niu XD, Wang JF, et al. CapSAUicin protects mice from community-associated methicillin-resistant Staphylococcus aureus pneumonia[J]. PLoS ONE,2012,7(3):e33032.
[5] Liu X, Liang J, Jiang Y, et al. Molecular characteristics of community-acquired methicillin-resistant Staphylococcus aureus strains isolated from outpatients with skin and soft tissue infections in Wuhan, China[J]. Pathog Dis,2016, 74(4):ftw026.
[6] Ning X, Sun M, Qiao Y, et al. Characterization of pediatric hospital-associated infection caused by methicillin-resistant Staphylococcus aureus in mainland China[J]. Infect Dis, 2015, 47(6):410-417.
[7] Yan X, Tao X, He L, et al. Increasing resistance in multiresistant methicillin-resistant Staphylococcus aureus clones isolated from a Chinese hospital over a 5-year period[J]. Microb Drug Resist, 2011, 17(2):235-239.
[8] Cui S, Li J, Hu C, Jin S, et al. Isolation and characterization of methicillin-resistant Staphylococcus aureus from swine and workers in China[J]. J Antimicrob Chemother, 2009, 64(4):680-683.
[9] Zhang H, Xiao M, Kong F, et al. A multicentre study of meticillin-resistant Staphylococcus aureus in acute bacterial skin and skin-structure infections in China: susceptibility to ceftaroline and molecular epidemiology[J]. Int J Antimicrob Agents, 2015, 45(4):347-350.
[10]Eyoh AB, Toukam M, Atashili J, et al. Relationship between multiple drug resistance and biofilm formation in Staphylococcus aureus isolated from medical and non-medical personnel in Yaounde, Cameroon[J]. Pan Afr Med J, 2014(17):186-190.
[11]Almeida GC, dos Santos MM, Lima NG, et al. Prevalence and factors associated with wound colonization by Staphylococcus spp. and Staphylococcus aureus in hospitalized patients in inland northeastern Brazil: a cross-sectional study[J]. BMC Infect Dis, 2014, 14(1): 328-335.
[12]李丽民, 吴先华, 徐礼锋. 金黄色葡萄球菌的临床分布及耐药性分析[J]. 中华医院感染学杂志, 2014, 24(4):1668-1669.
[13]Sisirak M, Zvizdic A, Hukic M. Methicillin-resistant Staphylococcus aureus (MRSA) as a cause of nosocomial wound infections[J]. Bosn J Basic Med Sci, 2010, 10(1): 32-37.
[14]Stevens DL, Bisno AL, Chambers HF, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2014, 59(2): e10-e52.
[15]杨琳, 胡熙苒, 肖怀志. 呼吸内科老年患者下呼吸道感染病原菌分布及耐药性分析[J]. 实用老年医学, 2014, 28(7):605-606.
[16]王萍, 曾玉兰. 395例老年患者院内获得性葡萄球菌感染的临床分析[J]. 实用老年医学, 2016, 30(9):782-783.
[17]Leung NS, Padgett P, Robinson DA, et al. Prevalence and behavioural risk factors of Staphylococcus aureus naSAUl colonization in community-based injection drug users[J]. Epidemiol Infect, 2015, 143(11):2430-2439.
[18]朱砚萍, 瞿介明, 朱惠莉, 等. 老年病房耐甲氧西林金黄色葡萄球菌葡萄球菌染色体mec基因盒基因型和杀白细胞素基因的检测及特点[J]. 上海医学, 2013, 36(1):10-14.
[19]陈坚,余方友,王彩虹. 耐复方新诺明金黄色葡萄球菌耐药谱分析[J]. 中华医院感染学杂志, 2008, 18(10):1482-1484.
Analysis of distribution and drug resistance of Staphylococcus aureus in elderly and adult patients
YUBo-xin,HUANGTing-ting,LIUDan,WANGJia-he.
DepartmentofGeriatrics,ShengjingHospitalofChinaMedicalUniversity,Shenyang110014,China
Objective To explore the drug distribution characteristics of Staphylococcus aureus (SAU) and methicillin-resistant Staphylococcus aureus (MRSA) in hospitalized elderly and adult patients, and to compare and analyze their drug resistance in order to guide clinical therapy. Methods The retrospective analysis and statistical analysis were performed to analyze the infection status and drug resistance in elderly and adults patients who were infected with SAU and MRSA from January 2015 to December 2015. Results The elderly patients infected by SAU and MRSA were most from the department of neurosurgery, with a ratio of 18.97% and 30.95%, respectively. The adults infected by SAU were most from the department of general surgery (21.29%), and the adults infected by MRSA were most from intensive care unit (30.95%). The detection rate of MRSA in elderly group was 36.21%, compared with 27.10% in adult group. The resistance rate of SAU to penicillin G in elderly or adult patients was the highest, which was more than 90%; The resistance rate of SAU to sulfamethoxazole and the resistance rate of MRSA to clindamycin were significantly lower in elderly group than those in adult group (P<0.05). The resistance rates of SAU and MRSA to furantoin, quinupristin/dalfopristin, linezolid, tigecycline, vancomycin were 0. Conclusions Monitoring the drug resistance of SAU infection was beneficial to guide the reasonable use of antibiotics.
aged; adults; Staphylococcus aureus; methicillin-resistant Staphylococcus aureus; drug resistance; pathogens
国家自然科学基金青年基金(81101224);盛京自由研究者计划(201206);辽宁省自然科学基金(201602858)
110001辽宁省沈阳市,中国医科大学附属盛京医院老年病科
王佳贺,Email:wangjhcmusj@163.com
R 515
A
10.3969/j.issn.1003-9198.2017.05.010
2017-01-02)
