百脉根根际高效溶磷菌LC15的特性研究及菌株鉴定
2017-05-17马培杰王小利陆瑞霞
蔡 璐,马培杰,王小利,陈 莹,陆瑞霞,王 茜
(1.贵州省生物技术研究所,贵州 贵阳 550006;2.贵州省草业研究所,贵州 贵阳 550006)
百脉根根际高效溶磷菌LC15的特性研究及菌株鉴定
蔡 璐1,马培杰2,王小利2,陈 莹2,陆瑞霞2,王 茜2
(1.贵州省生物技术研究所,贵州 贵阳 550006;2.贵州省草业研究所,贵州 贵阳 550006)
研究了分离自百脉根(Lotuscorniculatus) 根际的溶磷菌LC15,通过对其进行生理生化特性及16S rDNA序列分析表明,其菌株具有较强的溶解无机磷和有机磷的能力,且对无机磷的溶解能力更强,D/d比值均超过3.00;振荡培养7 d后其可溶性磷含量高达400.49 mg/L,分泌总有机酸量30.67 mmol/L,且菌悬液pH 4.39呈酸性;革兰氏染色呈阴性,在厌氧生长、V-P、柠檬酸盐利用、ONPG测定、精氨酸双水解酶等生理生化试验中均呈阳性;经BIOLOG测定,可利用碳源占95种供试碳源种类的54%;结合菌株16S rDNA序列同源性比对分析,初步鉴定为柠檬酸杆菌属(Citrobctersp.)。
溶磷菌;百脉根;溶磷能力;16S rDNA
磷元素是促进植物生长及高产的必需营养元素,但由于其95%在土壤中易与Ca2+、Fe2+、Fe3+、Al3+等金属阳离子结合形成闭蓄态难溶性磷酸盐,进而难被植物吸收利用,成为影响植物生长发育的重要限制因素[1]。植物根际土壤中含有大量微生物,这些微生物在有机质分解、养分循环和植物养分利用等过程中发挥着重要的作用。其中,能够促进植物生长、防治病害、增加作物产量的微生物被称为植物根际促生菌(PGPR)。溶磷菌作为PGPR家族中的一类重要成员,在将难溶性的磷酸盐转化为可溶态,进而供植物吸收利用方面发挥着至关重要的作用[2]。因此,研究与应用土壤溶磷菌可以提高土壤中磷资源的利用,并通过研制开发微生物菌肥,促进植物对土壤有效磷的吸收,对我国农业发展具有重大意义[3-4]。
百脉根(Lotuscorniculatus) 属豆科百脉根属多年生草本植物,又名鸟趾草、乌足豆和五叶草,原产于欧、亚温暖地区,现世界各国广泛栽培利用[5]。我国西北、华北、华南、西南等地均有分布,是温暖湿润地区极具潜力的优良牧草[6]。在我国贵州黔中、黔西北地区,已成为栽培利用和草山改良的首选优良豆科牧草。百脉根根系发达,侧根着生根瘤,具有增加土壤有机质和提高氮素吸收、改良土壤和增加土壤肥力等效果。且其营养丰富,耐寒、抗旱、耐涝、虫害少、皂素含量低、适口性好、采食率高、家畜饲用安全[7-8]。也是研究生物固氮机理及牧草品质改良的豆科模式植物[9-10]。
1 材料和方法
1.1 菌株来源
供试菌株分离自百脉根根际土壤,百脉根及土样均采集于贵州省草业研究所独山县试验地,菌株编号为LC15。
1.2 培养基及试剂
(1) LB液培养基:蛋白胨10.0 g,酵母粉5.0 g,NaCl 10.0 g,琼脂15.0~20.0 g,蒸馏水定容至1 L,pH 7.0;(2) Pikovaslaia’s (PKO) 无机磷培养基:葡萄糖10.0 g,(NH4)2SO40.5 g,NaCl 0.2 g,KCl 0.2 g,FeSO4·7H2O 0.003 g,MnSO4·4H2O 0.03 g,MgSO4·7H2O 0.1 g,Ca3(PO4)23.0 g,酵母粉0.5 g,琼脂15.0~20.0 g,蒸馏水定容至1 L,pH 7.0;(3) 蒙金娜有机磷培养基[11]:葡糖糖10.0 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,Ca(CO3)25.0 g,酵母粉0.4 g,琼脂15.0~20.0 g (液体培养基不加),蛋黄卵磷脂0.2 g,蒸馏水定容至1 L,pH 7.0;(4) 无色氨酸King液体培养基[12]:蛋白胨20.0 g,甘油15 mL/L,K2HPO41.15 g,MgSO4·7H2O 1.5 g,蒸馏水定容至1 L,pH 6.8;(5) 无氮液体培养基(NFM)[13]:苹果酸5.0 g,K2HPO40.5 g,MgSO4·7H2O 0.2 g,CaCl2·2H2O 0.02 g,NaCl 0.1 g,NaMoO4·2H2O 0.002 g,溴麝香草酚蓝(0.5%) 5 mL,KOH 4.5 g,维生素H 10 μg,蒸馏水定容至1 L,pH 7.0;(6) Spot比色液[14]:0.5 mol/L FeCl31 mL,10.8 mol/L浓硫酸30 mL,蒸馏水定容至50 mL;(7) S2 (Salkowski) 比色液体[14]:由FeCl34.5 g,10.8 mol/L浓硫酸定容至1 L。
1.3 溶磷能力的测定
(1) 定性测定采用溶磷圈法。将活化后的LC15菌株点接种于PKO无机磷及蒙金娜有机磷平板上,于28℃恒温培养箱中倒置培养5,10和15 d,观察并测量菌株形成的溶磷圈大小。记录并计算溶磷圈直径(D) 和菌落直径(d) 比值(D/d);(2)定量测定采用钼蓝比色法。将50 mL液体PKO无机磷培养基装入150 mL三角瓶,120℃灭菌20 min,冷却后,将0.5 mL菌悬液(108cfu/mL) 接种至三角瓶中重复3次,以基础培养基不接种菌株为对照。并将三角瓶置于28℃、150 r/min摇床培养7 d,用酸度计测定培养液pH。第8 d将培养液10 000 r/min、4℃离心10 min,取1 mL上清液测定有效磷增量。同时,取5 mL上清液,以酚酞为指示剂,用0.1 mol/L NaOH滴定,测定LC15菌株分泌的总有机酸量。
1.4 分泌IAA能力的测定
(1)定性判断。将50 mL液体King培养基装于150 mL三角瓶,120℃灭菌20 min,冷却后将0.5 mL菌悬液(108cfu/mL) 接种至三角瓶中重复3次 ,以基础培养基不接种菌株为对照。将三角瓶置于28℃,150 r/min摇床培养7 d,取菌株悬浮液1 mL滴置于检测板上,加入等量Spot比色液,同时在比色液中加1 mL 50、30、10 mmol/L的植物生长激素(3-吲哚乙酸) 作对照;将检测板置室温下,在15 min内观察其颜色变化,颜色变粉红者表示能分泌IAA,颜色越深表示分泌IAA能力越强;不变色为阴性,即不分泌IAA[15]。
(2)定量测定。将50 mL液体King培养基装于150 mL三角瓶,120℃灭菌20 min,冷却后将0.5 mL菌悬液(108cfu/mL) 接种至三角瓶中重复3次,以基础培养基不接种菌株为对照。将三角瓶置于28℃,150 r/min摇床培养7 d,取菌株悬浮液1 mL滴置于检测板上,加入等量S2比色液,在黑暗下静置30 min后,迅速用波长530 nm紫外分光光度计测定OD值,根据标准曲线计算菌液中IAA含量,标准曲线采用纯的3-吲哚乙酸制作。
1.5 酸碱性能的测定
将50 mL液体NFM培养基装于150 mL三角瓶,120℃灭菌20 min,冷却后将0.5 mL菌悬液(108cfu/mL) 接种至三角瓶中重复3次 ,以基础培养基不接种菌株为对照。将三角瓶置于28℃,125 r/min恒温摇床上振荡培养72 h。随后,观察并记录培养基颜色变化。
1.6 菌株的鉴定
(1) 菌落特征及生理生化特性参照《常见细菌系统鉴定手册》及《伯杰氏细菌鉴定手册》对菌株LC15的菌落特征及各项生理生化特性进行试验鉴定[16-17];(2)菌株的16S rDNA序列分析由宝生物(大连) 公司提供DNA基因组提取试剂盒提取菌株LC15基因组DNA。所用引物由上海捷瑞生物工程有限公司合成,上游引物:5′-GAGAGTTTGATCCTGGCTCAG-3′;下游引物:5′-CTACGGCTACCTTGTTACGA-3′。25 μL PCR反应体系包括:10×buffer2.5 μL,dNTP Mixture (10 mmol/L) 2.0 μL,TaqDNA酶(2.5 U/μL) 0.25 μL,MgCl2(25 mmol/L) 5.0 μL,上游与下游引物(10 μmol/μL) 各1.0 μL,模板(20 ng/μL) 1.0 μL,ddH2017.25 μL。空白对照为含有除模板核算外的所有组分。反应条件:94℃ 5 min;94℃ 30 s,45℃ 30 s,72℃ 2 min,进行30个循环。PCR扩增产物经1.0%琼脂糖凝胶电泳,使用OMEGA BIO-TEK公司提供的Get Extraction Kit(50)D-2500-01试剂盒回收目的片段,以T载体法克隆PCR产物,将阳性克隆送上海英骏生物技术有限公司进行测序,测序结果在GenBank中的Blast数据库进行同源性比对,最终,利用Clustal 1.8和Mega 4.0软件绘制其系统进化树。
2 结果与分析
2.1 菌株LC15溶磷能力
2.1.1 菌株LC15溶磷能力的定性测定 将从百脉根根际分离到的20株溶磷菌在PKO无机磷固体培养基平板上涂板。经筛选,得到一株具有较大溶磷圈的溶磷菌,标记为LC15。进一步将LC15用无菌牙签分别点接种于PKO无机磷及蒙金娜有机磷平板上,于28℃恒温培养箱中倒置培养5,10和15 d。结果显示,菌株LC15在蒙金娜有机磷培养基上的D/d比值随培养天数的延长逐渐增加;而在PKO无机磷培养基上的D/d比值随培养天数的延长逐渐下降,但其D/d比值均超过3.00。并且菌株LC15在PKO无机磷培养基上溶磷圈D/d比值始终高于在蒙金娜有机磷培养基上。菌株LC15具有较强的溶解无机磷及有机磷的能力,且其对无机磷的溶解能力更强(图1)。

图1 菌株LC15在培养基上溶磷圈的D/d比值Fig.1 Dynamic variation of phosphate-solubilizing zone D/d value of strain LC15 on PKO culture medium and Mengjinna culture medium,respectively
2.1.2 菌株LC15溶磷能力的定量测定 菌株LC15经7 d振荡培养后,定量测定其菌液中可溶性磷含量及pH。其可溶性磷含量高达400.49 mg/L,可见该溶磷菌在生长代谢过程中需要大量的磷素。同时,试验测得菌液中总有机酸量高达30.67 mmol/L,且该菌悬液pH 4.39,与对照pH 7.00相比,下降超过2个单位,可见菌株LC15具有很强的溶磷能力,且其在溶磷过程中产生了大量的有机酸(表1)。

表1 菌株LB15溶磷能力及其相关特性Table 1 Phosphate-solubilizing ability and relevant characteristics of strain LC15
2.2 菌株LC15分泌IAA能力及酸碱性能
对菌株LC15分泌IAA能力的定性测定结果显示,菌株LC15无明显显色反应(表2)。通常“+++”表示深粉红色;“++”表示粉红色;“+”表示浅粉红色;“-”表示无色,且显色程度与菌株分泌IAA能力正相关[15]。进一步定量测定结果与定性测定结果一致,检测到菌株LC15分泌的IAA量为0。与多数植物根际微生物不同,百脉根根际溶磷菌LC15可能不具有分泌IAA的能力。菌株在NFM液体培养基中振荡培养72 h后,菌悬液颜色为绿色或草绿色,为中性菌株;变成黄色,表明其为产酸菌株;变成蓝色为产碱菌株。菌株LC15使原本为绿色的菌悬液变成蓝色(表2),因此,确定该菌株为产碱菌株。

表2 菌株LC15分泌IAA及酸碱性能Table 2 The characteristics of IAA secretion and acid-base property from strain LC15
2.3 菌株鉴定
2.3.1 菌株LC15菌落形态及革兰氏染色特征 将菌株LC15培养于LB固体培养基上,2 d后观察其菌落形态学特征(图2)。菌落大、表面光滑,不规则、呈淡白色、半透明、湿润、中间凸起、边缘整齐光滑。革兰氏染色结果呈阴性,显微镜下观察为杆状。
2.3.2 菌株LC15生理生化特性 溶磷菌LC15厌氧生长、接触酶、V-P、硝酸盐还原、柠檬酸盐利用、ONPG测定及精氨酸双水解酶试验结果均呈阳性;而氧化酶、吲哚、丙二酸利用、硫化氢、赖氨酸脱羧酶及鸟氨酸脱羧酶试验结果均呈阴性。碳源利用试验采用BIOLOG微生物全自动鉴定系统完成。试验结果表明,菌株LC15可利用的碳源占95种供试碳源种类的54%(表3)。
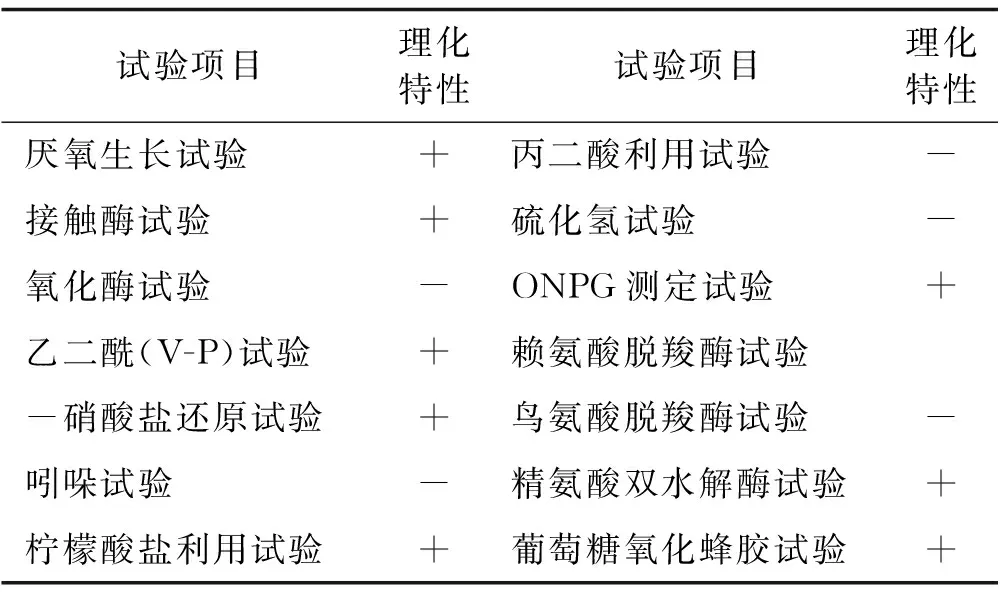
表3 菌株LC15生理生化特性Table 3 The physiological-biochemical characteristics of strain LC15
注:“+”表示为阳性反应,“-”表示为阴性反应
参照《常见细菌系统鉴定手册》及《伯杰氏细菌鉴定手册》,菌株LC15理化特性与杨氏柠檬酸杆菌(Citrobacteryoungae) 最为相似。

图2 菌株LC15在LB培养基上的菌落Fig.2 The colonyof strain LC15 on LB culture medium
2.3.3 菌株LC15的16S rDNA序列分析 菌株LC15的基因组DNA经PCR扩增后的产物,由1.0%的琼脂糖凝胶电泳检测,最终获得约1 500 bp大小的片段(图3左)。随后,将菌株DNA PCR扩增产物进行回收,再次经1.0%琼脂糖凝胶进行电泳检测(图3右),回收产物条带明亮,无杂带,片段长度在1 500 bp左右。
将回收产物插入PMD18载体,重组质粒DNA,并送交上海英骏生物技术有限公司进行正反向测序,最终序列长度为1 441 bp。将其序列输入Genbank中Blast搜索相近序列进行同源性比对。结果发现,菌株LC15的16S rDNA序列与多株柠檬酸菌属(Citrobactersp.)、肠杆菌属(Enterobactersp.) 及勒克氏菌属(Leclerciasp.) 的16S rDNA核苷酸序列具有较高的同源性。其中与柠檬酸杆菌(Citrobactersp.) 菌株CH-65 (登录号:KR149007) 及CH-51 (登录号:KR148996) 的同源性分别为96.21%和96.35%,与阿氏肠杆菌(Enterobacterasburiae) 菌株DK20 (登录号:JQ271799) 的同源性为97.23%,与非脱酸勒克氏杆菌(Leclerciaadecarboxylata) 菌株H3-31 (登录号:KC252602) 的同源性为97.98%;而与泛菌属(Pantoeasp.)和根瘤菌属(Rhizobiumsp.) 的同源性相对较远,约94%(图4)。依据比对结果及菌株的主要生理生化特征,将菌株LC15初步归属为柠檬酸菌属(Citrobactersp.) 细菌。

图3 菌株LC15基因组PCR扩增电泳图(左) 和PCR扩增产物回收电泳图(右)Fig.3 The amplification of PCR (light) and recycled product of PCR(right) from strains LC15注:M:DNA Marker DL 2000;1:LC15)

图4 基于菌株的16S rDNA序列同源性构建的系统进化树Fig.4 The pbylogenetic tree based on 16S rDNA sequences homology of strains
3 讨论
目前,测定溶磷微生物溶磷能力的方法有4种:一是采用固体平板溶磷圈法;二是对菌株进行液体培养,经过一定时间的发酵培养,测定培养液上清液中所含的可溶性磷含量;三是同位素示踪法;四是土培法,即测定土壤中有效磷含量[2]。其中前两种方法被广泛使用,分别在定性和定量的水平上测定了溶磷菌的溶磷能力[18,19]。已有研究报道,溶磷菌产生溶磷圈的大小与其分解无机磷能力的强弱有关,从而可初步判断溶磷菌溶磷能力[20]。研究结果中,LC15在PKO无机磷培养基上溶磷圈D/d比值在5~15 d中均大于3.00 (图1),经进一步定量分析,7 d振荡培养后,菌液中可溶性磷含量高达400.49 mg/L,且呈酸性(表1)。这些酸性物质的产生可能在LC15溶磷过程中发挥重要作用。已有研究报道,溶磷菌对难溶无机磷酸盐的溶磷机理之一是菌体生长过程中分泌有机酸,溶磷菌能够分泌甲酸、乳酸、葡萄糖酸、柠檬酸、丙酸、丁二酸等多种有机酸[21-22],这些酸一方面使培养液的pH下降,另一方面还与Ca2+、Mg2+、Fe3+、Al3+等离子以多种形式结合,从而使难溶磷转化为有效磷[23]。Park等[24]研究发现,溶磷菌通过释放有机酸降低土壤pH,促进作物的生长。
除此之外,有研究者认为多数植物根际微生物具有分泌IAA的能力[25-26],该过程不仅对植物有直接促生作用,如改变细胞内环境、促进RNA及蛋白质的合成,还可抑制几丁质酶等的活性,使有益细菌更易定殖于植物[27]。研究发现,与多数植物根际微生物不同,百脉根根际溶磷菌LC15可能不具有分泌IAA的能力,定量与定性测定结果均检测到其分泌的IAA量为0 (表2)。与李显刚等[27]研究结果相似,百脉根菌株LC15与葛藤菌株GTR15均为产碱菌株,可能与协调贵州偏酸性的黄壤土结构有关。
研究中,碳源利用试验采用BIOLOG微生物全自动鉴定系统完成。该系统利用细菌对95种不同碳源的代谢情况来鉴定菌种,即每种菌种形成各自特有的代谢指纹图谱,选用四唑紫作为细菌能否利用供试碳源的指示剂,其中,碳源包括糖、醇、酸、胺、酯和大分子聚合物。该方法在于分析鉴定细菌代谢的氧化还原过程而不是他们的代谢副产物(如产酸、产气)。试验结果发现,百脉根菌株LC15在95种供试碳源中,可利用的种类高达54%,可见,该菌株能够利用多类碳源为自身生长提供能量,进而能够在多种生境下发挥溶磷作用,适用性广泛。
综合生理生化特征及16S rDNA序列分析结果,研究的溶磷细菌LC15属于目前全世界已知30属89种溶磷微生物中的柠檬酸菌属(Citrobactersp.) 细菌。通过对该菌株溶磷能力及生理生化特性的探讨,为下一步研制高效生物菌肥奠定了基础。
4 结论
菌株LC15对磷酸钙的溶磷量为400.49 mg/L,分泌总有机酸量30.67 mmol/L,其菌悬液呈明显酸性(pH 4.39),结合生理生化特征及16S rDNA序列分析为柠檬酸杆菌属(Citrobactersp.),是一株优良的溶磷菌株。
[1] 王光华,周可琴,金剑.不同碳源对三种溶磷真菌溶解磷矿粉能力的影响[J].生态学杂志,2004,23(2):32-36.
[2] 李云海,孔维宝,达文燕,等.土壤溶磷微生物研究进展[J].生物学通报.2013,48(7):1-5.
[3] 冯月红,姚拓,龙瑞军.土壤解磷菌研究进展[J].草原与草坪,2003(1):3-7.
[4] Pérez E,Sulbarán M,Ball M M,etal.Isolation and characterization of mineral phosphate-solubilizing bacteria naturallycolonizing a limonitc crust in the south-eastern Venezuelanregion[J].Soil Biology and Biochemistry,2007,39(11):2905-2914.
[5] 孙艳香,杨红梅,耿云红,等.南开大学学报(自然科学版)[J].2006,39(2):51-57.
[6] 赵丽丽,陈超,王普昶.百脉根种子萌发期抗旱性综合评价[J].贵州农业科学,2012(9):50-56.
[7] Duke J A.Handbookof legumesof world economicimportance[M].London:Plenum Press,1981.
[8] 陈燕,李聪,苏加楷.发根农杆菌介导的百脉根的基因转化[J].草地学报,1996,4(2):116-120.
[9] 佳耀林,马诚.植物组织培养[M].北京:科学出版社,1985:101-107.
[10] 赵海明,孙桂枝,王学敏,等.百脉根种质苗期抗旱性鉴定及综合评价[J].草原与草坪,2011,31(6):18-26.[11] 林启美,赵小蓉,孙炎鑫,等.四种不同生态系统中的解磷细菌数量及种群分布[J].土壤与环境,2000,9(1):34-37.
[12] 李玉娥,姚拓,荣良燕.溶磷菌溶磷和分泌IAA特性及对苜蓿生长的影响[J].草地学报,2010(1):84-88.
[13] Hafeez F Y,Malik K A.Manual on biofertilizertechnology[M].Pakistan:Nibge,2000:132-135.
[14] 姚拓.饲用燕麦和小麦根际促生菌特性研究及其生物菌肥初步研制[D].兰州:甘肃农业大学,2002.[15] 席琳乔,姚拓,杨俊基,等.联合固氮菌株分泌能力及其对燕麦的促生效应测定[J].草原与草坪,2005(3):23-27.
[16] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[17] 中国科学院微生物研究所.伯杰氏细菌鉴定手册[M].北京:科学出版社,1994.
[18] Morrison I M.Asemi-micro method from the determination of lignin and its use in predicting the digestibility of forage crops[J].J Sei Food Agric,1972,23:455-463.
[19] Rosas S B,Andrrs J A,Rovera M,etal.Phosphate-solubilizing Pseudomonas putidacan influence the rhizobia-legume symbiosis[J].Soil Biology and Biochemistry,2006,38:3502-3505.
[20] 李文红,施积炎.西湖沉积物中解磷菌的分离纯化及其解磷能力[J].应用生态学报,2006,17(11):2112-2116.
[21] Chen Y P,Renkha P D,Arun A B,etal.Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J].Applied Soil Ecology,2006,34(1):33-41.
[22] Rodrguez H,Fraga R,Gonzalez T,etal.Genetics of phos-phatesolubilization and its potential applications for improving plant growth promoting bacteria[J].Plant Soil,2006,287:15-21.
[23] 舒健虹,王普昶,王小利,等.鸭茅根际溶磷菌溶磷性和分泌植物生长素能力的研究[J].草原与草坪,2012,32(6):23-30.
[24] Park J H,Bolan N,Megharaj M,etal.Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil[J].Journal of Hazardous Materials,2011,185(2-3):829-836.
[25] Gibson A H.Genetic variation in the effectiveness of nodulation of Lucerne varieties[J].Aust J Agic Res,1962,13:388-399.
[26] 姚拓.高寒地区燕麦根际联合固氮菌研究Ⅱ.固氮菌的溶磷性和分泌植物生长素特性测定[J].草业学报,2004,13(3):85-90.
[27] 李显刚,姚拓,王小利,等.一株分离自葛藤根际高效溶磷细菌特性研究及菌株鉴定[J].中国土壤与肥料,2012(2):87-91.
Characteristics and identification of phosphate-solubilizing bacteria LC15 isolated from rhizosphere ofLotuscorniculatus
CAI Lu1,MA Pei-jie2,WANG Xiao-li2,CHEN Ying2,LU Rui-xia2,WANG Qian2
(1.GuizhouInstituteofPrataculture,Guiyang550006,China;2.GuizhouInstituteofBiologicalTechnology,Guiyang550006,China)
Phosphate-dissolving bacteria strain LC15 was isolated from the rhizosphere ofLotuscorniculatus,and the physiological and biochemical characters and 16S rDNA sequence were analyzed.The results showed that LC15 had the strong ability of dissolving both inorganic and organic phosphorus,especially for inorganic phosphorus (D/d values were over 3.00);After 7 days incubation,the release of maximal available soluble phosphorus and organic acid reached to 400.49 mg/L and 30.67 mmol/L,respectively;The bacterial suspension was significantly acid (pH 4.39);Based on different measures,including Gram stain negative,anaerobic growth,V-P,citrate utilization,ONPG,arginine dihydrolase,BIOLOG et al.,as well as 16S rDNA sequence analysis,the strain LC15 was identified asCitrobctersp..The strain has the great potential for developing the efficient microbial phosphate inoculant and microbial fertilizer.
phosphate-dissolving bacteria;Lotuscorniculatus;capacity of phosphate solubilization;16S rDNA
2016-04-05;
2016-10-25
贵州牧草根际溶磷菌库建立与溶磷机理研究 (黔科合J字[2013]2152号)资助
蔡璐(1987-),女,贵州贵阳人,助理研究员,从事生物技术研究工作。 E-mail:cys0801@163.com
S 541;S 144
A
1009-5500(2017)02-0029-06
王茜为通讯作者。
