猪附红细胞体吉林感染株二维电泳图谱分析
2017-05-17丛艳昭倪婷婷伍生军薛书江
丛艳昭, 倪婷婷, 伍生军, 齐 楷, 薛书江*
(1.延边大学农学院;2.吉林省延吉市动物卫生检疫站;3.吉林省延边州畜牧总站:吉林 延吉 133000)
猪附红细胞体吉林感染株二维电泳图谱分析
丛艳昭1,2, 倪婷婷1, 伍生军1, 齐 楷3, 薛书江1*
(1.延边大学农学院;2.吉林省延吉市动物卫生检疫站;3.吉林省延边州畜牧总站:吉林 延吉 133000)
为获得猪附红细胞体吉林感染株2-DE图谱,并筛选猪附红细胞体吉林感染株免疫原性蛋白,本试验采用2-D电泳分析猪附红细胞体蛋白表达谱,利用感染血清与二维电泳凝胶进行免疫印迹。结果表明:二维电泳共检测到(60±5)个蛋白质点,蛋白主要集中在pH值6~9和分子量45~25 ku。二维电泳中的9个蛋白点被猪附红细胞体感染血清所识别。本研究将为进一步开展猪附红细胞体病的疫苗和诊断候选分子研究奠定基础。
猪附红细胞体;吉林感染株;蛋白组学;2-DE图谱
猪附红细胞体是附着于猪红细胞表面的细胞外病原,可引起红细胞损伤和畸形。猪附红细胞体病急性临床症状为发热、急性贫血和低发病率、高死亡率的黄疸。慢性病例可引起母猪的繁殖效率降低,育肥猪生长迟缓,呼吸道和肠道疾病的发病率增加[1-5]。该病对我国养猪业的发展造成严重威胁。
所有生命现象的体现者和直接参与者是蛋白质。所以,只有通过对蛋白质进行整体、动态和网络水平上的分析,才能全面和深入地认识生命活动。在蛋白质组学技术诞生之前,对生命现象的研究往往仅针对某个单一蛋白,而蛋白质组学是从一个网络水平上来揭示蛋白质信号系统。大规模、高通量和整体蛋白质水平是蛋白质组学的研究特点,因此,蛋白质组学成为当前开发疫苗、药物和了解病原微生物生长、发育的有效手段,并在病原微生物研究中展现了无限的应用前景[6,7]。
蛋白质组学技术对于猪附红细胞体病的研究也是一种有效、必要的工具。本研究对解离的猪附红细胞体吉林感染株进行了蛋白组学二维电泳图谱分析和二维电泳凝胶的免疫印迹分析。旨在筛选猪附红细胞体免疫原性蛋白,为猪附红细胞体病的诊断和防治研究奠定基础。
1 材料与方法
1.1 主要试剂
猪淋巴细胞分离液、1.2 μm滤膜、CHAPS、二硫苏糖醇、Tris、TEMED、SDS和TCA等购自宝生物工程(大连)有限公司;13 cm pH值3~10梯度胶条、2-D Clean-up kit为GE公司产品。
1.2 阳性血液的鉴定
猪附红细胞体吉林感染株阳性血液的鉴定参照薛书江[8]的方法进行。
1.3 样本和感染血清的制备
1.3.1 样本的制备
将鉴定为阳性的抗凝血洗涤、白细胞去除、水浴、滤过和离心,收集病原体。超声裂解后12 000 r/min离心30 min。上清液移至新的离心管中,加入TCA,使终浓度达到10%。去上清,用预冷丙酮洗2次,沉淀干燥5 min。加入IPG Buffer溶解沉淀,室温离心5 min,保留上清。样本在水化前用2-D Clean-up试剂盒纯化。
1.3.2 感染血清的制备
参照郭莲娣的方法[9-10],略有改进。PCR检测确认小鼠未被猪附红细胞体感染。用猪附红细胞体检测呈阳性的血液腹腔接种给小鼠,之后采集小鼠血液,经血涂片染色和PCR检测猪附红细胞体。确认小白鼠被感染后,采集血液,制备血清,-80 ℃保存备用。
1.4 水化
取水化盘,添加280 μL制备好的蛋白样品。干胶条去掉保护膜后放入水化盘,胶面向下。胶条表面用1~2 mL矿物油完全覆盖,样品室温静置水化14~15 h。
1.5 蛋白样本的等电聚焦电泳
干胶条水化完成后放入聚焦槽中。铺设盐桥,按以下程序电泳:电压500 V,2 h;电压1 000 V,1 h;电压8 000 V,2.5 h;电压8 000 V,0.5 h。
1.6 蛋白样本的平衡
聚焦完成的胶条转移至平衡液Ⅰ[0.375 mol/L Tris-HCl(pH值8.8)、6 mol/L尿素、2% SDS、20%甘油、20 g/L DTT]中平衡15 min,再转移至平衡液Ⅱ[0.375 mol/L Tris-HCl(pH值8.8)、6 mol/L尿素、2% SDS、20%甘油、25 g/L IAA]中平衡15 min。将胶条上残留的平衡液用高纯度水洗净。
1.7 蛋白样本的SDS-PAGE电泳
胶条平衡后,放置于预先配置好的12% SDS-PAGE凝胶顶部,不要产生气泡。最后,加入低熔点琼脂糖封顶,然后将其放置到电泳槽内。电泳电压设置:起始为50 V,而后,适当增加电压。电泳完毕后,取出凝胶,切角进行标记。两板凝胶一板进行考马斯亮蓝染色,另一板进行免疫印迹。
1.8 凝胶的染色及脱色
将凝胶取出后置于先前配置好的固定液中处理40 min。考马斯亮蓝进行染色,然后脱色,直至凝胶上的蛋白点明显可视。
1.9 免疫印迹
在染色前对SDS-PAGE凝胶进行电转印。转印结束后,将转印有标准蛋白的膜切下,浸入到氨基黑染色液中染色,然后脱色。另一部分膜,依次进行一抗(猪附红细胞体感染血清)反应,酶标二抗(HRP标记羊抗鼠IgG )反应,然后进行底物显色,最后进行图像扫描。
1.10 图像的采集
用扫描仪将脱色至背景清晰的二维电泳凝胶扫描。扫描仪按如下设置:透射扫描模式,光学分辨率400 dpi。用保鲜膜将扫描后的凝胶包裹,4 ℃保存备用。
1.11 图像分析
将2-DE凝胶扫描图像和免疫印迹的扫描图像进行对比分析。根据所用干胶条的pH值和预染标准蛋白Marker的位置,分别确定蛋白质点的等电点和分子量大小。标记并记录感染血清识别的蛋白质点在2-DE凝胶上的位置。
2 结果与分析
2.1 猪附红细胞体阳性血液的鉴定
无菌采集抗凝血,制作血涂片。经吖啶橙染色和姬姆萨氏染色后的血涂片,镜检可见猪附红细胞体感染(图1,2)。图1可见血液涂片背景较清晰,红细胞呈淡绿色, 附红细胞体呈现橘红色荧光和绿色荧光2种,很容易分辨,且多为单体存在。部分血浆中呈游离状态的附红细胞体也可观察到荧光。由图2可见,红细胞呈淡红色,且红细胞形态出现变形,呈齿轮状。附红细胞体吸附在红细胞表面,被染为蓝紫色。

图1 猪附红细胞体吖啶橙染色(1 000×)

图2 猪附红细胞体吉姆萨氏染色(1 000×)
2.2 猪附红细胞体2-DE图谱
反复优化电泳条件的结果显示,应用13 cm、pH值3~10 的IPG 胶条、850 μg蛋白上样量、考马氏亮蓝染色,获得了较理想的猪附红细胞体双向电泳图谱(图3)。
由图3可见,共有(60±5)个蛋白斑点在猪附红细胞体蛋白组2-DE图谱中被检测到,而且大部分集中在pI 6~9范围内。检测到的蛋白斑点大部分分布在偏弱碱性区域(pH值6~9),分子量分布在66~15 ku,集中分布在45~25 ku。图谱显示,蛋白斑点可见度高、数量较多、分辨率高,凝胶背景染色浅。重复检测结果显示,斑点分布模式近乎相同,表现为形态大小存在差异以及分布无规律、颜色深浅不一。

图3 猪附红细胞体2-DE图谱
2.3 猪附红细胞体吉林感染株免疫原性蛋白的筛选
未经染色的2-DE凝胶进行电转印,用猪附红细胞体感染血清作为一抗,识别猪附红细胞体全病原体蛋白。
由图4A可知,猪附红细胞体感染血清识别2-DE凝胶中的9个蛋白质点。
由图4B可知,通过对猪附红细胞体蛋白的2-DE凝胶扫描图像和免疫印迹的扫描图像反复对比分析,在2-DE凝胶上找到了感染血清识别的共9个蛋白质点,标记为1~9。
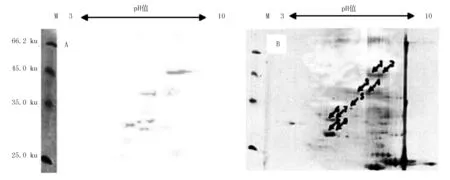
M:蛋白质分子质量标准;A:猪附红细胞体感染血清识别蛋白的免疫印迹;B:血清筛选的蛋白在2-DE凝胶中对应的蛋白质点;1~9:血清筛选的蛋白质点
图4 猪附红细胞体吉林感染株免疫原性蛋白的筛选结果
Fig.4 Screening results of immunogenicity protein ofM.suisin Jilin strain
3 讨论与结论
蛋白样品的制备直接影响二维电泳的成功与否,是双向电泳中最关键的一步。制备抗原的过程中尽可能抽提总蛋白,减少蛋白质的损失。另外,要注意提高蛋白样品的溶解度,减少蛋白质的人为修饰。在提取蛋白质的过程中,注意要排除无机盐小分子和核酸等大分子对蛋白质可溶性和二维电泳重复性的干扰。核酸等大分子能堵塞凝胶孔径,而无机盐小分子浓度过高会使等电聚焦的电压降低,甚至破坏IPG 胶条,最终都会导致2-D电泳的失败。本研究将收集的猪附红细胞体超声波裂解后,经TCA、冷丙酮和IPG Buffer处理,2-D Clean-up试剂盒纯化,获得了较理想的蛋白样本。
胶条的长度、pH值范围及凝胶染色方法等影响因素决定其样品添加量,而样品添加量对双向电泳效果产生重要影响。蛋白加样量过低,很难区别蛋白斑点或无法显示。而蛋白加样量过多,则会发生蛋白质点拖尾、重叠的现象,对试验结果造成影响。另外,染色方法也是影响试验结果的重要因素。考马斯亮蓝染色和银染是二维电泳常用的2种染色方法。考马斯亮蓝染色的优点是蛋白质斑点染色清晰,凝胶背景浅,可获得高质量图谱。缺点是分辨率不如银染法。银染的优点是灵敏度较高,蛋白质点染色清晰。缺点是高丰度蛋白容易干扰低丰度蛋白的显现,容易形成“空泡”,影响软件的识别和分析。本研究通过反复优化电泳条件,应用13 cm、pH值3~10 的IPG 胶条、850 μg蛋白上样量、考马氏亮蓝染色,获得了较好效果的蛋白图谱。
Hoelzle等[11]对人工感染猪附红细体的猪血液中分离了病原,并进行了二维电泳分析。结果得到了29个蛋白点,应用猪附红细体感染的猪抗血清检测到了11个免疫反应斑点。而本研究共检测到蛋白斑点(60±5)个,且多数斑点集中在偏弱碱性区域(pH值6~9);蛋白质的分子量分主要集中在45~25 ku。猪附红细胞体感染血清识别了2-DE凝胶中的9个蛋白质点。本研究的结果与Hoelzle等报道的有些差异,分析原因可能有2个方面:1) 由于病原体的地域差异;2) 二维电泳试验方法本身的性质决定,每次试验结果均存在一定差异。关于猪附红细胞体感染血清识别的蛋白的生物学活性和功能,还需在后续的试验研究中进一步挖掘。
[1] Messick J B.Hemotrophic mycoplasmas(hemoplasmas):a review and new insights into pathogenic potential[J].Vet Clin Pathol,2004,33:2-13.
[2] Neimark H,Johansson K E,Rikihisa Y,et al.Revision of haemotrophic Mycoplasma species names[J].Int J Syst Evol Microbiol,2002,52:683.
[3] 程跃红,余华,邓小红,等.猪支原体病的流行及防控策略[J].安徽农业科学,2013,41(36): 13921-13924.
[4] 张永富,马国文,武克炳,等.猪传染性胃肠炎和流行性腹泻混合感染的诊断与防治[J].内蒙古民族大学学报(自然科学版),2016,31(03):240-243.
[5] 朱学良,陈意伟,翟少伦,等.一例流浪猫巴尔通氏体病的诊断与治疗[J].安徽农业科学,2016,44(27):117.
[6] 陈龙.蛋白质组学[J].生物学教学,2000,25(11):1-2.
[7] 李向阳,王学理,刘 凯,等.牛布鲁氏菌不同种强毒株膜蛋白质组学差异的比较[J].安徽农业科学,2013,41(35):13464.
[8] 薛书江.猪附红细胞体吉林株单克隆抗体的制备应用和免疫蛋白组学研究[D].延吉:延边大学,2014.
[9] 郭莲娣,李佳川,曾鸣,等.TopBP1 多克隆抗体的制备及初步鉴定[J].西南民族大学学报(自然科学版) ,2016,42(01):34-38.
[10] 赵永军,战洪波,王亮,等.犬贾第虫MM/Sac-C/1基因的克隆及序列分析[J].内蒙古民族大学学报(自然科学版),2016,31(04):311-316.
[11] Hoelzle L E,Hoelzle K,Harder A,et al.First identification and functional characterization of an immunogenic protein in unculturable haemotrophic Mycoplasmas(Mycoplasma suis HspA1)[J].FEMS Immunology & Medical Microbiology,2007,49(02):215-223.
Analysis of two-dimensional electrophoresis map forMycoplasmasuisin Jilin strain
CONG Yanzhao1,2, NI Tingting1, WU Shengjun1, QI Kai3, XUE Shujiang1*
(1.AgriculturalcollogeofYanbianUniversity; 2.AnimalHealthandQuarantineStationofYanji;3.YanbianAnimalDiseasePreventionandControlCenterofJilinProvince,YanjiJilin131100,China)
In order to obtain the 2-DE map ofMycoplasmasuisin Jilin strain and screen the immunogenic protein ofMycoplasmasuis, the protein expression profile ofMycoplasmasuiswas analyzed by 2-D electrophoresis, immunoblotting was performed with infected sera and two-dimensional gel electrophoresis.The results indicated that 60±5 protein spots were detected by two-dimensional electrophoresis,the proteins were mainly concentrated in the range of molecular weight 45 ~25 ku and pH 6~9.The 9 spots in the two-dimensional electrophoresis were identified by infected sera ofMycoplasmasuis.This study would lay the foundation for the further study ofMycoplasmasuisin swine and the candidate molecules of vaccine.
Mycoplasmasuis; Jilin strain; proteomics; 2-DE map
2017-01-10 基金项目:国家自然基金项目(31460657);吉林省科技厅青年科研基金项目(20150520129JH)
丛艳昭(1982—),男,吉林扶余人,兽医师,硕士,研究方向为动物寄生虫。薛书江为通信作者,E-mail:sjxue@ybu.edu.cn
1004-7999(2017)01-0061-05
10.13478/j.cnki.jasyu.2017.01.010
S858.28
A
