1株耐Cd细菌的分离、鉴定及其吸附特性研究
2017-05-17徐淑霞杜文涛王晓雅张继冉张世敏
徐淑霞,杜文涛,王晓雅,张继冉,张世敏,吴 坤
(河南农业大学 生命科学学院/农业部农业微生物酶工程重点实验室,河南 郑州 450002)
1株耐Cd细菌的分离、鉴定及其吸附特性研究
徐淑霞,杜文涛,王晓雅,张继冉,张世敏,吴 坤*
(河南农业大学 生命科学学院/农业部农业微生物酶工程重点实验室,河南 郑州 450002)
从长期受农药污染的土壤中分离筛选到1株可耐受重金属Cd的菌株,经形态观察、生理生化特性、16S rRNA基因序列和系统发育分析确定该菌株为路德维希肠杆菌(Enterobacterludwigii),命名为EM1,为Cd污染水体及土壤的修复提供微生物菌株。在无机盐培养基中菌株EM1对Cd2+的最适耐受质量浓度为50 mg/L,吸附Cd2+的最适生长温度为35 ℃,最适pH值为6.0,在此条件下,其对Cd2+的吸附率最大,为92%。电镜扫描结果表明,在吸附Cd2+的过程中菌体表面分泌大量的胞外多聚物且菌体形态发生变化。红外光谱分析显示,Cd2+胁迫条件下,菌体细胞壁结构并未发生变化,菌株吸附Cd2+的过程主要与菌体表面的羟基、N-H、C-H、多糖中的C-O-C及酰胺基团有关。
耐镉细菌; 路德维希肠杆菌; 生物吸附; 电镜观察; 红外光谱分析
随着国家工业水平的提高,工业迅速发展带来的环境问题也越来越严重。由于采矿、冶炼、电镀等产业的快速发展,大量含有重金属离子的工业废水排放到环境中,引起生态恶化,对环境造成严重危害。重金属污染是目前环境污染中日趋严重的一种污染方式,其中镉(Cd)是污染程度最严重的重金属之一[1]。Cd具有一定的致癌和致突变性,是一种毒性很强的重金属元素。它能经食物链在动植物体内富集,并对动物内脏器官以及血液循环系统产生一系列损伤,从而对动物尤其是人类的健康产生威胁[2]。重金属污染是我国水体和土壤环境中普遍存在的污染形式,并对农产品安全和人体健康构成严重威胁。因此,必须重视重金属污染问题,探索经济高效的污染修复技术,为国家粮食安全及农业的可持续发展奠定基础。环境中重金属污染的处理方法有许多种,在众多的处理方法中,利用微生物作为吸附剂去除工业废水及其污染土壤中的重金属离子具有吸附容量大、速度快、选择性好、成本低、易再生等优点[3],具有广阔的应用前景,已成为目前研究的热点。目前,重金属在环境中的存在与安全性逐渐被人们所重视,但有关其对生物的毒害机制及生物治理的研究还处于探索阶段,相关报道较少。Holan等[4]研究发现,海藻对Cd去除率达99%;李清彪等[5]研究了白腐真菌对Pb的吸附,吸附率达到95%以上;Arivalagan等[6]从电镀厂土壤中分离得到1株抗Cd菌株B.cereusKTSMBNL 43,在适宜的条件下,其对Cd2+的最大生物吸附率达82%;Polti等[7]分离出能够同时去除重金属Cd2+和农药林丹的5株放线菌,其中放线菌M7对2种污染物的去除率都较高,为40%左右;Olaniran等[8]研究发现,在Pb和Hg存在的条件下,微生物对1,2-二氯乙烷在土壤中的降解产生负面影响,且生物刺激可以对1,2-二氯乙烷微生物降解产生积极的影响。以上研究表明,生物方法尤其是微生物方法用于修复重金属污染具有可行性。鉴于此,从长期受农药污染的土壤中分离耐Cd细菌,对其进行鉴定,分析其吸附特性,并利用扫描电镜、红外光谱等分析手段对其在吸附Cd过程中细胞表面活性基团的变化进行了初步研究,从而确定其重金属结合位点及与吸附作用相关的细胞成分,进而为研究菌体吸附重金属的机制提供理论依据,并为微生物在Cd污染治理中的应用提供一定的技术支持。
1 材料和方法
1.1 材料
1.1.1 土样 土样采自河南一农药厂。
1.1.2 培养基 无机盐培养基:K2HPO41.0 g、NaH2PO41.0 g、CaCl2·H2O 0.02 g、MgSO4·7H2O 0.2 g、NH4NO31.0 g、FeCl3·3H2O 0.05 g、水1 000 mL。
LB培养基:NaCl 10.0 g、胰蛋白胨10.0 g、酵母粉5.0 g、水1 000 mL。
1.1.3 仪器 主要仪器为MIKRO-22R高速冷冻离心机、JSM.6490LV扫描电子显微镜、DZF-6020真空干燥箱、VERTEX70傅里叶变换红外光谱仪。
1.2 方法
1.2.1 耐Cd菌株的分离与纯化 取10 g采集的土样加入到90 mL带玻璃珠的无菌水中制成土壤悬液。采用10倍梯度稀释法对土壤悬液进行稀释,取1 mL稀释度为10-6的菌悬液加入到含有100 mg/L Cd2+的固体LB培养基中,35 ℃培养5 d,将获得的单菌落采用平板划线法进行纯化。
1.2.2 耐Cd菌株的鉴定
1.2.2.1 耐Cd菌株的形态观察及生理生化特性分析 将所得单菌落接种于LB培养基内,于35 ℃、160 r/min摇床中培养,取1 mL稀释度为10-6的菌液涂布平板,培养24 h,观察菌落形态,并参照《微生物学实验技术》[9]进行革兰氏染色。细菌常规的生理生化鉴定试验参照《常见细菌系统鉴定手册》[10]进行。
1.2.2.2 耐Cd菌株的16S rRNA基因序列分析及系统发育树构建 细菌总DNA利用DNA提取试剂盒提取。引物为16S rRNA通用引物,27F:5′-AGAGTTTGATCCTGGCTCAG-3′、1492R:5′-CTACGGCTACCTTGTTACGA-3′。PCR反应体系(50 μL)为:Taq聚合酶(5 U/μL) 1.0 μL、基因组DNA(20 ng/μL)1.0 μL、10×Buffer (含2.5 mmol/L Mg2+) 5.0 μL、dNTP(10 mmol/L)1.0 μL、27F 引物(10 μmol/L)和1492R 引物(10 μmol/L)各1.5 μL、ddH2O 39.0 μL。PCR反应条件:94 ℃10 min;94 ℃1 min、54 ℃1 min、72 ℃1.5 min,25个循环;72 ℃10 min终止。PCR产物利用回收试剂盒纯化后,交由上海生工生物工程有限公司测序。将测得的序列在NCBI上进行BLAST比对分析,利用软件MEGA 6.0构建16S rRNA基因系统发育树。
1.2.3 耐Cd菌株吸附Cd2+条件的优化
1.2.3.1 外源Cd2+质量浓度 将处于对数期的耐Cd菌株接种到含有50 mL pH值为7.0以葡萄糖为碳源的无机盐液体培养基中,Cd2+添加量分别为0、25、50、100、200 mg/L,在35 ℃、160 r/min条件下培养8 h,然后用紫外分光光度计测定OD600值,每个样品3个平行,计算平均值,确定耐Cd菌株对Cd2+的耐受质量浓度。
1.2.3.2 温度 将处于对数期的耐Cd菌株接种于Cd2+质量浓度为50 mg/L的无机盐培养基(添加0.1%的葡萄糖作为碳源)中,于25、30、35、40、45 ℃条件下培养6 d,离心(10 000 r/min、15 min)后获得上清,经2%稀硝酸稀释后测定Cd2+含量,考察温度对耐Cd菌株吸附Cd2+性能的影响。
1.2.3.3 pH值 配制含Cd2+质量浓度为50 mg/L的无机盐培养基,pH值分别为5.0、6.0、7.0、8.0、9.0,接种处于对数期的耐Cd菌株,于最适温度培养6 d,离心(10 000 r/min、15 min)后获得上清,经2%稀硝酸稀释后测定Cd2+含量,考察pH值对耐Cd菌株吸附Cd2+性能的影响。
1.2.4 Cd2+含量的测定 采用原子吸收光谱(AAS)测定Cd2+含量,AAS检测条件:火焰类型Air-C2H2、燃气流量1.8 L/min、助燃气流量15 L/min、检测波长228.8 nm。
1.2.5 耐Cd菌株的扫描电镜分析 将筛选获得的耐Cd菌株分别接种于含有0(对照)、50、100、200 mg/L Cd2+的无机盐培养基(添加0.1%的葡萄糖作为碳源)中,于35 ℃、160 r/min摇床中培养6 d,然后于4 ℃条件下160 r/min离心5 min,收集菌体。菌体于2.5%的戊二醛溶液中固定4 h ,固定后的菌体于0.1 mol/L、pH值7.0的磷酸缓冲液中清洗3次,然后依次用30%、50%、70%、85%、95%的乙醇分别对菌体进行脱水15 min,用100%乙醇脱水2次,每次20 min,最后乙酸异戊酯置换2次,每次20 min[11]。随后将处理好的菌体转移到洁净锡箔纸上,置于真空干燥箱中干燥24 h,使菌体充分干燥,然后喷金、电镜观察。
1.2.6 耐Cd菌株的红外吸收光谱分析 将在含有0(对照)、50、100、200 mg/L Cd2+的无机盐培养基(0.1%葡萄糖作为碳源)中培养6 d的耐Cd菌体离心(4 ℃条件下,160 r/min离心5 min),收集菌体,然后于0.1 mol/L、pH值7.0的磷酸缓冲液中洗涤,冷冻干燥后与KBr粉末充分混合均匀,研磨压片后置于FTIR样品仓中进行红外吸收光谱分析[12]。
2 结果与分析
2.1 耐Cd菌株的形态特征及生理生化特性
从长期受农药污染的土壤中分离获得1株耐Cd细菌,命名为EM1。由图1可知,该菌菌落呈白色、黏液状,菌体表面较湿润,用接种环挑起时易拉成丝。革兰氏染色结果(图2)表明,菌株EM1为革兰氏阴性菌,细胞呈杆状。菌株EM1的柠檬酸盐利用试验、接触酶试验、V-P试验及淀粉水解试验均为阳性;吲哚试验及甲基红试验均为阴性(表1)。
图1 耐Cd菌株的菌落形态
图2 耐Cd菌株的革兰氏染色结果

试验名称结果试验名称结果柠檬酸盐利用试验+吲哚试验-接触酶试验+淀粉水解试验+V-P试验+甲基红试验-
注:+代表阳性,-代表阴性。
2.2 菌株EM1的16S rRNA基因序列及系统发育分析
PCR扩增产物的琼脂糖凝胶电泳结果(图3)显示,菌株EM1的16S rRNA基因片段约为1 500 bp。将PCR产物纯化,测序后将获得的序列在NCBI上进行BLAST比对,并构建系统发育树(图4),结果表明,菌株EM1与路德维希肠杆菌(EnterobacterludwigiiEN-119)的同源性达99%,结合形态学和生理生化特性鉴定EM1为路德维希肠杆菌(Enterobacterludwigii)。
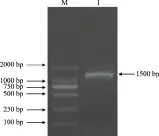
M:DL2000 DNA Marker; 1:PCR产物
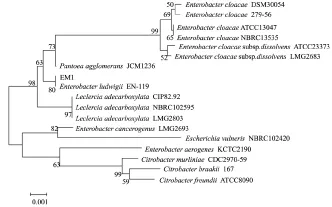
图4 菌株EM1菌株基于16S rRNA基因序列的系统发育树
2.3 菌株EM1吸附Cd2+的最优条件
微生物吸附重金属的过程与菌体的生长代谢密切相关,菌体的正常生长是高效富集重金属离子的保证,而微生物的生长会受到多种环境因素的影响。因此,研究不同环境因子对菌体吸附重金属离子过程的影响,有利于优化吸附条件,为环境中重金属离子的治理提供一定的技术依据。
2.3.1 外源Cd2+质量浓度 微生物在生长过程中受各种外界环境因素的影响,若培养条件适宜,则微生物能够进行正常的生长代谢活动,反之则生长受到抑制甚至发生变异或死亡。由图5可知,以葡萄糖为碳源不添加Cd2+时,菌体OD600为0.33,菌体生长相对较好。当加入25、50 mg/L Cd2+时,菌体OD600均为0.30,菌体仍可正常生长。随着重金属Cd2+质量浓度的不断增加,菌体OD600逐渐减小,当Cd2+质量浓度分别为100、200 mg/L时,菌体生长受到明显抑制,菌体OD600分别为0.02、0.01。这是由于重金属Cd2+的毒性较大, 高质量浓度的Cd2+产生的毒性抑制了菌株的生长,从而导致OD600下降。以上结果表明,EM1可耐受200 mg/L的Cd2+,且对Cd2+的最适耐受质量浓度为50 mg/L。
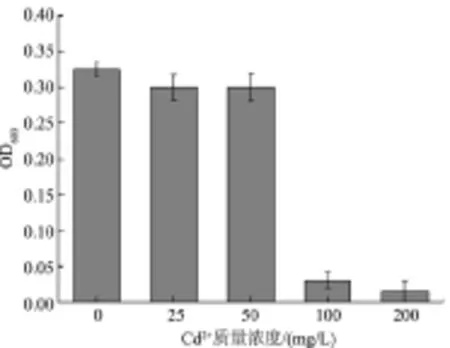
图5 重金属Cd2+质量浓度对菌体生长量的影响
2.3.2 温度 温度在菌体吸附重金属离子时起到很重要的作用,温度会影响细胞壁的稳定性及结合位点表面官能团的电离,从而影响微生物吸附重金属的过程。从图6可以看出,随着温度升高,菌株EM1对重金属Cd2+的吸附率呈先增加后降低的趋势。在温度为25 ℃时,菌株EM1对Cd2+的吸附率为32%;温度为35 ℃时,菌株EM1对Cd2+的吸附率最大,为90%;随着温度的进一步升高,当温度为45 ℃时,吸附率则下降为30%。综上,菌株对50 mg/L Cd2+吸附的最适温度为35 ℃。
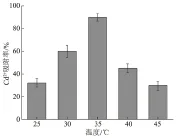
图6 温度对菌株EM1吸附Cd2+的影响
2.3.3 pH值 生物吸附能力取决于生物量的多少及菌体表面所带电荷可与金属离子位点结合的多少[13],且微生物在生长过程中机体时刻发生着酶促反应,只有在适宜的pH值范围内酶促反应速率才能达到最高,高于或低于这个范围微生物生长都会被抑制。因此,pH值也是影响菌体吸附Cd2+的一个重要因素。由图7可知,随着pH值升高,菌株EM1对Cd2+的吸附率呈先增加后降低的趋势。当pH值为6.0时,菌株EM1对Cd2+的吸附率最高,为92%。这是因为当溶液体系中pH值较低时,H+浓度较高,从而形成大量的H3O+占据着菌体表面大多数的金属结合位点,抑制Cd2+与相关基团的结合,进而导致吸附率降低。随着pH值升高,当pH值为6.0时,生物质表面官能团的离解度增加,静电相互作用增强,生物质表面的负电荷也随之增多,因此促进了对带正电的Cd2+的富集,菌株EM1对Cd2+的吸附率最高。pH值进一步升高,Cd2+的富集率降低,这可能是由于pH偏碱性时,Cd2+与溶液中的-OH形成沉淀,进而导致Cd2+吸附率降低。综上,菌株对50 mg/L Cd2+吸附的最适pH值为6.0。
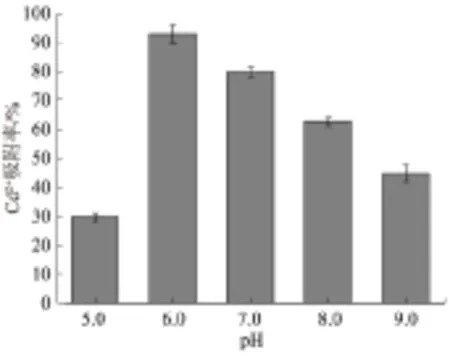
图7 pH值对菌株EM1吸附Cd2+的影响
2.4 菌株EM1吸附Cd2+前后的扫描电镜分析
不同质量浓度Cd2+胁迫条件下菌株EM1的电镜扫描结果如图8所示。由图8可以看出,对照组(图8a)细胞呈短棒状,细胞长约5 μm,宽约2 μm,菌体饱满,表面光滑平整,生长状态良好,个体形态明显。对处理组(图8b、c)进行观察发现,随着重金属Cd2+质量浓度的升高,细胞表面开始有少量分泌物生成并伴随着轻微的集聚现象;当Cd2+质量浓度进一步增大时(图8d),菌体细胞严重皱缩变小并由短棒状变为椭球状,同时菌体周边生成大量白色雾状的多聚物使细胞之间相互嵌合,集聚现象更加明显。有研究表明,在重金属离子胁迫条件下,菌体的形态及细胞膜的通透性会发生改变并分泌大量的胞外多聚物,这些多聚物可以为重金属提供众多的结合位点,进而形成一道选择性屏障阻止重金属离子进入细胞内部[14]。因此,菌体形态的变化及多聚物的分泌是对环境压力产生的一种保护机制。

a.对照; b.50 mg/L Cd2+; c.100 mg/L Cd2+; d.200 mg/L Cd2+
2.5 菌株EM1吸附Cd2+前后的红外吸收光谱分析
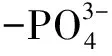
综合分析发现,菌体对重金属吸附前后的红外光谱图在吸光度上有较大的差异,而峰型则基本保持一致,并没有明显的新峰出现,表明吸附过程中Cd2+并未对菌体细胞壁造成破坏,这也进一步证明,菌体对Cd2+的富集过程为表面吸附,且参与Cd2+吸附过程的只是菌体表面的一些活性基团。当菌体吸附的Cd2+质量浓度增大时,3 422、2 927、2 962 cm-1处的谱峰均出现不同程度的宽化、增强并伴随着向低波数的红移现象,而1 651、1 540 cm-1处的酰胺带,1 065 cm-1处多糖吸收带的吸收峰则变得尖而窄,并同样伴随着吸光度增加的现象,这表明菌体表面主要含有蛋白质、脂质及多糖类物质。综上所述,羟基、N-H、C-H、酰胺基团及多糖中的C-O-C是菌体表面吸附、螯合或络合金属离子的主要活性基团。

a.对照; b:50 mg/L Cd2+; c.100 mg/L Cd2+; d.200 mg/L的Cd2+
3 结论与讨论
本研究从长期受农药污染的土壤中分离筛选到1株可耐受重金属Cd的菌株。经形态观察、生理生化特性、16S rRNA基因序列及系统发育分析,确定该菌株为路德维希肠杆菌(Enterobacterludwigii),命名为EM1。研究表明,路德维希肠杆菌可用于去除废水中的Cd2+[19],且还具有解钾、解磷的特性[20],可作为生物肥料的备选菌株。因此,将其应用于Cd2+污染环境的治理具有广阔的前景。本研究结果表明,EM1最高可耐受200 mg/L的Cd2+,且菌株EM1对Cd2+的最适耐受质量浓度为50 mg/L,吸附Cd2+的最适生长温度为35 ℃,最适pH值为6.0,在此条件下,其对Cd2+的吸附率最大,为92%。电镜扫描结果显示,菌体呈短棒状,细胞长约5 μm,宽约2 μm,Cd2+胁迫条件下菌体由短棒状变为椭球状,同时菌体周边生成大量白色雾状的多聚物,并伴随着集聚现象,表明Cd2+胁迫过程中菌体表面会形成大量的分泌物并参与 Cd2+的吸附过程。有研究表明,在微生物对重金属离子的抗性机制中,菌体会产生胞外分泌物如多糖、酶等大分子有机物,参与重金属的吸附并在细胞表面累积,以减少重金属离子浓度起到解毒的作用,而这些物质多是由染色体或质粒编码[21],其中后者居多。红外光谱分析结果显示,菌体表面主要含有蛋白质、脂质及多糖类物质,菌体吸附Cd2+前后红外光谱图的峰型基本保持一致,只是一些特征峰的吸收位置和强度发生了变化,说明菌体对Cd2+的吸附过程中细胞成分及整体结构并未发生变化,该过程为表面吸附过程,而参与菌体吸附、螯合或络合金属离子的主要活性基团主要为细胞壁表面的羟基、N-H、C-H、多糖中的C-O-C及酰胺基团。
微生物修复是消除环境中重金属污染的有效手段,但实验室中筛选出的高效富集菌株直接应用于环境污染修复难度相对较大,主要是因为细菌应用于重金属的富集时受多种因素的影响。为此,本研究对菌株EM1的吸附特性进行研究,以期为Cd2+污染环境的治理与修复提供必要的基础资料。
[1] 刘标,尹红梅,陈薇,等.高效镉吸附菌株的筛选及生物学特性[J].江苏农业科学,2014,42(3):316-318.
[2] 刘爱民,黄为一.耐镉菌株的分离及其对Cd2+的吸附富集[J].中国环境科学,2006,26(1):91-95.
[3] 张玉秀,于飞,张媛雅,等.植物对重金属镉的吸收转运和累积机制[J].中国生态农业学报,2008,16(5):1317-1321.
[4] Holan Z R,Volesky B,Prasetyo I.Biosorption of cadmium by biomass of marine algae[J].Biotechnology & Bioengineering,1993,41(8):548-549.
[5] 李清彪,吴涓,杨宏泉,等.白腐真菌菌丝球形成的物化条件及其对铅的吸附[J].环境科学,1999,20(1):33-38.
[6] Arivalagan P,Singaraj D,Haridass V A.Removal of cadmium from aqueous solution by batch studies usingBacilluscereus[J].Ecological Engineering,2014,71(10):728-735.
[7] Polti M A,Aparicio J D,Benimeli C S,etal.Simultaneous bioremediation of Cr(Ⅵ) and lindane in soil by actinobacteria[J].International Biodeterioration & Biodegradation,2014,88(2):48-55.
[8] Olaniran A O,Naicker K,Pillay B.Antibiotic resistance profiles ofEscherichiacoliisolates from river sources in Durban,South Africa[J].World Journal of Microbiology & Biotechnology,2009,25(10):1743-1749.
[9] 吴坤,张世敏.微生物学实验技术[M].北京:气象出版社,2004:10-12.
[10] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[11] 谢家仪,董光军,刘振英,等.扫描电镜的微生物样品制备方法[J].电子显微学报,2005,24(4):440.
[12] 谢朝阳,黄巧云,李素霞,等.耐重金属细菌与土壤胶体体系吸附Cu2+、Cd2+的红外光谱研究[J].安徽农业科学,2010,38(1):35-37.
[13] Fan J,Okyay T O,Rodrigues D F.The synergism of temperature,pH and growth phases on heavy metal biosorption by two environmental isolates [J].Journal of Hazardous Materials,2014,279(8):236-243.
[14] Sun X F,Wang S G,Zhang X M,etal.Spectroscopic study of Zn2+and Co2+binding to extracellular polymeric substances(EPS)from aerobic granules[J].Journal of Colloid and Interface Science,2009,335(1):11-17.
[15] 翁诗甫.傅里叶变换红外光谱分析[M].北京:化学工业出版社,2010:25-41.
[16] 苏艳蓉,柴立元,杨志辉,等.PannonibacterphragmitetusT1菌对Pb2+的吸附特性[J].中国有色金属学报,2011,21(12):3211-3217.
[17] 韩润平,李建军,鲍改玲.酵母菌吸附铅前后红外光谱比较[J].光谱实验室,2000,17(4):385-387.
[18] 刘瑞霞,潘建华,汤鸿霄,等.Cu(Ⅱ)离子在Micrococcusluteus细菌上的吸附机理[J].环境化学,2002,21(1):50-55.
[19] 徐雅雅,张建霞,朱晓丽,等.一株路德维希肠杆菌处理含镉废水的效应分析[J].化学工程,2015,43(6):1-5.
[20] 王金昌,郑国华,傅筱冲.一株解钾解磷菌株的筛选[J].江西科学,2014,32(1):51-53,103.
[21] 王昭,王席,杨威,等.金属硫蛋白基因M1TA在大肠杆菌中的自诱导表达条件优化及抗镉条件[J].河南农业科学,2016,45(5):66-70.
Isolation,Identification and Adsorption Characteristics of a Cd-tolerant Bacterium
XU Shuxia,DU Wentao,WANG Xiaoya,ZHANG Jiran,ZHANG Shimin,WU Kun*
(College of Life Sciences,Henan Agricultural University/Key Laboratory of Agricultural Microbial Enzyme Engineering of Ministry of Agriculture,Zhengzhou 450002,China)
A Cd-tolerant strain was isolated from the pesticide polluted soil,on the basis of morphological observation,physiological and biochemical characteristics,16S rRNA gene sequence and phylogenetic analysis,the strain was identified asEnterobacterludwigii,and named as EM1,so as to provide strain for remediation of Cd polluted water and soil.The optimal Cd2+concentration of strain EM1 against Cd2+was 50 mg/L,the optimum growth temperature of strain EM1 against Cd2+was 35 ℃,and the optimum pH value of strain EM1 against Cd2+was about 6.0.Under this condition,the Cd2+adsorption rate of EM1 was the highest,reached 92%.The SEM results showed that in the process of adsorption of Cd2+,the morphology of the strains was changed,and a large number of extracellular polymeric substances were secreted on the strain surface.Infrared scanning analysis showed that under the Cd2+stress condition,the cell walls structure had not changed,and hydroxy,N-H,C-H,C-O-C and aminoacyl were confirmed to be the key functional groups for the strain to adsorb Cd2+.
Cd-tolerant bacterium;Enterobacterludwigii; bioadsorption; electron microscopic observation; infrared spectroscopy analysis
2017-02-20
河南省重点科技攻关项目(152102110054); 河南省高等学校重点科研项目(15A180005)
徐淑霞(1971-),女,河南灵宝人,副教授,博士,主要从事环境污染物的微生物转化和修复研究。 E-mail:xushuxia97@163.com
*通讯作者:吴 坤(1963-),男,河南平舆人,教授,博士,主要从事环境污染物的微生物降解研究。 E-mail:wukun63@126.com
X172;X53
A
1004-3268(2017)05-0071-07
