不同降解菌对甲基毒死蜱及3,5,6-三氯-2-吡啶酚的降解能力比较
2017-05-17李晓楼
李晓楼
(四川职业技术学院 建筑与环境工程系,四川 遂宁 629000)
不同降解菌对甲基毒死蜱及3,5,6-三氯-2-吡啶酚的降解能力比较
李晓楼
(四川职业技术学院 建筑与环境工程系,四川 遂宁 629000)
为掌握微生物降解甲基毒死蜱的特性与机制,首先从土壤中分离不同的甲基毒死蜱降解菌,然后对其降解效率、降解过程中中间产物3,5,6-三氯-2-吡啶酚(TCP)的质量浓度变化、对TCP与其他6种有机磷农药的降解能力以及磷酸酯酶活性进行了测试分析。结果表明,分离到2株能高效降解甲基毒死蜱的菌株,经鉴定命名为地衣芽孢杆菌ZL-7与荧光假单胞菌ZHLXL-2,其降解甲基毒死蜱的5 d降解率分别为90.6%和99.4%;在菌株ZL-7降解甲基毒死蜱的过程中检出了TCP,而在菌株ZHLXL-2的降解过程中未检出。菌株ZHLXL-2能降解TCP,48 h降解率可达91.0%,而菌株ZL-7不能降解TCP。两菌株都能降解6种供试的有机磷农药,但菌株ZL-7降解率更高,其10 d降解率在92.1%~99.8%,菌株ZHLXL-2的10 d降解率为89.2%~93.4%;同时菌株ZL-7的磷酸酯酶活性显著高于菌株ZHLXL-2。分析表明,这2种菌株的磷酸酯酶活性与其降解有机磷农药的能力呈正相关性,而菌株ZHLXL-2因可有效降解中间物TCP,从而能更快地降解甲基毒死蜱。
地衣芽孢杆菌; 荧光假单胞菌; 有机磷农药;甲基毒死蜱; 3,5,6-三氯-2-吡啶酚; 降解
甲基毒死蜱(O,O-二甲基-O-3,5,6-三氯-2-吡啶基硫逐磷酸酯)是一种广谱型有机磷杀虫剂,它通过抑制乙酰胆碱酯酶的活性,干扰害虫正常的神经传导,并导致害虫死亡[1]。甲基毒死蜱在世界范围内作为商品杀虫剂应用已有约40 a的历史,1975年其被联合国粮农组织和世界卫生组织认可,推荐作为储粮害虫防护剂使用,并作为防治卫生害虫的有机磷农药之一[2]。
甲基毒死蜱的大量应用可能导致其在农作物中广泛残留,并不可避免地导致土壤及水体污染,这些均会对人类健康及生态环境造成潜在危害。因此,需要充分掌握甲基毒死蜱的残留状况及降解机制,并探索如何从污染的土壤、水体或农作物中去除甲基毒死蜱等农药残留。通常,具降解能力的微生物被认为在有机磷农药的环境分解及解毒中起重要作用[3]。目前也已经分离了一些甲基毒死蜱的降解菌株,例如:Kim等[4]分离到一株能高效降解甲基毒死蜱的伯克霍尔德氏菌Burkholderiasp.KR100,它能将甲基毒死蜱完全降解,同时也能降解乐果、马拉硫磷以及毒死蜱等多种有机磷农药;Abraham等[5]获得的一株鞘氨醇杆菌Sphingobacteriumsp.JAS3也能有效降解甲基毒死蜱。微生物降解甲基毒死蜱的关键步骤是将其水解为3,5,6-三氯-2-吡啶酚(TCP),但是降解中间物TCP在自然环境中的稳定性较其母体更高,导致TCP较甲基毒死蜱更难降解,并且还会抑制某些磷酸酯键水解酶对甲基毒死蜱的分解,这一般是由于TCP 与酶发生某种程度的结合进而影响了酶活性[4,6]。另外,TCP也具有较大的毒性,且水溶性比甲基毒死蜱更高,导致其更容易污染水体和土壤,从而放大其危害[7]。在研究甲基毒死蜱生物降解特性的过程中发现,某些甲基毒死蜱降解菌仅能将其分解为TCP,而不能将TCP降解,这可能导致只是在名义上消除了甲基毒死蜱残留。为此,从土壤中分离获得不同的甲基毒死蜱降解菌地衣芽孢杆菌ZL-7与荧光假单胞菌ZHLXL-2,对比分析二者在甲基毒死蜱降解速率、TCP降解能力、磷酸酯酶活性以及有机磷农药降解能力等方面的参数,以期更完整地掌握微生物降解甲基毒死蜱的特点和机制,并为处理甲基毒死蜱及相关农药污染打下更坚实的基础。
1 材料和方法
1.1 材料
试剂:甲基毒死蜱(98%)与甲基毒死蜱标准品购自Sigma-Aldrich公司(美国),TCP购自Dr.Ehrenstorfer公司(德国),乙腈、丙酮购自Merck公司(德国),所有化学试剂均为分析纯或以上级别。
蛋白酶抑制剂混合物:0.3 mg/mL EDTA、35 μg/mL苯甲基磺酰氟(PMSF)、0.7 μg/mL抑肽素(pepstatin)、0.5 μg/mL亮肽素(leupeptin)。
培养基:(1)营养肉汤培养基:蛋白胨10 g、牛肉浸膏3 g、氯化钠5 g、蒸馏水1 L,pH值7.0;(2)LB培养基:蛋白胨 10 g、酵母提取物5 g、氯化钠10 g、蒸馏水1 L,pH值7.0;(3)甲基毒死蜱降解菌分离培养基:K2HPO40.61 g、KH2PO40.39 g、KCl 0.25 g、MgSO4·7H2O 0.13 g、蒸馏水1 L、微量元素液1.0 mL(每升微量元素液含CaCl2·2H2O 1.0 mg、FeSO4·7H2O 40 mg、MnSO4·4H2O 40 mg、ZnSO4·7H2O 20 mg、CuSO4·5H2O 5 mg、NaCl 1.0 g), pH值自然;甲基毒死蜱的添加量根据试验需要确定。
仪器:岛津UV-2550分光光度计(日本)、AgilentTM7890A气相色谱仪(美国)、AgilentTM1200液相色谱仪(美国)、IKATM匀浆机 (德国)、Sigma 3K30离心机(德国)、华美QHZ-98B振荡培养箱(中国太仓)、梅特勒S20K pH计(瑞士)、VCX130 Sonics超声波细胞破碎仪(美国)、N-EVAP氮吹浓缩器(美国)、EscoTM超净工作台(新加坡)。
1.2 方法
1.2.1 甲基毒死蜱降解菌的分离与鉴定 用于降解菌分离的土壤样品取自四川遂宁农田(使用甲基毒死蜱3 a以上)。取土样2.5 g接种于 100 mL甲基毒死蜱降解菌分离培养基(甲基毒死蜱质量浓度为50 mg/L)中,30 ℃振荡培养(120 r/min),每隔1 d测定甲基毒死蜱残留质量浓度(测定方法参照文献[2])。取3 d降解率[降解率=(1-残余量/添加量)×100%]大于40%的培养液5 mL,转接到含相同质量浓度甲基毒死蜱的降解菌富集培养基(营养肉汤)中,连续转接5 次以上;再次验证降解效果后,在甲基毒死蜱降解菌分离培养基平板上涂布富集培养液,30 ℃倒置培养,挑取生长旺盛的优势菌落在培养基平板上划线,分离纯化得到甲基毒死蜱降解菌的纯培养。微生物生化分析参考《Bergey’s manual of determinative bacteriology》[8]和《常见细菌系统鉴定手册》[9];菌种鉴定采用BiologTM微生物鉴定系统和16S rDNA序列分析法。
1.2.2 降解菌ZL-7与ZHLXL-2接种体的准备 分离纯化的甲基毒死蜱降解菌经肉汤培养后,5 500 r/min离心8 min,收集菌体,用无菌水洗涤3遍并重悬至OD600=1.8,该悬浮液作为后续甲基毒死蜱及TCP降解试验的接种体。
1.2.3 菌株ZL-7与ZHLXL-2降解甲基毒死蜱过程中TCP的测定 在甲基毒死蜱降解菌分离培养基(甲基毒死蜱质量浓度为50 mg/L)中接入2%的ZHLXL-2 或ZL-7接种体,然后将其置入摇床中(120 r/min, 30 ℃)培养,每隔24 h取样测试TCP质量浓度,同时测定残留甲基毒死蜱的质量浓度。TCP的测定参照文献方法[10]。
1.2.4 菌株ZL-7与ZHLXL-2对TCP的降解能力测定 在甲基毒死蜱降解菌分离培养基(其中的甲基毒死蜱用TCP代替,质量浓度为50 mg/L)中接入2%的接种体,然后将其置入摇床中(120 r/min, 30 ℃)培养4 d以上,每隔12 h取样测试TCP质量浓度,用以评价不同菌株对TCP的降解能力。
1.2.5 菌株ZL-7与ZHLXL-2对另外6种有机磷农药的降解能力测定 取灭菌土壤(土壤取自四川省遂宁市抛荒耕地,未检出甲基毒死蜱及另外6种供试有机磷农药, 121 ℃灭菌30 min)分成6组。第1组:在土壤中添加经无菌处理的甲胺磷农药,使其含量为100 mg/kg,然后再接种菌株ZHLXL-2,接种量为每100 g土壤中添加10 mL接种体,并以未接种菌株ZHLXL-2的土样作为对照,最后将其置于培养箱中培养,培养期间土壤的持水量调节至40%,每间隔48 h取样测定农药残留的质量浓度,连续测试14 d,以评价菌株ZHLXL-2对土壤中有机磷农药的降解效应。第2组至第6组中除试验农药依次改变为甲拌磷、久效磷、甲基对硫磷、杀螟硫磷和水胺硫磷以外,其他均与第1组相同。按同样方法测试菌株ZL-7对6种有机磷农药的降解能力。土壤中有机磷农药残留的分析方法参照国标GB/T 14552—2003[11]。
1.2.6 菌株ZL-7与ZHLXL-2的磷酸酯酶活性测定 磷酸酯酶活性的测定参照Subhas等[12]和Bhadbhade等[13]的方法。取菌株ZHLXL-2培养液100 mL,加入0.75 mL蛋白酶抑制剂混合物,在0 ℃下10 000 r/min离心5 min,收集菌体沉淀并保留上清液(Ⅰ);用50 mmol/L的Tris-HCl缓冲液洗涤菌体2次,洗涤液合并到上清液(Ⅰ),冻存以供测试胞外酶活性(需先冷冻干燥至近干,并定容至20 mL)。经洗涤的菌体用Tris-HCl缓冲液定容到20 mL,并加入适量蛋白酶抑制剂,冰浴中超声破碎细胞(功率200 W,破碎5 s,间隔4 s,共4 min),然后10 000 r/min离心10 min,上清(Ⅱ)即为粗酶液(测定酶活时需定容至20 mL)。 将粗酶液18 000 r/min离心30 min,沉淀用20 mL Tris-HCl缓冲液重悬,用于测试膜结合酶活性,上清(Ⅲ)用Tris-HCl缓冲液重新定容至20 mL,用于测试胞内酶活性。菌株ZL-7按同样方法测试。
磷酸酯酶酶促反应体系(3 mL)为:2.8 mL甘氨酸-氢氧化钠缓冲液(0.05 mol/L,pH值9.0)、0.19 mL酶液、10 μL对硝基苯磷酸二钠盐(4-NPP,40 mmol/L);37 ℃水浴1 h,取反应液0.5 mL于试管中,加入3.5 mL甘氨酸-氢氧化钠缓冲液(pH值10.0)混匀,紫外分光光度计测定OD405,通过比色法测定溶液中对硝基苯酚的生成量。各组试验均设置3个重复,对照组以等量蒸馏水替代酶液。酶活性单位(U)定义:在本试验条件下,1 min内转化对硝基苯磷酸二钠生成1 μmol对硝基苯酚所需的酶量。
2 结果与分析
2.1 2株甲基毒死蜱降解菌株的鉴定及特性
从土壤中分离到2株能高效降解甲基毒死蜱的菌株,其降解50 mg/L甲基毒死蜱的5 d降解率分别为90.6%和99.4%,两菌株分别被命名为ZL-7与ZHLXL-2。菌株ZL-7:直形或稍有弯曲的杆状菌,大小为(0.6~0.8)μm×(1.8~3.0)μm,G+,能运动,中生芽孢或偏端生芽孢,兼性厌氧,在营养肉汤平板上形成不透明的粗糙型菌落。淀粉水解、接触酶、明胶试验及V.P.试验均呈阳性,但吲哚试验为阴性; 经BiologTM微生物鉴定系统鉴定为地衣芽孢杆菌(Bacilluslicheniformis)。菌株ZHLXL-2:直形或微弯曲的杆菌,大小(0.6~0.7)μm×(2.0~2.5)μm,G-,能运动,无芽孢,好氧生活,在营养肉汤平板上形成湿润的圆形菌落;接触酶、氧化酶、明胶液化及V.P.试验均呈阳性,而淀粉水解试验和反硝化试验呈阴性;经BiologTM微生物鉴定系统鉴定为荧光假单胞菌(Pseudomonasfluorescens)。菌株ZHLXL-2与ZL-7通过PCR扩增获得的16S rDNA序列长度分别为1 507 bp和1 506 bp,GenBank序列登记号分别为KY030783和KY030784,经Blastn序列比对分析,结果显示,菌株ZL-7与地衣芽孢杆菌的核苷酸序列同源性达99%以上,菌株ZHLXL-2与荧光假单胞菌的序列同源性大于99%。
2.2 菌株ZL-7与ZHLXL-2对甲基毒死蜱和TCP的降解效率
图1表明,菌株ZL-7与ZHLXL-2都能有效地降解甲基毒死蜱,其3 d降解率分别达到了70.6%和91.6%。TCP是甲基毒死蜱降解过程中最重要的中间产物之一,主要由磷酸酯酶水解甲基毒死蜱产生。但是图1所示的结果表明,仅在菌株ZL-7降解甲基毒死蜱的过程中检测到了TCP,而在菌株ZHLXL-2降解甲基毒死蜱的过程中并未检出TCP(对照组也未检出)。在菌株ZL-7降解甲基毒死蜱的过程中,随着甲基毒死蜱的逐渐降解,培养基中TCP的质量浓度逐步升高,但3 d后TCP质量浓度即不再显著增长。若菌株ZL-7不能降解TCP,其TCP含量应随甲基毒死蜱的降解持续增加,没有持续增加可能是由于除了磷酸酯酶途径外,还有其他方式参与到甲基毒死蜱的降解,且不产生TCP,例如,仅对甲基毒死蜱的O-甲基进行水解,或者是由于TCP与微生物代谢物发生化学反应生成其衍生物所致。
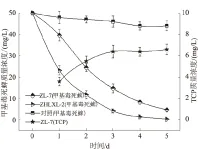
对照组及ZHLXL-2降解甲基毒死蜱过程中均未检出TCP
图2数据表明,菌株ZL-7不具备降解TCP的能力(与对照组无显著差异,P>0.05),菌株ZHLXL-2则表现出较强的TCP降解能力。菌株ZHLXL-2降解TCP的48 h降解率可达91.0%,降解速率显著高于Abraham等[7]分离的苍白杆菌JAS2和Anwar等[10]报道的短小芽孢杆菌C2A1。

图2 不同菌株对TCP的降解曲线
菌株ZHLXL-2降解甲基毒死蜱的过程中未检出TCP,可能是由于产生的TCP被迅速降解。对图1所示的菌株ZHLXL-2降解甲基毒死蜱的曲线及其相关数据进行统计分析,发现其在本试验条件下的降解规律符合一级动力学模型,按一级动力学模型C=C0·e-kt(C0为初始浓度,C为t天的残余浓度,t为降解时间,k为降解速率常数)模拟的方程为C=100e-1.294 7t,R2=0.989 1,k为1.294 7,降解半衰期为0.91 d。甲基毒死蜱的降解量在一定意义上也是其可产生TCP的最大量,若菌株ZHLXL-2降解TCP的速率高于产生TCP的速率,则TCP作为甲基毒死蜱降解的中间物就不会积累。后经证实,菌株ZHLXL-2能快速降解TCP(图2),且能以 TCP作为唯一碳源进行生长,按一级动力学模型模拟的TCP降解方程为C=100e-1.628 3t,R2=0.928 5,k为1.628 3,降解半衰期为0.82 d。通过比较上述2组降解参数可知,TCP的降解速率常数更高、半衰期也更短。因此,在菌株ZHLXL-2降解甲基毒死蜱的过程中,TCP作为中间物不会积累,因而也没有被检出。
2.3 菌株ZL-7与ZHLXL-2降解6种有机磷农药的效果
有机磷农药一般具有磷酸酯、硫代磷酸酯、磷酰胺酯类的共有结构,能降解这类共有结构的微生物通常能降解多种有机磷农药,为验证所筛选的菌株是否具有这种广谱降解有机磷农药的能力,测试了菌株ZHLXL-2与菌株ZL-7对其他6种有机磷农药的降解性能,所选取的6种农药均是曾在我国大量使用过的或目前仍在应用的有机磷农药(甲胺磷、甲拌磷、久效磷、甲基对硫磷、杀螟硫磷和水胺硫磷)。
从图3可知,菌株ZL-7对6种供试农药均有较好的降解效果,其10 d降解率都在92%以上(92.1%~99.8%),而14 d降解率则均高于99%。这些测试结果表明,菌株ZL-7对有机磷农药的降解作用具有广谱性,可能是由于菌株ZL-7产生的相关酶类作用于有机磷农药的共有结构所致,而降解速度的快慢则可能与农药自身的化学稳定性、降解酶接触农药靶标位点的难易程度、农药及降解产物对酶促反应的反馈作用等多种因素有关[14-15]。

图3 菌株ZL-7对土壤中6种不同有机磷农药的降解曲线
菌株ZHLXL-2降解6种有机磷农药的性能测试结果见图4。尽管前述试验结果已经表明菌株ZHLXL-2降解甲基毒死蜱的速率显著高于菌株ZL-7,但比较两菌株对6种其他有机磷农药的降解曲线及数据可知,菌株ZHLXL-2降解其他有机磷农药的速率低于菌株ZL-7(菌株ZHLXL-2降解6种供试农药的10 d降解率为89.2%~93.4%),因此,初步推断菌株ZL-7具有更强的有机磷农药广谱降解能力。菌株ZHLXL-2能高效降解中间物TCP,可能是其较菌株ZL-7能更好地降解甲基毒死蜱的重要原因。

图4 菌株ZHLXL-2对土壤中6种不同有机磷农药的降解曲线
2.4 菌株ZL-7与ZHLXL-2的磷酸酯酶活性
对有机磷农药结构中的磷酸酯键具有分解作用的酶类较多,磷酸酯酶即是其中最重要的一类。一般而言,能产生磷酸酯酶活性的微生物往往也会具有广谱降解有机磷农药的能力,而酶活性的大小则与降解能力呈正相关性[16]。为了弄清菌株ZL-7与ZHLXL-2降解有机磷农药的能力与其磷酸酯酶活性之间的关系,测试并比较了2种菌株的磷酸酯酶活性。由于磷酸酯酶能够水解4-NPP,反应后产生黄色的末端产物,并可在波长405 nm处读取,因此以此为基础测定磷酸酯酶的活性。
在试验中发现,同时含有菌株ZL-7和4-NPP的试验组能观察到溶液呈黄色,对菌株ZHLXL-2的试验结果也与之类似,因此推断,这是由于菌株ZL-7与ZHLXL-2在生长过程中具有磷酸酯酶活性,能够水解4-NPP产生黄色产物所致。从图5可知,2种菌株在生长过程中均具有较强的磷酸酯酶活性,其胞外酶、胞内酶及膜结合酶中都能检出磷酸酯酶活性(主要为胞内酶),这可能是2种菌株都能有效降解多种有机磷农药的原因。另外,菌株ZL-7的磷酸酯酶活性显著高于菌株ZHLXL-2(P<0.05),也印证了菌株ZL-7降解有机磷农药的能力优于菌株ZHLXL-2,证实了这2种菌株的磷酸酯酶活性与其降解有机磷农药的能力呈正相关性,而菌株ZL-7降解甲基毒死蜱的能力不及菌株ZHLXL-2则是由于其他原因所致。根据图5,2种菌株粗酶液的磷酸酯酶活性分别为59.4 U/mL和40.8 U/mL,活性大小与Bhadbhade等[13]报道的数据相当,这也暗示了这2种菌株都具有开发相应酶制剂的基础,开发的磷酸酯酶相关制剂可望用于有机磷农药污染的降解等方面。

图5 菌株ZL-7与ZHLXL-2的磷酸酯酶活性
3 结论与讨论
在本研究中,成功分离到2株甲基毒死蜱高效降解菌株,分别为地衣芽孢杆菌ZL-7与荧光假单胞菌ZHLXL-2,其降解甲基毒死蜱的5 d降解率分别为90.6%和99.4%。两菌株都有较高的磷酸酯酶活性和降解多种有机磷农药的能力,其酶活性与降解速率之间呈正相关性;菌株ZL-7较菌株ZHLXL-2有更高的磷酸酯酶活性,与之相应的是其对多种有机磷农药的降解速率更快。但是,菌株ZL-7降解甲基毒死蜱的能力不及菌株ZHLXL-2,这一现象被初步归因于菌株ZL-7不能降解甲基毒死蜱降解过程中产生的中间物TCP,TCP的积累将会导致反馈抑制效应;而菌株ZHLXL-2则能降解TCP,从而将甲基毒死蜱完全降解,最终导致菌株ZHLXL-2较菌株ZL-7降解甲基毒死蜱更为有效、快速。
有机磷农药降解菌株在生长过程中可能会产生多种降解有机磷农药的酶类,其中最重要的一类是磷酸酯酶,它能够水解有机磷农药中的磷酸酯键,因而能水解多种有机磷农药。微生物若能产生这类能够作用于有机磷农药共有结构的酶类,也就具备了降解有机磷农药的广谱性,而降解速度则与农药自身的结构、降解产物对微生物及酶促反应的反馈作用等多种因素有关。另外,微生物也能产生一些针对个别农药的特异性基团或化学键的酶类,这些酶只能对个别农药起到分解作用;不同的微生物产生的酶类差异很大,这决定了它们不同的降解特性。在本研究中,2株甲基毒死蜱降解菌都能分解供试的6种有机磷农药,故推测这2种菌株都能产生降解有机磷农药的广谱性酶类,其产生的酶类可能是磷酸酯酶,也可能包括其他有相似功能的酶类。菌株ZL-7降解有机磷农药的能力整体上优于菌株ZHLXL-2,这是由于菌株ZL-7产生的有机磷农药降解酶产量更大或者活性更高;而菌株ZL-7降解甲基毒死蜱的能力不及菌株ZHLXL-2,这一现象可能是由于菌株ZHLXL-2产生了针对甲基毒死蜱的特异性酶类,这些特异性酶类或者能直接导致甲基毒死蜱的降解,或者对甲基毒死蜱降解的中间产物有分解作用,从而有利于降解反应的快速进行。在本研究中,菌株ZHLXL-2能高效降解TCP被认为是其能更快降解甲基毒死蜱的重要原因之一。
通常在有机污染物治理过程中仅关注了目标污染物的数量指标,而由其导致的有害的次级效应常被忽视。从本研究的结果可知,某些甲基毒死蜱降解菌仅能将甲基毒死蜱分解为TCP,而不能将TCP降解,这就导致只是在名义上消除了甲基毒死蜱残留的危害。因为TCP在自然环境中的稳定性很高,导致TCP较甲基毒死蜱更难降解,并且TCP也具有较甲基毒死蜱更大的毒性,且水溶性比甲基毒死蜱也更高,导致其更容易污染水体和土壤,从而放大危害。按照已有的资料,绿草定、毒死蜱等农药的降解过程中也有类似现象[10,17]。因此,在利用微生物降解有机污染物的应用中,需要充分掌握不同微生物降解污染物的特点及降解机制,特别是降解中间物的可降解性、毒性及存在状态等方面。
[1] 朱杰丽.甲基毒死蜱在甘蓝、土壤中的残留动态和水解研究[D].长春:吉林农业大学,2004.
[2] 张超,杨红.水、土壤和蔬菜中毒死蜱、甲基毒死蜱残留检测前处理方法[J].农药,2010,49(5):367-370.
[3] Richins R D,Kaneva I,Mulchandani A,etal.Biodegradation of organophosphorus pesticides by surface-expressed organophosphorus hydrolase[J].Nature Biotechnology,1997,15(10):984-987.
[4] Kim J R,Ahn Y J.Identification and characterization of chlorpyrifos-methyl and 3,5,6-trichloro-2-pyridinol degradingBurkholderiasp.strain KR100[J].Biodegradation,2009,20(4):487-497.
[5] Abraham J,Silambarasan S.Biodegradation of chlorpyrifos and its hydrolyzing metabolite 3,5,6-trichloro-2-pyridinol bySphingobacteriumsp.JAS3[J].Process Biochemistry,2013,48(10):1559-1564.
[6] Racke K D,Coats J R,Titus K R.Degradation of chlorpyrifos and its hydrolysis product,3,5,6-trichloro-2-pyridinol,in soil[J].J Environ Sci Heal(Part B),1988,23(6):527-539.
[7] Abraham J,Silambarasan S.Biodegradation of chlorpyrifos and its hydrolysis product 3,5,6-trichloro-2-pyridinol using a novel bacteriumOchrobactrumsp.JAS2:A proposal of its metabolic pathway[J].Pesticide Biochemistry & Physiology,2016,126:13-21.
[8] Holt J G.Bergey’s manual of determinative bacteriology[M].9th ed.Philadelphia:Lippincott Williams & Wilkins,1993.
[9] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[10] Anwar S,Liaquat F,Khan Q M.Biodegradation of chlorpyrifos and its hydrolysis product 3,5,6-trichloro-2-pyridinol byBacilluspumilusstrain C2A1[J].Journal of Hazardous Materials,2009,168(1):400-405.
[11] 中华人民共和国农业部.水、土中有机磷农药测定的气相色谱法:GB/T 14552—2003[S].北京:中国标准出版社,2003.
[12] Subhas,Singh D K.Utilization of monocrotophos as phosphorus source byPseudomonasaeruginosaF10B andClavibactermichiganensesubsp.insidiosumSBL11[J].Canadian Journal of Microbiology,2003,49(2):101-109.
[13] Bhadbhade B J,Sarnaik S S,Kanekar P P.Biomineralization of an organophosphorus pesticide,monocrotophos,by soil bacteria[J].Journal of Applied Microbiology,2002,93(2):224-234.
[14] Singh B K,Walker A,Morgan J A,etal.Biodegradation of chlorpyrifos byEnterobacterstrain B-14 and its use in bioremediation of contaminated soils[J].Appl Environ Microbiol,2004,70:4855-4863.
[15] 李淑秀,张秀平,赵海泉.一株高效降解有机磷农药的菌株S3的应用研究[J].安徽农业大学学报,2011,38(2):244-247.
[16] 曹礼,徐琳.微生物降解3,5,6-三氯-2-吡啶醇的研究进展[J].微生物学通报,2015,42(6):1158-1164.
[17] 李静泉.3,5,6-三氯-2-吡啶醇降解菌Ralstoniasp.strain T6的分离与鉴定及降解特性和降解机制研究[D].南京:南京农业大学,2012.
Biodegradation of Chlorpyrifos-methyl and Its Hydrolysis Product 3,5,6-Trichloro-2-pyridinol by Different Degrading Bacteria
LI Xiaolou
(Architecture and Environmental Engineering Department,Sichuan Vocational and Technological College,Suining 629000,China)
To understand the degradation characteristics and mechanism of chlorpyrifos-methyl by microorganisms,First,different chlorpyrifos-methyl degrading bacteria were isolated from soil,and then,their degradation characteristics were tested and analyzed,including degradation efficiency on chlorpyrifos-methyl,variation of intermediate(3,5,6-trichloro-2-pyridinol,TCP) concentration in the degradation process,phosphatase activity, degradation ability on TCP and 6 organophosphorus pesticides.Two chlorpyrifos-methyl degrading bacteria were isolated,which were identified asBacilluslicheniformisZL-7 andPseudomonasfluorescensZHLXL-2,and their degradation rates on chlorpyrifos-methyl were 90.6% and 99.4% respectively in five days.TCP was found in the degradation process of chlorpyrifos-methyl by the strain ZL-7, but not by the strain ZHLXL-2.The strain ZHLXL-2 could degrade TCP, and the degradation rate reached 91.0% at 48 h,while the strain ZL-7 could not degrade TCP.Both strains could degrade 6 kinds of organophosphorus pesticides.The 10 d degradation rate of 6 organophosphorus pesticides by the strain ZL-7 was 92.1%—99.8%,higher than the degradation rate by the strain ZHLXL-2(89.2%—93.4%).In addition,the phosphatase activity of strain ZL-7 was significantly higher than that of strain ZHLXL-2.These results showed that the phosphatase activity of the two strains was positively correlated with their ability to degrade organophosphorus pesticides.The strain ZHLXL-2 could degrade chlorpyrifos-methyl more quickly because of its ability to degrade TCP effectively.
Bacilluslicheniformis;Pseudomonasfluorescens; organophosphorus pesticide; chlorpyrifos-methyl; 3,5,6-trichloro-2-pyridinol; degradation
2016-11-22
四川省教育厅重点项目(13ZA0036)
李晓楼(1974-),男,四川遂宁人,副教授,硕士,主要从事微生物应用研究。E-mail:3141024328@qq.com
X172
A
1004-3268(2017)05-0084-06
