抑制NF-κB的活化对免疫性肝损伤小鼠CYP3A代谢活力的影响
2017-05-17李学峰郭海军张小谦石素琴王宝珍薛永志
李学峰,郭海军,张小谦,石素琴,王宝珍,薛永志
(1.包头医学院第二附属医院药剂科,内蒙古 包头 014030;2.包头医学院药理学教研室,内蒙古 包头 014060)
◇研究简报◇
抑制NF-κB的活化对免疫性肝损伤小鼠CYP3A代谢活力的影响
李学峰1,郭海军1,张小谦1,石素琴1,王宝珍1,薛永志2
(1.包头医学院第二附属医院药剂科,内蒙古 包头 014030;2.包头医学院药理学教研室,内蒙古 包头 014060)
免疫性肝损伤通常由生物因素引起,重要的特征是肝组织内大量的炎症细胞浸润,从而产生免疫-炎症应答[1]。因此,现代医学认为免疫性肝损伤的发病机制与免疫应答和免疫调节紊乱有关[2-3]。肝脏免疫系统包含众多的固有天然免疫细胞,如巨噬细胞、NK细胞和NKT细胞。这些细胞群体大量聚集在肝脏中,能够为机体提供抵抗外来抗原入侵的免疫监视及保护作用。如果这些免疫细胞功能表现异常,会破坏肝脏内原有的免疫平衡,从而诱发一系列的肝脏病理损伤。目前研究认为,NF-κB、CYP3A与免疫性肝损伤的发生有着密切的关系[4-5]。因此,本文通过建立免疫性肝损伤模型,考察肝脏NF-κB表达是否会影响CYP3A的代谢活力,能否通过抑制NF-κB活性降低免疫性肝损伤的程度,以期为寻找治疗免疫性肝损伤的药物提供思路。
1 材料与方法
1.1 实验动物与试剂 清洁级Balb/c小鼠(北京大学医学部实验动物部):体质量20~22 g,♀,动物合格证号:SCXK(京)2007-0001;BCG冻干粉(每支60 mg,1 g·L-1)(Sigma);BCA 蛋白分析试剂盒、ECL反应试剂盒(Pierce);蛋白酶抑制剂(PMSF)(碧云天生物制品公司);兔抗β-actin多克隆抗体、Cytoglobin兔多克隆抗体(Santa Cruz);辣根酶标记的山羊抗兔IgG(中杉生物);咪达唑仑(MDZ) 2 mL/10 mg(江苏恩华药业股份有限公司)。
1.2 仪器 XHP-1内切式匀浆机(宁波新芝生物科技股份有限公司);TG16-WS台式高速离心机(湘仪离心机仪器厂);DYY-7B型转移电泳仪(北京市六一仪器厂);TS-1脱色摇床(华峰仪器有限公司);RB-200智能热板仪(成都泰盟科技有限公司);紫外透射反射分析仪(上海康禾光电仪器有限公司)。
1.3 动物分组及模型制备 小鼠在清洁条件下喂养2周,自由饮水进食。将50只♀小鼠称重编号后,按随机数字表分为Control、BCG、BCG+PDTC(50 mg·kg-1)、BCG+PDTC(100 mg·kg-1)、BCG+PDTC(200 mg·kg-1),每组10只。BCG、BCG+PDTC(低、中、高)组尾静脉注射125 mg·kg-114 d制备免疫性肝损伤小鼠模型,Control组尾静脉注射等体积NS。采用NF-κB特异性抑制剂对BCG+PDTC(低、中、高)组进行干预(d 11、12、13的16 ∶00腹腔注射PDTC各1次,剂量分别为50、100、200 mg·kg-1)。d 14将小鼠颈椎脱臼处死,迅速剖取肝脏、脾脏称重。将部分肝脏组织浸泡于事先准备好的甲醛酒精(甲醛 ∶酒精=1 ∶9)固定液中,石蜡包埋切片,常规HE染色。另称取部分肝脏组织冻存,用于Western blot检测。
1.4 小鼠肝组织匀浆中蛋白含量的测定 取肝脏组织切成细小的碎片,取适当量的裂解液,在使用前数分钟内加入蛋白酶抑制剂PMSF,使PMSF的最终浓度为1 mmol·L-1,按照每20 mg组织加入100~200 μL裂解液的比例加入裂解液,用内切式匀浆机在冰上破碎皮层组织,直至用肉眼无法看到块状组织为止,然后12 000 r·min-1低温离心15 min,取上清为蛋白样品,置于-20℃备用。采用BCA蛋白分析试剂盒方法绘制蛋白标准曲线,保存于电脑内备用,测定样品蛋白含量时把此标准曲线调出即可。
1.5 Western blot检测 电泳,转膜,封闭,Cytoglobin兔多克隆抗体、兔抗β-actin多克隆抗体杂交,加二抗,显色,X线片曝光,用紫外透视成像系统对X 线片进行光密度分析。


GroupLw/Bw/%ALT/U·L-1AST/U·L-1Control5.0±0.665.2±8.685.8±9.1BCG8.7±0.5∗195.8±12,3∗∗150.6±16.3∗∗BCG+PDTC50mg·kg-18.2±1.1∗172.3±15.4∗∗143.8±14.2∗∗BCG+PDTC100mg·kg-17.9±0.5∗#145.9±13.7∗#132.5±14.5∗#BCG+PDTC200mg·kg-17.5±0.6∗##110.1±12.7∗##121.5±12.4∗##
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsBCG
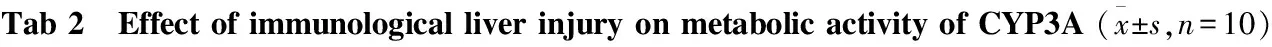

GroupLickthefrontfeet/timesLicktherearfeet/timesHop/timesLatentperiod/minControl22.33±2.06104.00±3.616.33±1.5319.37±0.45BCG8.00±1.00∗86.00±3.00∗1.67±1.1545.87±3.16∗
*P<0.05vscontrol
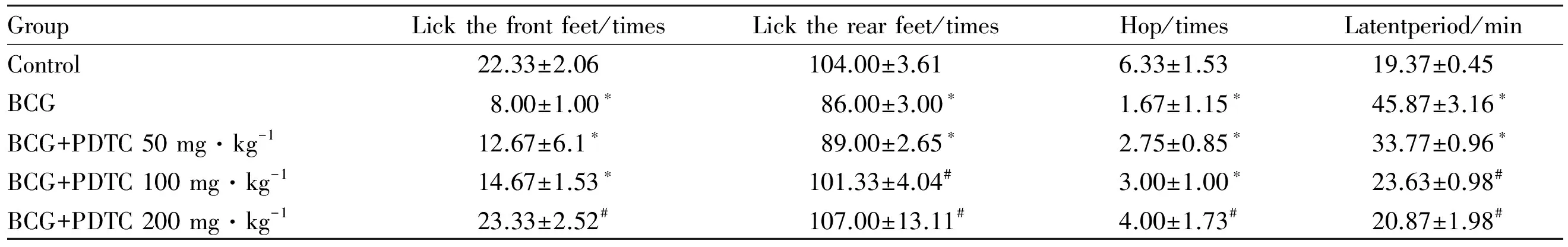
GroupLickthefrontfeet/timesLicktherearfeet/timesHop/timesLatentperiod/minControl22.33±2.06104.00±3.616.33±1.5319.37±0.45BCG8.00±1.00∗86.00±3.00∗1.67±1.15∗45.87±3.16∗BCG+PDTC50mg·kg-112.67±6.1∗89.00±2.65∗2.75±0.85∗33.77±0.96∗BCG+PDTC100mg·kg-114.67±1.53∗101.33±4.04#3.00±1.00∗23.63±0.98#BCG+PDTC200mg·kg-123.33±2.52#107.00±13.11#4.00±1.73#20.87±1.98#
*P<0.05vscontrol;#P<0.05vsBCG
1.6 NF-κB对CYP3A活力影响的测定 动物让其自由饮水饮食。通过称重、编号、采用自身对照的方法,将10只小鼠置于22℃、42℃、44℃、46℃、48℃、50℃、52℃热板上,寻找最佳刺激温度点。MDZ 0.2 mL(2 mL/10 mg)加生理盐水至10 mL,然后将剩余的PDTC组小鼠尾静脉注射MDZ 0.2 mg·kg-1,相隔40 min后进行热板法测定CYP3A代谢活力。
2 结果
2.1 PDTC对BCG诱导的免疫性肝损伤小鼠肝脏病理组织学、肝重/体重、脾重/体重、血清转氨酶含量的影响 尾静脉注射BCG 5~7 d 后,小鼠攻击性增强,激惹易怒,相互撕打,啮咬; 2周后,光镜下观察到肝实质及汇管区周围有大量单核细胞及淋巴细胞浸润,形成大小不等且弥漫性分布的大量肉芽肿团块为特征的免疫性肝损伤,肝脏、脾脏重量明显增大(P<0.05);血清AST、ALT 均升高(P< 0.01)。给予PDTC 进行干预,炎性细胞浸润团块减少,见Tab 1。
2.2 PDTC组对NF-κB的抑制作用 PDTC组NF-κB的表达明显比BCG组、Control组少(P<0.05)。
2.3 免疫性肝损伤对小鼠肝脏CYP3A代谢活力的影响 小鼠免疫性肝损伤组明显比空白对照组舔足次数减少,跳跃次数减少,潜伏期增加(P<0.05),见Tab 2。
2.4 钝化NF-κB活化对小鼠肝脏CYP3A代谢活力的影响 随温度升高(42℃~48℃),舔后足次数明显增加,存在明显量效关系(r=0.8,P<0.01)。而舔前足次数在50℃时最多,随温度升高(42℃~50℃),舔前足次数的量效关系(r=0.344,P<0.05)不如舔后足的量效关系明显(r=0.8,P<0.01)。跳跃次数从46℃开始逐渐增加,48℃~52℃变化明显,52℃鼠后足已经烫伤。因此认为最佳刺激温度为48℃。
小鼠免疫性肝损伤组的舔足次数、跳跃次数明显比Control组减少(P<0.05),潜伏期明显增加(P<0.05)。而PDTC组的舔足次数以及跳跃次数比BCG损伤组增加,潜伏期缩短,且呈现剂量依赖性。见Tab 3。
3 讨论
本研究结果显示,免疫损伤过程中,CYP3A表达和代谢活力下调,许多学者认为MDZ是体内CYP3A较理想的探针药物[6-8],它与CYP3A的底物有着良好的相关性。本文选择MDZ作为CYP3A代谢活性的探针药物,通过热板实验观察小鼠的舔足以及跳跃反应,推测CYP3A的活力改变可能与调节NF-κB有关,通过抑制NF-κB 的活化可以上调CYP3A的活力,从而代谢MDZ能力增加,导致小鼠舔足以及跳跃次数增加。当免疫性肝损伤时,能够产生TNF和NO,而NO作为第二信使能够活化NF-κB,由于受到刺激NF-κB通过磷酸化、泛素化而降解,从而使NF-κB的核定位信号暴露,进入细胞核与靶基因的κB位点结合,发挥转录调节作用[9]。NF-κB的激活促进各种细胞因子和化学因子的基因转录,这些细胞因子和炎症介质可引起肝细胞进一步坏死、凋亡、炎症和纤维化。因此,NF-κB在免疫性肝损伤中十分重要。
[1] 杨雄志,张庆珍. “水三仙”口服液对小鼠免疫性肝损伤保护作用的研究[J].实用中西医结合临床, 2005,5(3):7-8.
[1] Yang X Z,Zhang Q Z.Research of the protective effect of oral Shuishanxian Liquor(SSL)on immunological liver injury[J].PractClinJIntegrTraditChinWestMed,2005,5(3):7-8.
[2] 刘道芳. Toll样受体4介导BCG/LPS诱导免疫性肝损伤的机制及芍药苷的作用[D].合肥:安徽医科大学, 2006.
[2] Liu D F.The mechanism of Toll-like receptor4 mediated BCG/LPS induced immunological liver injury and the effect of paeoniflorin[D]. Hefei:Anhui Medical University,2006.
[3] 赵 囊,郑 敏,鲍翠玉,等. 大蒜多糖C对免疫性肝损伤小鼠血清及肝组织ALT、AST的影响[J]. 咸宁学院学报(医学版),2005, 19(1): 24-5.
[3] Zhao N,Zheng M,Bao C Y,et al.The effect of theAlliumSativumlpolysaccharide C on ALT and AST in the serum and liver of mice with immunological liver injury[J].JXianningColl(MedSci),2005,19(1): 24-5.
[4] 王 华, 徐德祥, 王安连, 等.N-乙酰半胱氨酸对小鼠免疫性肝损伤的影响[J]. 中国药理学通报,2007,23(4): 468-72.
[4] Wang H,Xu D X,Wang A L,et al.Effects of N-acetylcysteine on immunological liver injury in mice[J].ChinPhamacolBull,2007, 23(4):468-72.
[5] 吴春明,曹家羹,朱小区,等. 二草清肝汤治疗免疫性肝损伤大鼠的作用机制[J].山东医药,2008,48(24):38-40.
[5] Wu C M,Cao J G,Zhu X O,et al.The mechanism of Ercao Qinggan Decoction cured immunological liver injury in rats[J].ShandongMedJ,2008,48(24):38-40.
[6] Anakk S, Kalsotra A, Kikuta Y, et al. CAR/PXR provide directives for Cyp3a41 gene regulation differently from Cyp3a11[J].PharmacogenomicsJ, 2004, 4(2):91-101.
[7] Beigneux A P, Moser A H, Shigenaga J K, et al. Reduction in cytochrome P-450 enzyme expression is associated with repression of CAR (constitutive androstane receptor) and PXR (pregnane X receptor) in mouse liver during the acute phase response[J].BiochemBiophysResCommun, 2002, 293(1):145-9.
[8] Coumoul X, Diry M, Barouki R. PXR-dependent induction of human CYP3A4 gene expression by organochlorine pesticides[J].BiochemPharmacol, 2002, 64(10):1513-9.
[9] Laethem R M, Balazy M, Falck J R, et al. Formation of 19(S)-, 19(R)-, and 18(R)-hydroxyeicosatetraenoic acids by alcohol-inducible cytochrome p450 2E1[J].JBiolChem, 1993, 268(17): 12912-8.
Effect of blunting NF-κB activation on CYP3A in immunological liver injury mice
LI Xue-feng1,GUO Hai-jun1,ZHANG Xiao-qian1,SHI SU-qin1,WANG Bao-zhen1,XUE Yong-zhi2
( 1.DeptofPharmacy,theSecondAffiliatedHospitalofBaotouMedicalCollege,BaoTouInnerMongolia014030,China;2.DeptofPharmacology,BaotouMedicalCollege,BaotouInnerMongolia014060,China)
肝损伤;核转录因子-κB;吡咯烷烷二硫氨基甲酸;细胞色素P450 3A;小鼠;热板法;
liver injury; NF-κB; PDTC; CYP3A;mice; hot plate
2016-12-22,
2017-01-19
国家自然科学基金资助项目(No 30760289,81460567);内蒙古自然科学基金资助项目(No 2009MS1104,2014MS0813);内蒙古教育厅资助项目(No NJ03148,NJZY13244);内蒙古卫生厅项目(No 201302099)
李学峰(1983-),男,硕士,主管药师,研究方向:药物代谢与肝脏分子药理学,Tel:0472-3169854,E-mail: lixuefeng79@163.com; 薛永志(1968-),男,硕士,教授,硕士生导师,研究方向:药物代谢与肝脏分子药理学,通讯作者,Tel:0472-7167843, E-mail:xyzhxyzh68@sohu.com
时间:2017-4-24 11:21
http://kns.cnki.net/kcms/detail/34.1086.R.20170424.1121.054.html
10.3969/j.issn.1001-1978.2017.05.027
A
1001-1978(2017)05-0733-03
R-332;R322.47;R345.99;R575.02;R593.02;R977.3;R977.6
