胡黄连苷Ⅱ通过抑制cyto C/caspase-9 /caspase-3通路发挥神经保护作用
2017-05-17张红艳王婷婷张艳辉郭云良
张红艳,翟 丽,王婷婷,李 珊,张艳辉,郭云良
(青岛大学附属医院脑血管病研究所,山东 青岛 266003)
胡黄连苷Ⅱ通过抑制cyto C/caspase-9 /caspase-3通路发挥神经保护作用
张红艳,翟 丽,王婷婷,李 珊,张艳辉,郭云良
(青岛大学附属医院脑血管病研究所,山东 青岛 266003)
目的 研究胡黄连苷Ⅱ对大鼠脑缺血/再灌注过程中cyto C/caspase-9/caspase-3信号通路的影响及其神经保护作用机制。方法 环孢素(CsA)和苍术苷(Atr)分别作为cyto C阳性对照和阴性对照,改良Longa法制备缺血2 h再灌注24 h大鼠脑缺血/再灌注(I/R)模型。再灌注24 h后,TTC染色观察脑梗死体积;免疫组织化学和Western blot检测cyto C、caspase-9、caspase-3表达水平。结果 模型组大鼠脑缺血/再灌注后TTC显示染色脑梗死体积明显增加;免疫组织化学和Western blot显示cyto C、caspase-9、caspase-3表达水平较假手术组明显增多(P<0.05)。治疗组大鼠TTC显示脑梗死体积缩小;免疫组化和Western blot显示cyto C、caspase-9、caspase-3表达水平与模型组相比明显降低(P<0.05)。与Atr组相比,Atr+胡黄连苷Ⅱ组大鼠脑梗死体积缩小,免疫组化和Western blot显示cyto C、caspase-9、caspase-3表达水平减弱(P<0.05)。结论 胡黄连苷II抑制缺血/再灌注损伤大脑神经凋亡的机制可能与下调cyto C/caspase-9/caspase-3信号通路蛋白有关。
胡黄连苷Ⅱ;脑;缺血/再灌注损伤;cyto C/caspase-9/caspase-3信号通路;神经保护;大鼠
缺血性脑卒中可导致脑损伤,是引起死亡和残疾的主要原因[1]。急性脑缺血半暗带损伤的机制很多,但这些分子机制之间的相互作用目前尚不十分清楚[2]。溶栓及时恢复血供是治疗缺血性脑卒中的一种有效的治疗方式。然而,溶栓再灌注疗法通常会带来细胞生化及代谢等问题,包括活性氧过量产生、钙超载、线粒体损伤和细胞死亡,最终导致不可逆性的再灌注损伤[3]。而过量的活性氧作为细胞凋亡的一种刺激,可触发线粒体凋亡途径,致cyto C等凋亡因子的释放[4]。一旦释放入胞质中,cyto C会激活下游caspase家族。其中,caspase-9是重要的启动器,参与cyto C依赖性的caspase级联反应,而caspase-3则参与凋亡信号的转导。
《本草纲目》记载:胡黄连味苦性寒,具有“清热燥湿”作用。《本草经疏》曰:胡黄连“大寒至苦,极清之性,能清热,一切湿热、邪热、阴分伏热所生诸病,莫不消除”。现代医学研究表明,西藏胡黄连提取物含有胡黄连苷Ⅰ、Ⅱ、Ⅲ 3种环烯醚萜苷,其中胡黄连苷Ⅱ为主要有效成分,含有邻苯二酚基结构,具有较好的抗氧化作用。本课题组前期研究探讨胡黄连苷Ⅱ时间效应窗[5],在脑缺血半暗带损伤中具有抗炎[6-7]、抗氧化[8]、抑制神经凋亡的作用[9-10],然而,其保护神经细胞的机制还有待研究。由于cyto C/caspase-9/caspase-3信号通路在神经细胞的凋亡中起重要作用,本实验以此为切入点,进一步探讨胡黄连苷Ⅱ对脑缺血/再灌注半暗带损伤的保护作用机制。
1 材料与方法
1.1 缺血/再灌注模型制备 健康成年Wistar ♂大鼠120只,体质量240~270 g,SPF级,青岛市药品检验所实验动物中心[SCXK(鲁)20100010]提供。大鼠术前禁食12 h,水合氯醛溶液(100 g·L-1)麻醉后固定于手术台。用牙科钻定位(前囟左旁开5 mm、向后3 mm)钻孔至硬脑膜,将激光多普勒血流检测仪(PE-5001,Swedan)探头经孔固定在硬脑膜上,记录左侧大脑中动脉供血区的血流变化,应用线栓法[11]制备缺血/再灌注(I/R)模型,缺血2 h时后,拔出线栓实现24 h再灌注。模型成功标准:插入线栓后,局部脑血流量峰值降到插线前的30%及以下,拔出线栓后,rCBF恢复至插线前的80%及以上为模型成功的标准。造模成功的96只大鼠随机分为假手术组(Sham)、模型组(Model)、治疗组Ⅱ组(Treatment)、阳性对照药组(Positive)、阳性对照药+治疗组(Positive+Treatment)、阴性对照药组(Negative)、阴性对照药+治疗组(Negative+Treatment)、溶媒组(DMSO),每组12只。
1.2 干预措施 假手术组线栓进入颈内动脉10 mm后即刻退出。模型组建立模型,缺血2 h拔线栓后,腹腔注射生理盐水0.5 mL。治疗组将胡黄连苷Ⅱ(天津奎青有限公司)配制为10 g·L-1的溶液,在缺血2 h拔线栓时,腹腔注射胡黄连苷II溶液(20 mg·kg-1)。阳性对照药组将环孢素A(CsA,Selleck公司)用DMSO配制成2 μmol·L-1的溶液,再灌注前15 min侧脑室注射5 μL(脑立体定向仪,江湾Ⅰ型C,上海第二军医大学修配厂)。阳性对照药+治疗组与阳性对照药组相同,CsA溶液注射结束后,给予胡黄连苷Ⅱ溶液。阴性对照药组苍术苷(Atr,上海同田生物技术有限公司)用生理盐水配制成2 mmol·L-1的溶液,再灌注前15 min侧脑室注射5 μL。阴性对照药+治疗组与阴性对照药组相同,Atr溶液注射结束后,给予胡黄连苷Ⅱ溶液。溶媒组,再灌注前15 min侧脑室注射DMSO溶液5 μL。1.3 脑梗死体积测量(TTC) 每组取4只动物,脑缺血/再灌注24 h后,水合氯醛溶液(100 g·L-1)腹腔注射麻醉,断头取脑。生理盐水将脑冲洗干净,置于脑模具中。-20℃冷冻10 min后,自前向后连续冠状切面切片(每片2 mm),每个脑切5片,置于20 g·L-1的TTC磷酸盐溶液中,37℃孵育10 min。数码相机拍照,采用Adobe PhotoShop CS测量脑梗死体积。脑梗死体积(cerebral infract volume,CIV)=经过视交叉平面的脑梗死面积/该层对侧半球面积。
1.4 免疫组化 每组取4只动物,于缺血2 h再灌注24 h后,水合氯醛溶液(100 g·L-1)麻醉后,心脏灌注生理盐水和多聚甲醛溶液(40 g·L-1)各200 mL,取缺血部位脑组织。将组织置于多聚甲醛溶液(40 g·L-1)中固定2 h,蒸馏水浸泡4 h。常规脱水、透明、浸蜡、包埋。石蜡切片机连续冠状切片,每片厚5 μm,贴于载玻片上,常温保存。石蜡切片常规脱蜡、水化后,按二步法免疫组化试剂盒(北京中杉金桥生物公司)进行染色。胞质出现棕黄色颗粒者为阳性细胞,阴性对照以PBS替代抗体,不出现阳性细胞。在400倍显微镜下进行观察,每张切片随机观察5个不重叠视野,计数阳性细胞数(PCI=阳性细胞数/细胞总数),取其均值。
1.5 浆蛋白提取 每组取4只动物,缺血2 h再灌注24 h后,水合氯醛溶液腹腔注射麻醉,经心脏灌注生理盐水200 mL。每组取新鲜缺血脑组织100 mg,剩余冻存,用于总蛋白提取。根据线粒体/胞质制备试剂盒(C3606,碧云天生物公司)提取浆蛋白。将100 mg新鲜缺血脑组织剪碎,放入小容量玻璃匀浆器内,按1 ∶10(重量 ∶体积)加入添加蛋白酶抑制剂的分离液A,600×g,4℃离心10 min。取上清,11 000×g,4℃离心15 min。将上清再次12 000×g,4℃离心15 min,取上清为浆蛋白。取少量BCA检测蛋白浓度,剩余加入SDS-PAGE Sample Loading Buffer(5×)混匀,置于97℃水浴8 min,冷却后-20℃保存。
1.6 总蛋白提取和Western blot分析 取上述脑组织各100 mg,按组织与细胞裂解液10 mg ∶100 μL的比例加入细胞裂解液(碧云天生物公司),置于冰上研磨。10 949×g,4℃离心15 min后取上清,BCA检测蛋白浓度,剩余加入SDS-PAGE Sample Loading Buffer(5×)混匀,置于97℃水浴8 min,冷却后-20℃保存。各组均取样品20 μg,10% SDS-PAGE凝胶电泳分离,湿转法转至NC膜(66485,Pall Corporation,USA),5% BSA室温封闭2 h,加入cyto C(1 ∶5 000)、caspase-9(1 ∶2 000)、caspase-3(1 ∶2 000)、β-actin(1 ∶3 000)一抗,4℃过夜。HRP标记的山羊抗兔二抗(1 ∶2 000)室温孵育1.5 h,凝胶成像分析系统(Biospectrum 810 Imaging system,UVP,USA)测定各条带的灰度值。计算各目的蛋白的相对灰度值(relative value of protein,RVP)。
2 结果
2.1 脑梗死体积 方差分析显示,不同处理组之间对I/R大鼠的脑梗死体积差异有统计学意义(F=33.87,P<0.05),I/R组、阴性对照药组、溶媒组梗死体积明显高于其他处理组。LSD两两比较显示(Fig 1):假手术组大鼠未见脑梗死;模型组大鼠可见明显梗死灶,与假手术组相比差异有统计学意义(t=12.21,P<0.05);治疗组大鼠脑梗死体积明显缩小,与模型组相比差异有统计学意义(t=4.61,P<0.05); 阴性对照药组大鼠梗死灶明显,阴性对照药+治疗组与阴性对照药组相比,梗死体积明显缩小(t=4.01,P<0.05)。
2.2 免疫组织化学染色
2.2.1 cyto C表达 方差分析示不同组别之间差异有统计学意义(F=22.86,P<0.05)。LSD显示(Fig 2):假手术组大鼠神经细胞胞质cyto C蛋白表达微弱,着色较浅。模型组大鼠胞质cyto C蛋白表达明显增多,阳性细胞数多于假手术组(t=9.80,P<0.05)。治疗组大鼠胞质cyto C蛋白表达明显低于模型组(t=4.06,P<0.05)。阴性对照组大鼠阳性细胞较多,阴性对照+治疗组与阴性对照组相比阳性细胞数减少,差异有有统计学意义(t=3.90,P<0.05)。
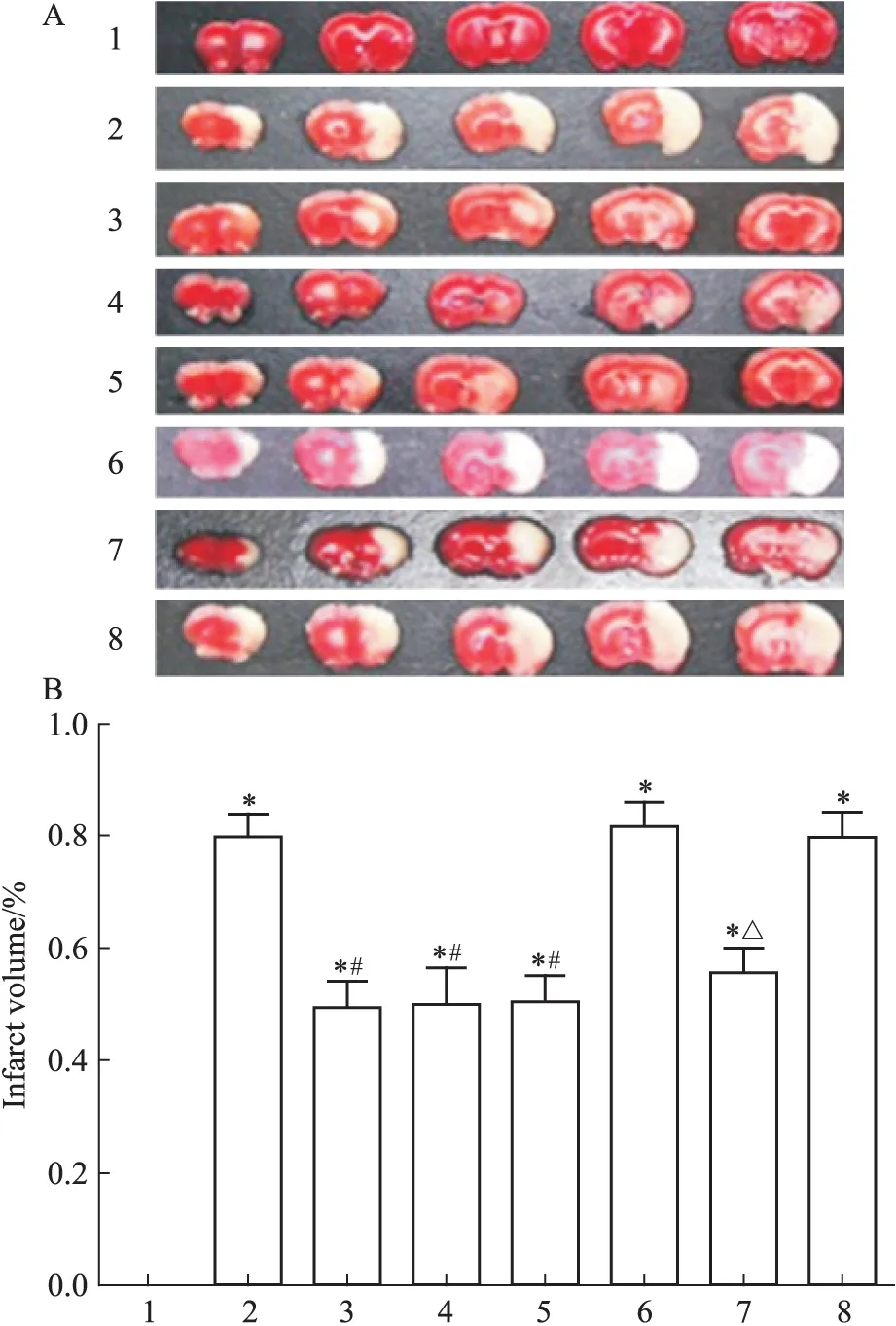
Fig 1 Effect of picroside Ⅱ on the infarct area
A: TTC staining showed the effect of picroside Ⅱ on cerebral infarct area; B: The quantification results of TTC staining. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+picroside Ⅱ group; 8: DMSO group.*P<0.05vssham group;#P<0.05vsmodel group;△P<0.05vsAtr group
2.2.2 caspase-9表达 方差分析可见不同处理组之间存在差异(F=15.55,P<0.05)。LSD两两比较显示(Fig 3):假手术组大鼠神经细胞caspase-9蛋白表达较弱,着色不明显;模型组大脑皮层可见明显棕黄色颗粒的caspase-9阳性细胞,数目较多,蛋白表达较假手术组明显增强(t=7.95,P<0.05);治疗组脑组织中caspase-9阳性细胞数量减少,表达减弱,与模型组相比差异有统计学意义(t=4.08,P<0.05);阴性对照组大鼠皮质区细胞大量神经细胞固缩深染,空洞较多,可见明显棕黄色颗粒的caspase-9阳性细胞;阴性对照+治疗组阳性细胞数量下降,与阴性对照组相比差异有统计学意义(t=4.08,P<0.05)。
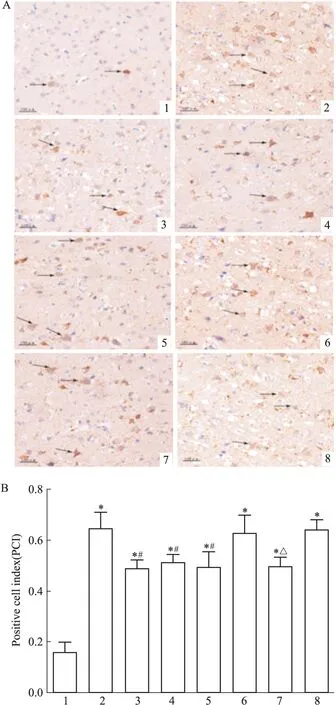
Fig 2 Effect of picroside Ⅱ on cyto C expression in I/R rats(×400)
A: Positive cells were measured by DAB assay and observed by microscopy; B: The PCI of picroside Ⅱ on cyto C expression in I/R rats. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+ picroside Ⅱ group; 8: DMSO group.*P<0.05vssham group;#P<0.05vsmodel group;△P<0.05vsAtr group
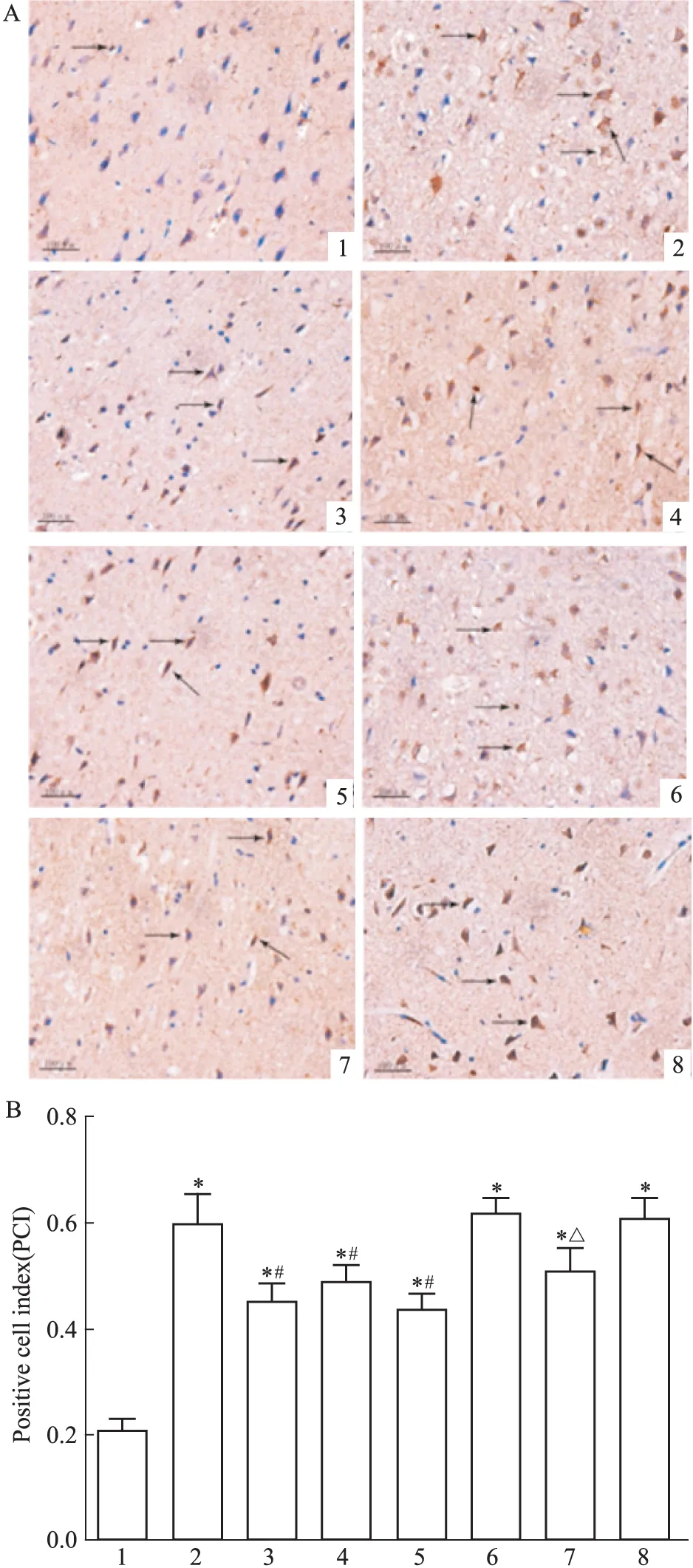
Fig 3 Effect of picroside Ⅱ on caspase-9 expression in I/R rats (×400)
A: Positive cells were measured by DAB assay and observed by microscopy; B: The PCI of picroside Ⅱ on caspase-9 expression in I/R rats. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+ picroside Ⅱ group; 8: DMSO group.*P<0.05vssham group;#P<0.05vsmodel group;△P<0.05vsAtr group
2.2.3 caspase-3表达 方差分析可见不同处理组之间存在差异(F=21.92,P<0.05)。LSD两两比较显示(Fig 4): 假手术组大鼠皮质区神经细胞见少量阳性caspase-3蛋白表达;模型组大鼠皮层可见明显增多的caspase-3蛋白,表达量较多,明显高于假手术组(t=9.83,P<0.05);治疗组阳性细胞表达量变弱,与模型组相比差异有统计学意义(t=4.59,P<0.05);阴性对照组蛋白表达量明显升高,阴性对照+治疗组与阴性对照组相比差异有统计学意义(t=3.89,P<0.05)。
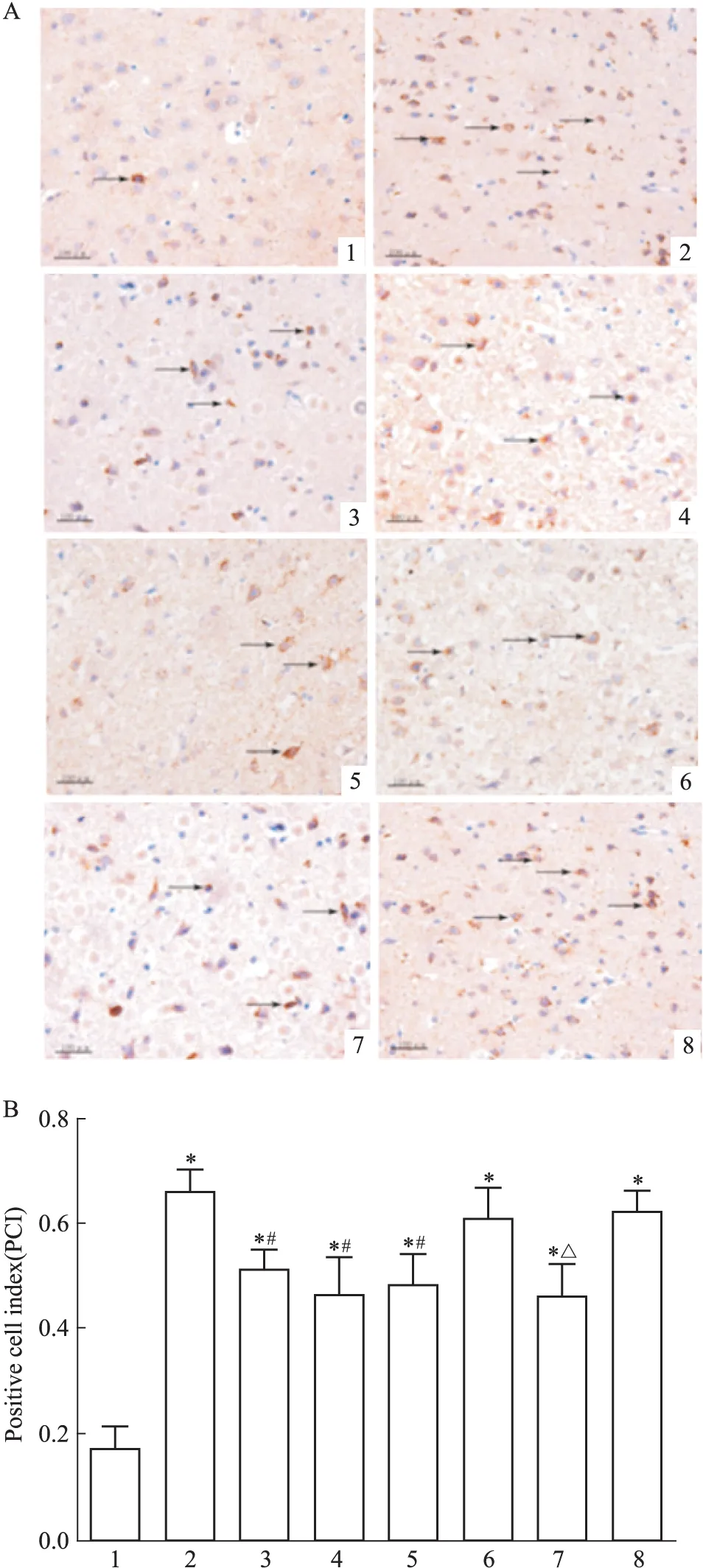
Fig 4 Effect of picroside Ⅱ on caspase-3 expression in I/R rats (×400)
A: Positive cells were measured by DAB assay and observed by microscopy; B: The PCI of picroside Ⅱ on caspase-3 expression in I/R rats. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+ picroside Ⅱ group; 8: DMSO group.*P<0.05vssham group;#P<0.05vsmodel group;△P<0.05vsAtr group
2.3 Western blot分析
2.3.1 胞质cyto C表达 Cyto C蛋白表达采用胞质细胞提取法。方差分析可见不同处理组之间存在差异(F=17.20,P<0.05)。LSD两两比较显示(Fig 5): 假手术组大鼠可见少量cyto C表达。模型组大鼠cyto C蛋白表达量明显上升,与假手术组相比差异有统计学意义(t=8.53,P<0.05)。治疗组cyto C表达量下降,与模型组相比差异有统计学意义(t=4.39,P<0.05)。阴性对照组cyto C含量明显增多;阴性对照+治疗组cyto C表达量明显下降,与阴性对照组相比差异有统计学意义(t=3.93,P<0.05)。
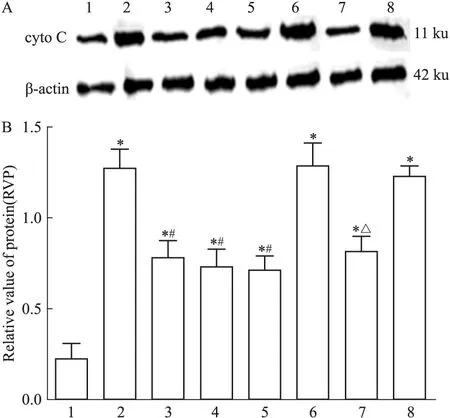
Fig 5 Cytosol cyto C expression in I/R rats by Western blot
A: Western blot assay of cytosol cyto C expression; B: Bar graph showed the relative amounts of cytosol cyto C normalized to β-actin. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+picroside Ⅱ group; 8: DMSO group.*P<0.05vssham group;#P<0.05vsmodel group;△P<0.05vsAtr group
2.3.2 caspase-9表达 方差分析可见不同处理组之间差异有统计学意义(F=20.34,P<0.05)。LSD两两比较显示(Fig 6):假手术组caspase-9蛋白表达量低;模型组大鼠caspase-9蛋白表达量较高,与假手术组相比差异有统计学意义(t=8.91,P<0.05);治疗组caspase-9表达量下降明显,与模型组相比差异有统计学意义(t=5.11,P<0.05);阴性对照+治疗组caspase-9表达量明显下降,与阴性组相比差异有统计学意义(t=4.40,P<0.05)。
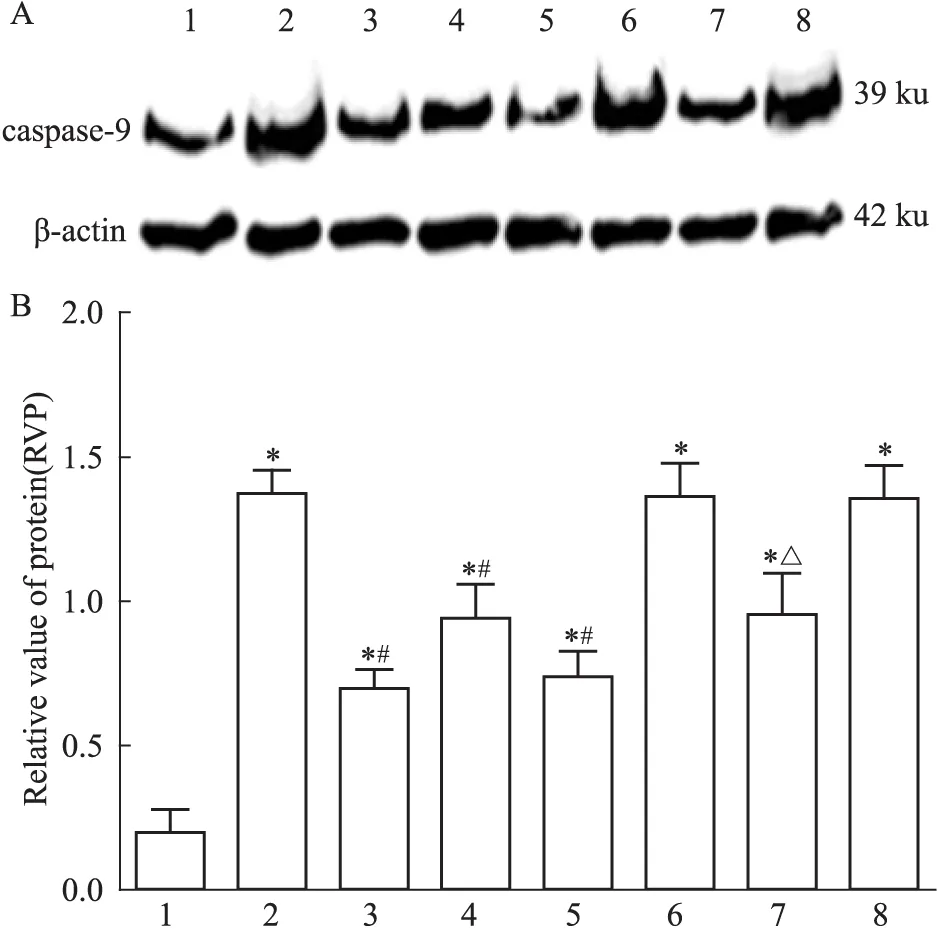
Fig 6 Caspase-9 expression in I/R rats by Western blot
A: Western blot assay of caspase-9 expression; B: Bar graph showed the relative amounts of caspase-9 normalized to β-actin. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+picroside Ⅱ group; 8: DMSO group.*P<0.05vssham group;#P<0.05vsmodel group;△P<0.05vsAtr group
2.3.3 caspase-3表达 方差分析可见不同处理组之间存在差异(F=16.34,P<0.05)。LSD 两两比较显示(Fig 7):假手术组大鼠caspase-3表达量较少。 模型组蛋白表达上升,与假手术组相比差异有统计学意义(t=8.18,P<0.05)。治疗组表达明显降低,与模型组相比差异有统计学意义(t=4.14,P<0.05)。阴性对照+治疗组蛋白表达量明显降低,与阴性对照组相比差异有统计学意义(t=4.81,P<0.05)。
3 讨论
脑缺血/再灌注时,cyto C从线粒体释放入胞质引起caspase级联反应是启动凋亡程序的关键。cyto C一旦释放入胞质,即可与Apaf-1和pro-caspase-9结合形成凋亡体,激活caspase-3,这对于缺血后神经细胞凋亡极其重要。Xing等[12]的研究表明,对于MCAO模型,缺血后处理会降低线粒体cyto C释放入胞质和caspase-3的活性,这与本实验结果一致。崔耀梅等[13]研究表明,在脑缺血/再灌注中,cyto C的释放及其下游因子的激活与MPTP的开放有关。于丽等[14]研究表明,抑制NADPH氧化酶,减少ROS的产生,对脑缺血/再灌注损伤起保护作用。以上研究说明,减少ROS及抑制MPTP的开放及cyto C的释放,对脑缺血/再灌注损伤具有保护作用。
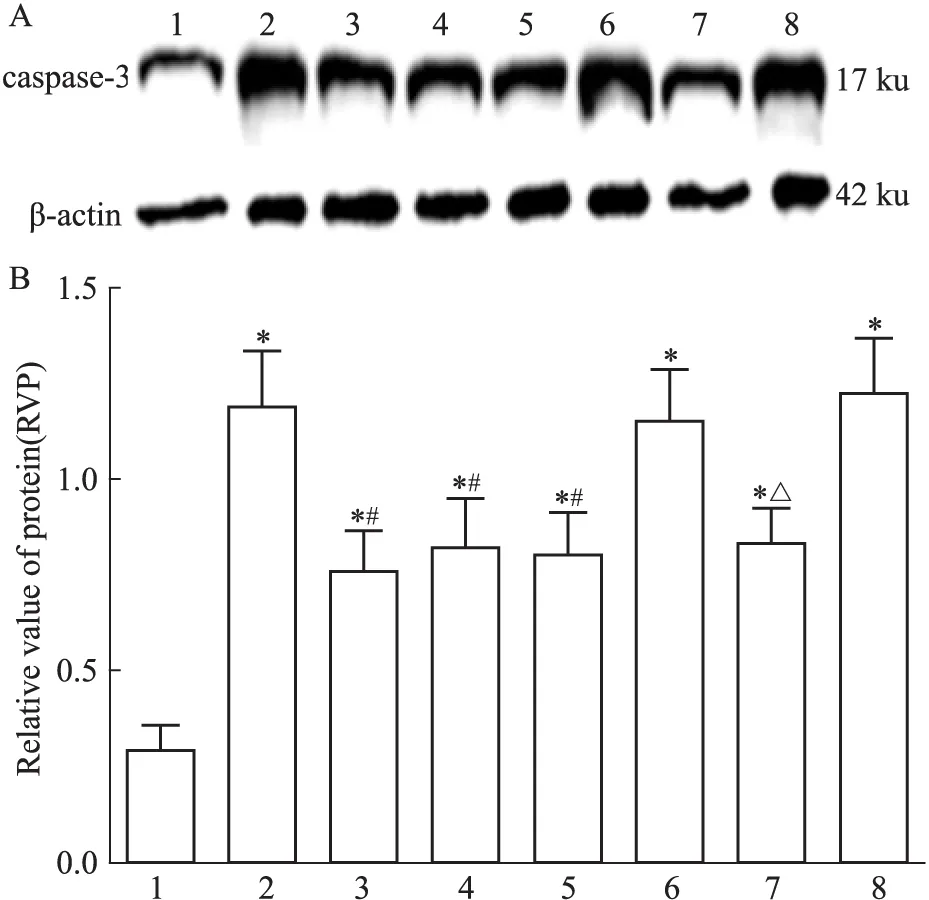
Fig 7 Caspase-3 expression in I/R rats by Western blot
A: Western blot assay of caspase-3 expression; B: Bar graph showed the relative amounts of caspase-3 normalized to β-actin. 1: Sham group; 2: Model group; 3: Picroside Ⅱ group; 4: CsA group; 5: Picroside Ⅱ+CsA group; 6: Atr group; 7: Atr+picroside Ⅱ group; 8: DMSO group.*P<0.05vssham group;#P<0.05vsmodel group;△P<0.05vsAtr group
由于caspases可自我活化并能相互激活,因此凋亡过程一旦激活,即呈级联放大作用。许多研究着力于caspases家族,以抑制caspases级联式反应作为开发治疗脑缺血药物的重点[15-16]。Caspase-9是线粒体凋亡途径中的一个必须始动子,而caspase-3是调节凋亡的关键蛋白。然而,仅通过抑制caspases来保护神经细胞是暂时的,因为线粒体通透性一旦不可逆增加,细胞凋亡将不依赖于caspases继续发生。cyto C的释放从侧面反映出线粒体通透性程度,胞质中cyto C的减少,会对凋亡体产生影响,从而使caspase-3激活受到影响,发挥保护神经细胞的作用。
环孢素A可特异性抑制cyto C的释放,故选为阳性对照药。苍术苷为cyto C的选择性激动剂,故选为阴性对照药。本实验证实,在大鼠脑缺血/再灌注模型中,环孢素A可明显抑制cyto C的表达,而苍术苷对cyto C的表达则未见明显作用。
本实验结果示,脑缺血/再灌注中,胡黄连苷Ⅱ能明显减小脑梗死体积,由此推测其对脑缺血半暗带有一定的保护作用。胡黄连苷Ⅱ对cyto C的抑制作用明显,与环孢素A相比未见明显统计学差异,这从侧面反映胡黄连苷Ⅱ对于凋亡体形成的抑制作用,其机制尚待进一步研究。胡黄连苷Ⅱ可下调caspase-9和caspase-3的表达水平,这可能与其抑制上游cyto C有关。环孢素A作为cyto C的特异性抑制剂,与胡黄连苷Ⅱ联合应用未见协同作用,其原因可能与胡黄连苷Ⅱ受体竞争性更强和胡黄连苷Ⅱ的药物浓度适中有关。苍术苷是cyto C的激动剂,与环孢素A和胡黄连苷Ⅱ的保护作用相反。本文CsA与Atr的结果与Sun等[17]结果相一致。
本研究尚存在不足之处,例如Atr组与模型组相比,脑梗死体积等不具有统计学意义;CsA组与胡黄连苷Ⅱ+CsA组比较,其梗死体积等无统计学意义。上述情况可能与以下因素有关:① 造模过程中,再灌注时间较长,不需要加激动剂通路已完全激活;② 受体饱和性,胡黄连苷II与受体结合强,当联合用药时未发挥协同作用,尚需进一步研究。
[1] Go A S, Mozaffarian D, Roger V L, et al. Executive summary: heart disease and stroke statistics—2014 update: a report from the American Heart Association.Circulation, 2014, 129(3): 399-410.
[2] Hinzman J M, Thomas T C, Quintero J E, et al. Disruptions in the regulation of extracellular glutamate by neurons and glia in the rat striatum two days after diffuse brain injury[J].JNeurotrauma, 2012, 29(6): 1197-2208.
[3] Palencia G, Ortizplata A, Sotelo J. Anti-apoptotic, anti-oxidant, and anti-inflammatory effects of thalidomide on cerebral ischemia/reperfusion injury in rats[J].JNeurolSci, 2015, 351(1-2):78-87.
[4] Dröse S, Brandt U, Wittig I. Mitochondrial respiratory chain complexes as sources and targets of thiol-based redox-regulation[J].BiochimBiophysActa, 2014, 1844(8):1344-54.
[5] 李红云,赵 丽,宿 希,等. 胡黄连苷Ⅱ治疗脑缺血/再灌注损伤剂量和时间窗的初步探讨[J]. 中国药理学通报,2012,28(4):549-53.
[5] Li H Y, Zhao L, Su X, et al. Primary study on the therapeutic dose and time window of picroside II in cerebral ischemic injury in rats[J].ChinPharmacolBull, 2012,28(4):549-53.
[6] Wang T T, Zhai L, Guo Y L, et al. Picroside II has a neuroprotective effect by inhibiting ERK1/2 activation after cerebral ischemic injury in rats[J].ClinExpPharmacolPhysiol, 2015, 42(7):930-9.
[7] Wang T T, Zhai L, Zhang H Y, et al. Picroside Ⅱ inhibits the MEK-ERK1/2-COX2 signal pathway to prevent cerebral ischemic injury in rats[J].JMolNeurosci, 2015, 57(3): 335-51.
[8] Wang L, Liu X H, Chen H, et al. Picroside Ⅱ protects rat kidney against ischemia/ reperfusion-induced oxidative stress and inflammation by the TLR4/NF-κB pathway[J].ExpTherMed, 2015, 9(4):1253-8.
[9] Wang T T, Zhao L, Guo Y L, et al. Picroside Ⅱ inhibits neuronal apoptosis and improves the morphology and structure of brain tissue following cerebral ischemic injury in rats[J].PLoSOne, 2015, 10(4): e0124099.
[10]王婷婷,赵 丽,李晓丹,等. 胡黄连苷Ⅱ对脑缺血损伤后神经细胞凋亡和超微结构的影响[J]. 中国药理学通报,2015,31(3):400-6.
[10]Wang T T, Zhao L, Li X D, et al. Effect of picroside Ⅱ on neuronal apoptosis and ultrastructure in cerebral ischemic injury in rats[J].ChinPharmacolBull,2015, 31(3):400-6.
[11]Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke, 1989, 20(1):84-91.
[12]Xing B, Chen H, Zhang M, et al. Ischemic postconditioning inhibits apoptosis after focal cerebral ischemia/reperfusion injury in the rat[J].Stroke, 2008, 39(8):2362-9.
[13]崔耀梅,程慧娴,曾宪明,等. 富氢液对大鼠脑缺血/再灌注损伤后海马线粒体通透性转换孔及细胞凋亡的影响[J]. 中国药理学通报,2012,28(6):853-8.
[13]Cui Y M, Chen H X, Zeng X M, et al. Effects of hydrogen-rich saline on hippocampus mitochondrial permeability transition pore and apoptosis of rats with global cerebral ischemia-reperfusion injury[J].ChinPharmacolBull,2012,28(6):853-8.
[14]于 丽, 童旭辉, 樊宗兵,等. 抑制NADPH氧化酶对脑缺血/再灌注损伤的保护作用[J]. 中国药理学通报,2015,31(8):1126-31.
[14]Yu L, Tong X H, Fan Z B, et al. Protective effect of NADPH oxdase against cerebral ischemia/reperfusion injury[J].ChinPharmacolBull, 2015,31(8):1126-31.
[15]Garcia de la Cadena S, Massieu L. Caspases and their role in inflammation and ischemic neuronal death. Focus on caspase-12[J].Apoptosis, 2016, 21(7):763-77.
[16]Min H M, Wang Y, Ren D Y,et al. Protective effect of 2-deoxy-D-glucose on the brain tissue in rat cerebral ischemia/reperfusion models by inhibiting caspase-apoptotic pathway[J].HistolHistopathol, 2017, 32(1):57-67.
[17]Sun J, Luan Q, Dong H, et al. Inhibition of mitochondrial permeability transition pore opening contributes to the neuroprotective effects of ischemic postconditioning in rats[J].BrainRes, 2012, 1436(2):101-10.
Picroside Ⅱ plays a neuroprotective effect by inhibiting cyto C/caspase-9/caspase-3 signal pathway following ischemia/reperfusion injury in rats
ZHANG Hong-yan, ZHAI Li, WANG Ting-ting, LI Shan, ZHANG Yan-hui, GUO Yun-liang
(InstituteofCerebrovascularDiseases,AffiliatedHospitalofQingdaoUniversity,QingdaoShandong266003,China)
Aim To investigate the neuroprotective effect of picroside Ⅱ(PIC) on cyto C/caspase-9/caspase-3 signal pathway following ischemia/reperfusion (I/R) injury in rats.Methods Atractyloside(Atr) was selected as negative control, cyclosporin A(CsA) was selected as positive control, and PIC was selected as the treatment medicine. The I/R model was made by inserting a monofilament suture into internal carotid artery for 2 h, and then reperfused for 24 h. The cerebral infarction volume was detected by TTC staining, and the expression of cyto C, caspase-9 and caspase-3 were determined by immunohistochemical assay and Western blot.Results In model group, the cerebral infarct volume was obviously large; the expression of cyto C, caspase-9 and caspase-3 was increased significantly more than that in sham group(P<0.05). In PIC group, the cerebral infarct volume was significantly improved; the expression of cyto C, caspase-9 and caspase-3 was significantly decreased than that in model group(P<0.05). In Atr+PIC group, the rat infarction volume was reduced, and the expression of cyto C, caspase-9 and caspase-3 was significantly decreased than that in Atr group(P<0.05).Conclusion The mechanism of PIC inhibiting neuron apoptosis in focal cerebral I/R rats might be through down-regulating the expression of cyto C, caspase-9 and caspase-3.
picroside Ⅱ; cerebrum; ischemic/reperfusion injury; cyto C/caspase-9/caspase-3 signal pathway; neuroprotection; rats
2017-02-16,
2017-03-15
国家自然科学基金资助项目(No 81274116)
张红艳(1989-),女,硕士生,研究方向:脑血管病,E-mail:1042022747@qq.com; 郭云良(1961-),男,博士,教授,博士生导师,研究方向:脑血管病,通讯作者,E-mail:guoqdsd@163.com
时间:2017-4-24 11:20
http://kns.cnki.net/kcms/detail/34.1086.R.20170424.1120.032.html
10.3969/j.issn.1001-1978.2017.05.016
A
1001-1978(2017)05-0668-07
R-332;R284.1;R322.81;R329.25;R743.310.22;R977.6
