MicroRNA-155 在肝细胞癌对索拉非尼抗药中的作用研究
2017-05-17艾麦提牙森李德卫
吕 峰,王 伟,艾麦提·牙森,金 鑫,李德卫
(重庆医科大学附属第一医院肝胆外科,重庆 400016)
MicroRNA-155 在肝细胞癌对索拉非尼抗药中的作用研究
吕 峰,王 伟,艾麦提·牙森,金 鑫,李德卫
(重庆医科大学附属第一医院肝胆外科,重庆 400016)
目的 探讨微小RNA155(microRNA-155,miR-155)在肝细胞癌(hepatocellular carcinoma,HCC)对索拉非尼(sorafenib)抗药中的作用。方法 将miR-155抑制慢病毒(miR-155 inhibitor)转染miR-155表达相对较高的SMMC-7721细胞,而miR-155过表达慢病毒(miR-155)转染miR-155表达相对较低的HepG2细胞;用荧光定量PCR(qPCR) 检测经慢病毒转染的SMMC-7721细胞及HepG2细胞miR-155表达量,以验证慢病毒转染效果;通过CCK-8法及流式细胞术检测各组细胞经索拉非尼作用后的存活率及凋亡情况;用Western blot检测凋亡相关蛋白活性caspase-3表达量,从而进一步探究各组细胞凋亡情况。结果 与对照组相比,转染miR-155抑制慢病毒的SMMC-7721细胞表达miR-155明显下调(P<0.01),经索拉非尼处理后其存活率明显降低(P<0.05),而索拉非尼诱导其凋亡明显增加(P<0.01),其活性caspase-3表达量明显上调(P<0.01);miR-155过表达慢病毒转染HepG2细胞后,则相反。结论 miR-155 参与肝细胞癌对索拉非尼的抗药,有希望成为一个肝癌治疗的新靶标。
微小RNA155; 肝细胞癌; 索拉非尼; 抗药; 慢病毒; 活性 caspase-3
肝癌发病率及死亡率极高。目前,多靶点抗肿瘤新药索拉非尼成为中晚期肝癌的重要治疗措施[1]。然而,肝癌患者对索拉非尼的药物抵抗问题也日趋暴露[2],研究表明多种 microRNAs 参与肝癌患者对化疗药物索拉非尼的抵抗。
MicroRNA是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,它们在机体参与靶基因抑制性转录后表达调控[3],许多microRNAs在肿瘤的发生、发展过程中有着重要作用[4]。miR-155是一个非常重要的microRNA,在多种肿瘤的发生、发展过程中均可见其踪影,可促进肿瘤细胞的增殖、迁移、侵袭等,如乳腺癌[5-7]、胶质瘤[8]、结直肠癌[9]、肝癌[10-12]等。目前研究证实miR-222[13]、miR-494[14]、miR-21[15]等参与肝癌患者对化疗药物索拉非尼的抵抗,但是miR-155是否参与肝癌患者对索拉非尼的抵抗仍然不清楚。本研究旨在通过慢病毒转染调高或调低miR-155在肝癌细胞中的表达,来探究其是否参与索拉非尼抵抗。
1 材料与方法
1.1 材料 SMMC-7721及HepG2细胞均由重庆医科大学附属第一医院实验研究中心提供;索拉非尼(sorafenib)购自Selleckchem公司(20 mg/支),相对分子质量为464.82,批次:S739702,纯度:99.87%;RPMI 1640培养基购自Corning公司;胎牛血清购自PAN-BiotechGmbH公司;青霉素/链霉素双抗、RIPA裂解液(强)、PMSF(100 nmol·L-1)、SDS-PAGE凝胶配制试剂盒、0.25%胰酶均购自碧云天公司;荧光定量PCR试剂及逆转录试剂盒均购自WesternBiotechnology公司;慢病毒购自吉凯公司;Cell Counting Kit-8(CCK-8)试剂盒购自日本株式会社同仁化学研究所;兔抗人caspase-3购自Abcam公司;辣根过氧化物酶标记的羊抗兔IgG购自武汉三鹰生物技术有限公司。
1.2 细胞培养及稳定细胞株的建立 SMMC-7721及HepG2细胞用含10%的胎牛血清、青霉素(1×105IU·L-1)和链霉素(100 g·L-1)的RPMI 1640培养基,于5% CO2、37 ℃ 孵箱培养。
将对数生长期的人肝癌细胞SMMC-7721、HepG2接种于6孔板中,每孔约1×105个细胞,待d 2细胞汇合度达50%~70%后,用miR-155 inhibitor及control慢病毒转染SMMC-7721细胞;用miR-155及control慢病毒转染HepG2细胞;MOI=10,感染24 h后换新鲜培养基,继续培养24 h后用嘌呤霉素(2 mg·L-1)进行筛选,以建立稳定细胞株。筛选完成后,用荧光显微镜观察细胞GFP绿色荧光表达及其形态学的改变。
1.3 qPCR检测各组细胞miR-155的表达 细胞总RNA的提取、反转录为cDNA及扩增步骤均按照荧光定量PCR试剂盒说明书操作。反转录条件为:25 ℃ 10 min,42 ℃ 60 min,85 ℃ 5 min。扩增条件为:94 ℃预变性4 min;94 ℃变性20 s,60 ℃退火30 s,72 ℃延伸30 s,循环35次;72 ℃检测信号。以U6作为内参计算miR-155相对表达量。
1.4 CCK-8法检测细胞存活率 分别取对数生长期的SMMC-7721 miR-155 inhibitor、SMMC-7721 miR-Control、HepG2 miR-155、HepG2 miR-Control细胞,以1×103/孔的密度接种于96孔板,每孔培养基为100 μL,培养24 h后,等量更换为含有索拉非尼的新鲜培养基,参阅文献[13-14]其终浓度为10 μmol·L-1。各组并设只具有细胞、CCK-8液、不含索拉非尼的常规培养基的不加药组及只具有培养基及CCK-8液而没有细胞的空白组,每组设6个复孔。更换培养基后,SMMC-7721 miR-155 inhibitor、SMMC-7721 miR-Control 两组细胞培养48 h,HepG2 miR-155、HepG2 miR-Control两组细胞培养24 h后,每孔加入CCK-8液10 μL,孵育4 h,用酶标仪(波长450 nm)测定OD值,计算细胞存活率:存活率/%=(加药组OD值-空白组OD值)/(不加药组OD值-空白组OD值)×100%。
1.5 流式细胞仪检测细胞凋亡 用预热的不含EDTA胰酶消化收集经索拉非尼处理后的各组细胞(索拉非尼终浓度及处理时间同上),用预冷PBS液洗涤细胞2次,1 000 r·min-1离心5 min,弃上清,用250 μL 1×Binding buffer重悬细胞,取100 μL细胞悬液于5 mL流式管中,再加入5 μL Annexin V-PE和10 μL 7-AAD,轻轻混匀,避光、室温反应15 min,加入400 μL 1×Binding buffer,混匀后尽快检测。流式细胞仪检测、分析细胞凋亡步骤参考说明书。
1.6 Western blot 检测细胞中活性caspase-3的表达 细胞经索拉非尼处理完成后(索拉非尼终浓度及处理时间同上)提取总蛋白;SDS-PAGE电泳,以60 V电压分离上层胶,在溴酚蓝进入下层胶时电压变为120 V继续电泳, 待溴酚蓝到达下层胶底端附近停止电泳;以250 mA恒定电流转膜30 min;转膜完毕后,漂洗1~2 min再加入脱脂奶粉,在摇床上缓慢摇动,室温封闭2 h;以1 ∶1 000比例稀释兔抗人caspase-3,4 ℃ 孵育过夜;孵育完成后回收一抗并加入TBST,在摇床上缓慢摇动漂洗3次,每次10 min;二抗为辣根过氧化物酶(HRP)标记的羊抗兔IgG(1 ∶2 000),于37 ℃孵育2 h;TBST洗膜3次, 每次10 min,显影并分析活性caspase-3的表达情况。
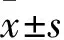
2 结果
2.1 稳定细胞株的建立与细胞形态学改变 慢病毒转染细胞并筛选完成后, 荧光显微镜下观测到GFP绿色荧光明显表达,每个细胞均高表达绿色荧光(Fig 1)。与SMMC-7721 miR-Control组相比,SMMC-7721 miR-155 inhibitor组细胞形态呈规则形或近圆形;与HepG2 miR-Control组相比,HepG2 miR-155组细胞形态呈长梭形、不规则。提示各种稳定细胞株成功建立,miR-155在肝癌细胞中高表达能诱导细胞表型的改变,从而影响细胞的生物学活性。
2.2 各组细胞miR-155的表达 首先用qPCR法分别检测SMMC-7721细胞系及HepG2细胞系miR-155的表达,发现SMMC-7721细胞miR-155表达量较HepG2细胞高(P<0.01)(Fig 2A)。因此,选用miR-155抑制慢病毒转染SMMC-7721细胞,miR-155过表达慢病毒转染HepG2细胞。转染完成后,再用qPCR法进行验证,检测结果显示(Fig 2B):SMMC-7721 miR-155 inhibitor组细胞中miR-155表达量较SMMC-7721 miR-Control组明显减少(P<0.01);HepG2 miR-155组细胞中miR-155表达量较HepG2 miR-Control组明显增多(P<0.01)。证实各组细胞成功转染慢病毒,且各组细胞miR-155表达量均得到相应表达,其差异有统计学意义,提示可进行后续实验。
2.3 各组细胞存活率 用CCK-8法检测经索拉非尼作用后的各组细胞存活率。检测结果显示(Fig 3),SMMC-7721 miR-155 inhibitor组细胞存活率(56.54±4.98)%较SMMC-7721 miR-Control组(77.70±10.34)%明显降低(P<0.05);HepG2 miR-155组细胞存活率(63.46±7.85)%较HepG2 miR-Control组(48.21±4.87)%明显升高(P<0.05)。可见调低肝癌细胞miR-155的表达可降低其经索拉非尼作用后的存活率,相反,调高肝癌细胞miR-155的表达可增加其经索拉非尼作用后的存活率。以上结果提示,miR-155可能在肝细胞癌对索拉非尼抵抗中起作用。
2.4 各组细胞凋亡率 为进一步验证以上结论,采用流式细胞术检测细胞凋亡率。结果显示(Fig 4),经索拉非尼处理各组细胞后,SMMC-7721 miR-155 inhibitor组细胞凋亡率(35.00±2.65)%较SMMC-7721 miR-Control组(12.33±1.53)%明显升高(P<0.01);HepG2 miR-155组细胞凋亡率(9.67±1.53)%较HepG2 miR-Control组(19.00±1.73)%明显降低(P<0.01)。可见肝癌细胞miR-155的表达量下调后,其经索拉非尼作用后的凋亡率明显上升,而肝癌细胞miR-155的表达量上调后,其经索拉非尼作用后的凋亡率则明显下降。此结果进一步提示miR-155可能参与肝细胞癌对索拉非尼抗药作用。
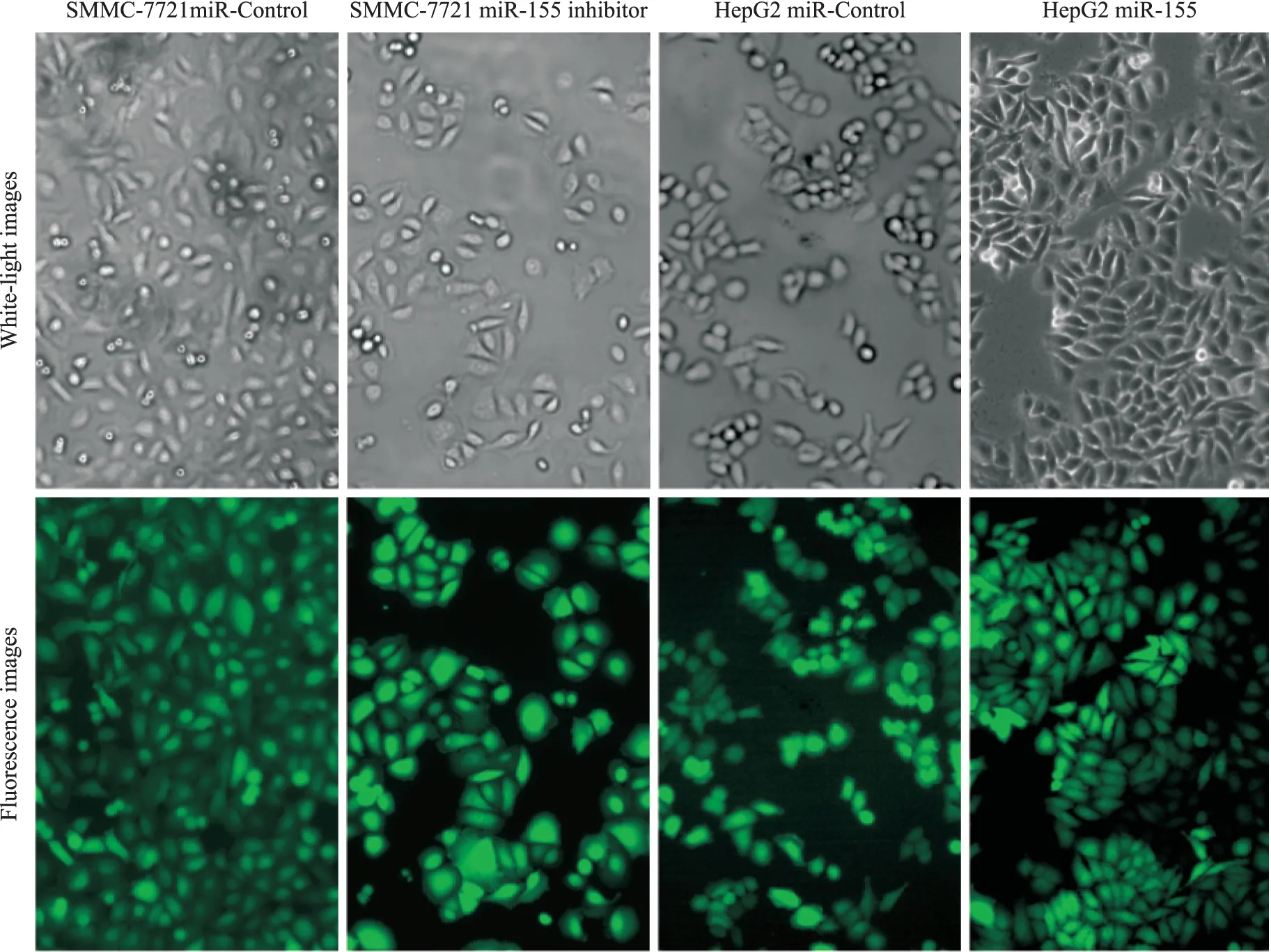
Fig 1 Fluorescent microscopy of infection efficiency of lentivirus in SMMC-7721 and HepG2 cells and cell morphologies(×100)
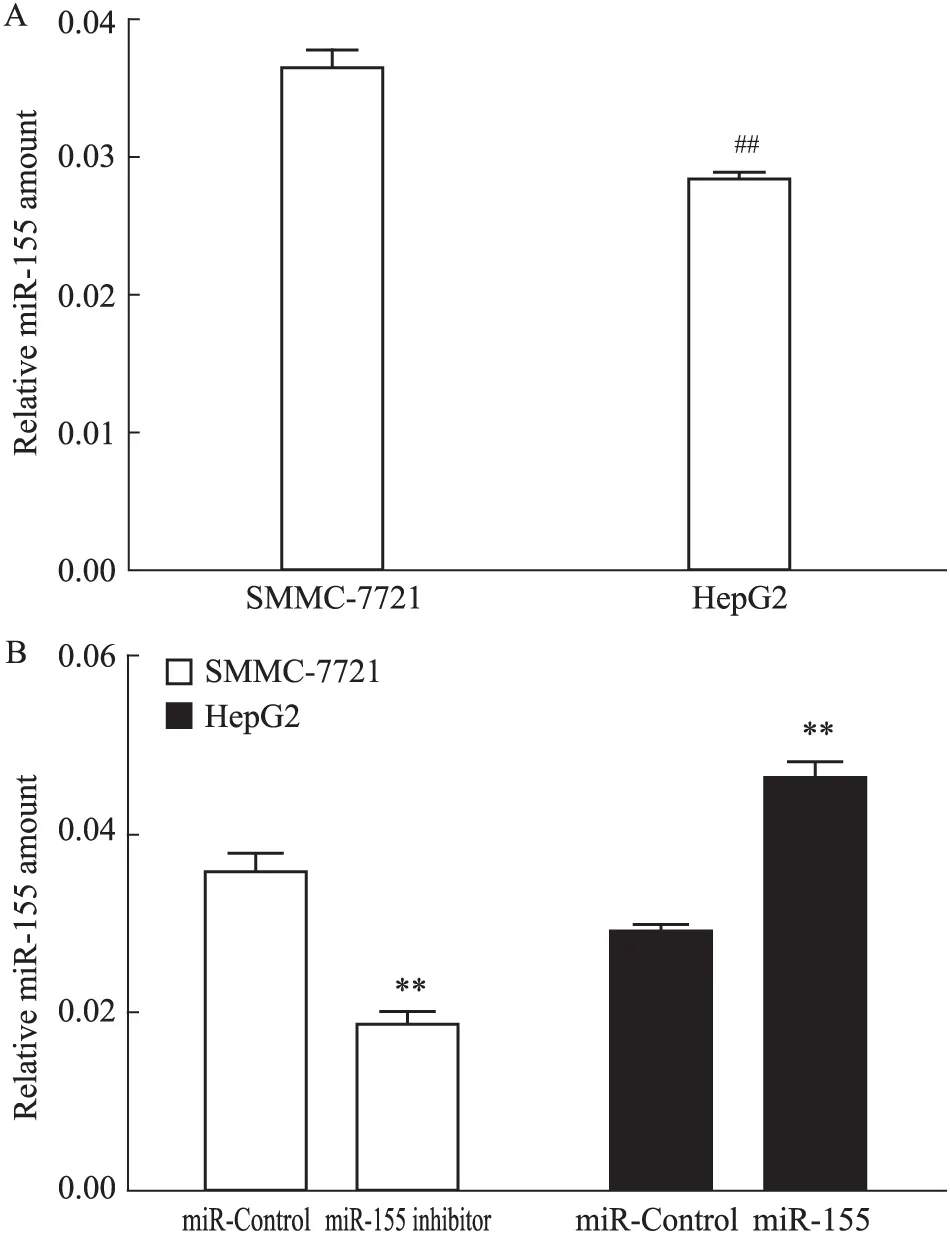
Fig 2 Expression of miR-155 in hepatocellular carcinoma cells
##P<0.01vsSMMC-7721;**P<0.01vsmiR-Control
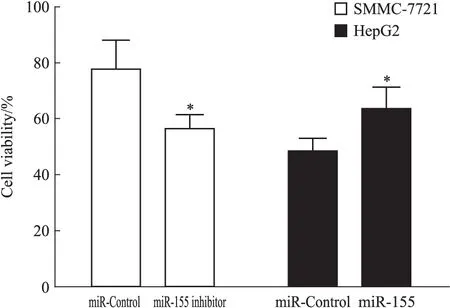
Fig 3 Viability of hepatocellular carcinoma cells
*P<0.05vsmiR-Control
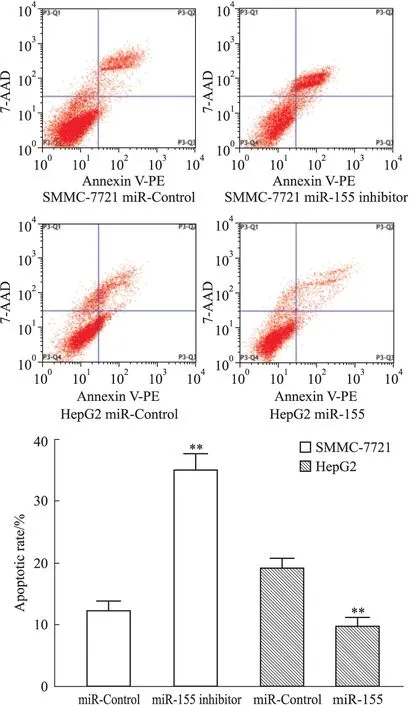
Fig 4 Influence of miR-155 on apoptosis of hepatocellular carcinoma cells induced by sorafenib
**P<0.01vsmiR-Control
2.5 各组细胞中活性caspase-3的表达量 Caspase-3是细胞凋亡过程中最主要的终末剪切酶,caspase-3在细胞凋亡中起着不可替代的作用,能很好反映细胞的凋亡情况。在凋亡过程中caspase-3可以被多种因素活化,从而诱导细胞的凋亡。Western blot检测结果显示(Fig 5),与对照组相比,SMMC-7721 miR-155 inhibitor组细胞活性caspase-3表达量明显较高(P<0.01),HepG2 miR-155组细胞活性caspase-3表达量明显较低(P<0.01)。结果表明miR-155低表达能促进索拉非尼诱导的肝癌细胞凋亡,而高表达能抑制索拉非尼诱导的肝癌细胞凋亡,更进一步说明miR-155可能参与肝细胞癌对索拉非尼抗药作用。
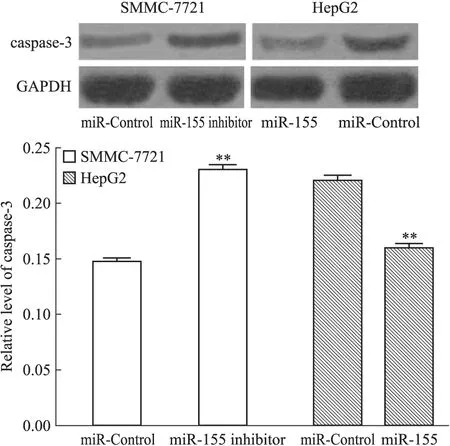
Fig 5 Relative protein expression of caspase-3 in each group
**P<0.01vsmiR-Control
3 讨论
肝细胞肝癌对靶向药物索拉非尼的抵抗问题日趋暴露,多种microRNAs参与肝癌患者对化疗药物索拉非尼的抵抗,但是miR-155是否参与肝癌患者对索拉非尼的抵抗仍然不清楚。研究发现,肝癌组织中miR-155的表达与肝癌细胞的低分化、高转移、TNM分期分级、一年无复发生存率明显相关[16]。一些研究证实miR-155可靶向抑制SOX6,从而间接下调p21waf1/cip1的表达,促进肝癌细胞的增殖[17]。miR-155异常表达能促进肝移植后肝癌患者的癌细胞侵袭,导致患者预后不良[11]。miR-155可靶向抑制TP53INP1诱导肝癌干细胞形成及增殖[18]。上述研究表明, miR-155 的异常表达可促进肝癌细胞恶性表型的转变,是一个致癌microRNA,我们推测其可能参与肝细胞肝癌对索拉非尼的药物抵抗。 本研究以SMMC-7721细胞系及HepG2细胞系为肝细胞肝癌的细胞模型,发现SMMC-7721细胞系相对高表达miR-155,而HepG2细胞系则相对低表达miR-155,所以选择抑制性慢病毒转染SMMC-7721细胞系,而过表达慢病毒转染HepG2细胞系。发现miR-155抑制慢病毒转染的SMMC-7721细胞系表达miR-155与对照组相比明显下调,经索拉非尼处理后其存活率明显低于对照组,而其凋亡率明显高于对照组;而转染过表达miR-155组的HepG2细胞表达miR-155较对照组明显上调,经索拉非尼处理后其存活率明显高于对照组,而其凋亡率明显低于对照组。这表明miR-155增强了肝细胞癌对索拉非尼的抵抗作用,各组间活性caspase-3的表达差异也进一步证实了这一点。因此,miR-155有望成为一个肝癌诊断及治疗的新靶标。
miR-155通过何种机制增强肝细胞癌对索拉非尼的抵抗作用仍然不清楚。miR-155在乳腺癌抵抗化疗药物中也起着至关重要的作用,其机制包括对抑癌基因FOXO3a的抑制作用、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)及上皮间质转化(EMT)信号通路的促进作用、对RhoA靶蛋白的抑制作用等[19]。许多其他microRNAs在肝细胞癌对索拉非尼的抵抗作用中也有参与,如miR-222通过激活PI3K/Akt信号通路,促进肝癌细胞的增殖、迁移、侵袭及对索拉非尼抵抗作用[13];miR-494通过靶向抑制PTEN,从而激活PI3K/Akt信号通路,促进肝癌细胞增殖、迁移、侵袭及对索拉非尼抵抗作用[14];miR-21通过PTEN/Akt通路抑制肝癌细胞的自噬作用,从而加强肝癌细胞对索拉非尼的抵抗作用[15]。可见microRNAs可通过作用多靶点、多种机制调节肿瘤对化疗药物的抵抗作用。而miR-155是否也通过激活PTEN/PI3K/Akt信号通路及其他信号通路,从而抑制、阻断索拉非尼诱导的肝癌细胞凋亡,尚有待进一步研究。
综上所述,miR-155的高表达可增强肝细胞癌对索拉非尼抗药性,然而其机制需进一步研究。因而,miR-155作为一种潜在的靶向治疗分子在肝细胞肝癌的生物治疗中具有重要临床意义。
(致谢:本实验完成于重庆医科大学附属第一医院实验研究中心。本研究中许多实验技术由实验研究中心的汤为学老师、邓晓娟老师指导,在此深表感谢!)
[1] 王 芳,符立梧. 多靶点抗肿瘤新药索拉非尼的研究进展[J].中国药理学通报,2008,24(8):1117-20.
[1] Wang F, Fu L W. Research advances in sorafenib:amultiple targeted anti-tumor agent[J].ChinPharmacolBull,2008, 24(8):1117-20.
[2] 朱 云,程 旸,李爱民. 原发性肝细胞癌对索拉非尼耐药机制的研究进展[J]. 中国药理学通报,2013,29(6):752-5.
[2] Zhu Y, Cheng Y,Li A M. Mechanisms of drug resistance to sorafenib in hepatocellular carcinoma[J].ChinPharmacolBull,2013, 29(6): 752-5.
[3] Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J].Cell,2004, 116(2): 281-97.
[4] Jansson M D, Lund A H. MicroRNA and cancer[J].MolOncol,2012, 6(6): 590-610.
[5] Iorio M V, Ferracin M, Liu C G, et al. MicroRNA gene expression deregulation in human breast cancer[J].CancerRes,2005, 65(16):7065-70.
[6] Kong W, Yang H, He L, et al. MicroRNA-155 is regulated by the transforming growth factor beta/Smad pathway and contributes to epithelial cell plasticity by targeting RhoA[J].MolCellBiol,2008, 28(22):6773-84.
[7] Kong W, He L, Coppola M, et al. microRNA-155 regulates cell survival, growth, and chemosensitivity by targeting FOXO3a in breast cancer[J].JBiolChem,2010, 285(23):17869-79.
[8] Ling N, Gu J, Lei Z, et al. MicroRNA-155 regulates cell proliferation and invasion by targeting FOXO3a in glioma[J].OncolRep,2013, 30(5):2111-8.
[9] Zhang G J, Xiao H X, Tian H P, et al. Upregulation of microRNA-155 promotes the migration and invasion of colorectal cancer cells through the regulation of claudin-1 expression[J].IntJMolMed,2013, 31(6):1375-80.
[10]Yan X L, Jia Y L, Chen L, et al. Hepatocellular carcinoma-associated mesenchymal stem cells promote hepatocarcinoma progression: role of the S100A4-miR155-SOCS1-MMP9 axis[J].Hepatology,2013, 57(6):2274-86.
[11]Han Z B, Chen H Y, Fan J W, et al. Up-regulation of microRNA-155 promotes cancer cell invasion and predicts poor survival of hepatocellular carcinoma following liver transplantation[J].JCancerResClinOncol,2012, 138(1):153-61.
[12]Liu F, Kong X, Lv L, et al. TGF-β1 acts through miR-155 to down-regulate TP53INP1 in promoting epithelial-mesenchymal transition and cancer stem cell phenotypes[J].CancerLett,2015,359(2):288-98.
[13]Liu K, Liu S, Zhang W, et al. miR-222 regulates sorafenib resistance and enhance tumorigenicity in hepatocellular carcinoma[J].IntJOncol, 2014, 45(4): 1537-46.
[14]Liu K, Liu S, Zhang W, et al. miR-494 promotes cell proliferation, migration and invasion, and increased sorafenib resistance in hepatocellular carcinoma by targeting PTEN[J].OncolRep,2015,34(2):1003-10.
[15]He C,Dong X,Zhai B,et al.MiR-21 mediates sorafenib resistance of hepatocellular carcinoma cells by inhibiting autophagy via the PTEN/Akt pathway[J].Oncotarget,2015,6(30):28867-81.
[16]Guan C, Yang F, He X, et al. Clinical significance of microRNA-155 expression in hepatocellular carcinoma[J].OncolLett,2016,11(2):1574-80.
[17]Xie Q, Chen X, Lu F, et al. Aberrant expression of microRNA 155 may accelerate cell proliferation by targeting sex-determining region Y box 6 in hepatocellular carcinoma[J].Cancer,2012,118(9):2431-42.
[18]Liu F, Kong X, Lv L, et al. MiR-155 targets TP53INP1 to regulate liver cancer stem cell acquisition and self-renewal[J].FEBSLett,2015,589(4):500-6.
[19]Yu D D, Lv M M, Chen W X, et al. Role of miR-155 in drug resistance of breast cancer[J].TumourBiol,2015,36(3):1395-401.
Effect of microRNA-155 on sorafenib resistance in hepatocellular carcinoma
LYU Feng, WANG Wei, AI Mai Ti·Ya Sen, JIN Xin, LI De-wei
(DeptofHepatobiliarySurgery,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
Aim To investigate the effect of microRNA-155(miR-155) on sorafenib resistance in hepatocellular carcinoma(HCC).Methods Lentivirus mediated miR-155 inhibition was transfected into SMMC-7721 cells, while lentivirus mediated miR-155 overexpression was transfected into HepG2 cells. The level of miR-155 was evaluated by qPCR. Cell viability and apoptosis were analyzed by cell counting kit-8(CCK-8) assay and flow cytometry, respectively.The protein expression of activated caspase-3 was measured by Western blot.Results Compared to control group, the expression of miR-155 was significantly downregulated in miR-155 inhibition lentivirus infected SMMC-7721 cells(P<0.01), sorafenib treatment markedly suppressed cell viability(P<0.05) and increased cell apoptosis(P<0.01), as well as enhanced the expression of activated caspase-3(P<0.01). However, HepG2 cells were infected by miR-155 overexpression lentivirus which deserved completely opposite results.Conclusion miR-155 may participate in sorafenib resistance in HCC and provide a promising molecular target for the treatment of HCC.
mircoRNA-155; hepatocellular carcinoma; sorafenib; drug resistance; lentivirus; activated caspase-3
2016-12-15,
2017-01-10
国家自然科学基金资助项目(No 81470898)
吕 峰(1990-),男,硕士生,研究方向:miR-155 在肝细胞癌中的生物学作用及其机制,E-mail:1036688945@qq.com; 李德卫(1970-),男,博士,教授,研究方向:肝胆疾病,通讯作者,E-mail: lidewei406@sina.com
时间:2017-4-24 11:20
http://kns.cnki.net/kcms/detail/34.1086.R.20170424.1120.028.html
10.3969/j.issn.1001-1978.2017.05.014
A
1001-1978(2017)05-0657-06
R329.25;R342.2;R373.9;R394.2;R735.702.2;R735.705
