C57BL/6J小鼠冻融胚胎移植后所得小鼠及其子代生物学特性数据测定与分析
2017-05-17徐伟超顾剑洁刘丽均
徐伟超,顾剑洁,葛 蓉,刘丽均,徐 平,芮 荣
(1.南京农业大学动物医学院,南京 210095; 2.中科院上海生命科学研究院,上海 200031;3.上海斯莱克实验动物有限责任公司,上海 201615)
研究报告
C57BL/6J小鼠冻融胚胎移植后所得小鼠及其子代生物学特性数据测定与分析
徐伟超1,2,顾剑洁3,葛 蓉3,刘丽均3,徐 平2,芮 荣1
(1.南京农业大学动物医学院,南京 210095; 2.中科院上海生命科学研究院,上海 200031;3.上海斯莱克实验动物有限责任公司,上海 201615)
目的 探讨C57BL/6J(B6)小鼠冷冻复苏胚胎移植后所得小鼠及其子代的平均体增长和血液生化等部分生物学特性数据的变化。方法 实验分为3组。实验组I:冻融胚移植组, B6小鼠体外受精后的2-cell胚胎采用EFS法冷冻,复苏后移植到受体(ICR小鼠)输卵管内所产的小鼠(雄鼠30只,雌鼠20只);实验组II:冻融胚胎移植所产的小鼠成熟后经自然交配得到的子一代(雄鼠26只,雌鼠17只);对照组:正常饲养和自然交配所得的子代(雌雄小鼠各20只)。3组小鼠饲养至16周龄,每周定时测定体质量,至16周龄时采血,测定各组小鼠血清生化值,并进行分析比较。结果 实验组I雌雄小鼠初生重和1 ~16周的平均体重均显著高于对照组(P<0.01),实验组II雌鼠体重从12周开始均显著高于对照组(P<0.01),而雄鼠只有部分周龄与对照组有差异,其余周龄则差异无显著性;实验组I和实验组II小鼠的血清生化值与对照组相比除AST、TP和Ca等项目无变化外,其余项目均发生了显著或极显著的上调或下调。结论 冷冻对胚胎移植所得小鼠及其自然繁殖子一代的平均体增长和血清生化值有一定影响。
冻融胚胎;体增长;血清生化指标
胚胎冷冻保存的研究起始于上世纪40年代末,Polge 和Smith[1]用甘油作防冻剂,保存兔胚胎获得成功。1972年Whittingham等[2]用慢速冷冻方法获得小鼠胚胎的成功保存。1978年Willadsen[3]建立了玻璃化冷冻保存技术。此后,随着辅助生殖技术的发展,胚胎冷冻技术日新月异,冷冻的物种范围也不断扩展。玻璃化冷冻是指是应用高浓度的冷冻保护剂保护细胞,通过快速冷冻从而避免细胞内冰晶形成的一种冷冻技术。与传统的程序化冷冻相比,具有操作简便、省时、冷冻损伤小等特点,因此成为胚胎冷冻保存技术的研究热点[4,5]。然而,玻璃化冻存液浓度很高,在常温下对胚胎具有一定的毒性,并且冷冻这一处理也会对胚胎产生一定的影响。现阶段研究多集中在胚胎冷冻复苏对配子和胚胎的发育潜能,以及胚胎表观遗传学方面的影响[6]。
本研究以C57BL/6J小鼠作为研究对象,对冷冻复苏移植所得小鼠及其后代(子一代)的部分生物学特性与正常繁育的小鼠进行比较,旨在探讨胚胎冷冻对冷冻所得个体及其子代的影响,现将初步结果报告如下。
1 材料和方法
1.1 实验动物
SPF级C57BL/6JSlac小鼠,受体小鼠为SPF级ICR小鼠,均由上海斯莱克实验动物有限责任公司提供(SCXK(沪)2012—0002)。小鼠饲养于屏障式动物房内(SYXK(沪)2012-0002),温度(20~24)℃,相对湿度40%~60%,以60Co辐照灭菌(30 kGy)的配合饲料(沪饲证<2014>04001)饲养,自由采食和饮水,12 h明/12 h暗自动光控。
1.2 实验分组
实验分为3组,实验组I:冻融胚移植组,B6小鼠体外受精后的2-cell胚胎,采用EFS法冷冻,复苏后移植到受体(ICR小鼠)输卵管内所得到的小鼠(雄鼠30只,雌鼠20只);实验组II:冻融胚胎移植所得的小鼠成熟后经自然交配得到的子一代(雄鼠26只,雌鼠17只);对照组:正常饲养和自然交配所得的子代(雌雄小鼠各20只)。
1.3 实验试剂与仪器
1.4 实验方法
近年来,一种名叫“粮食银行”的新型粮食流通业态在各地涌现,即企业代农户存储粮食,农民可按约定提取商品或折现。“粮食银行”不仅破解了农民储粮卖粮难题,还减轻了运营主体资金和原粮供应压力。
2.1 体重比较
试剂:PMSG(宁波第二激素厂,批号110915);hCG(宁波第二激素厂,批号120711);EFS20:含20%乙二醇的FS(Ficoll PM-sucrose)液;EFS40:含40%乙二醇的FS液;0.75 mol/L蔗糖;0.25 mol/L蔗糖;HTF:参照Quinn P (1985)[7]配制;KSOM:参照Lawitts (1993)[8]和Erbach (1994)[9]配制,所用试剂均购自Sigma公司;血液生化试剂盒(南京建成生物工程研究所,20151026)。仪器:实体显微镜(Nikon,SMZ645); CO2培养箱(Hera, cell, Kandro);日立7080全自动血液生化分析仪;手术器械;移液枪(Gilson);液氮罐等。
3.上市公司数量不断增加。截至2017 年底,深圳境内上市公司达273家,同比增长17.17%,排名全国第三,其中中小板112家、创业板82家,合计194家,连续11年位居大中城市首位;境内上市公司总市值5.34 万亿元,首次超过上海,跃居全国第二;而自2014年新三板扩容以来,新三板挂牌企业增长量迅猛,从无到平均每年超过200家,增长量位居全国首位,截至2017年10月底,全市就有新三板挂牌公司830家。
针对郁闭度低,且部分区域出现面积较大的空地的林区,在进行森林抚育管理工作时,应当加大人工投入,伐除空地区域的杂草和杂树,并在春、秋两季进行主要树木的补栽,填补林中空地。补种之后,管理人员还应当做好相应的幼林抚育工作,定期修枝,及时施加水、肥,帮助幼木成长。
在柔性直流输电系统的发展过程中,不同的换流站之间连接的输电线路较多。通常情况下,线路之间的直流潮流会按照换流站之间的电压以及线路电阻进行自动分配,在该自动分配状态下,部分指定线路会受到一定的影响而不能实现完全经受换流站进行独立控制,当直流潮流分配的自由度被控制后,会造成后续一系列线路潮流在进行电力运输时无法正常推进调度工作,最终影响广州市供电公司电网的正常运行[1]。为了保证电网能够正常输电,通常会采用串联的形式将附加的线路直流潮流控制器引入电网中,借以实现灵活有效的控制治理电网线路潮流。
1.4.1 超排与体外受精:下午3:00对3~4周龄C57BL/6J雌鼠腹腔注射PMSG每只10 IU,48 h后腹腔注射hCG,每只10 IU,次日早上采集卵团和雄鼠精子,待精子于HTF液滴内获能1~1.5 h后吸取适量获能精液于卵团内,次日早上可看到2-cell胚胎,洗胚并冷冻。
1.4.2 胚胎冷冻、复苏和移植: 胚胎冷冻复苏采用本实验室王俊风等[10]的EFS二步玻璃化冷冻法与相应的复苏法。移植采用输卵管移植法,即将复苏后的胚胎移植至假孕1d的ICR母鼠输卵管内,两侧输卵管各移植15~20枚胚胎。
4.2 多途径提高现有基层中医师素质 多途径、多手段提高基层中医师素质。一是开展针对性强的继续教育项目,提高基层中医师知识和技能水平,继续教育项目除了中西医基本技能的培训,还应侧重中医前沿知识、社会医学和心理学、传统文史哲学的培训。二是各级卫生部门应积极鼓励中专及以下学历的基层中医师提升学历,通过成人专科或本科教育,提高学历的同时促进职称的提升,可以全额报销或报销一定比例的学费,并保障学习期间的待遇。三是各级卫生部门应积极组织中医师承或确有专长的基层中医师,通过集中培训和学习,提高其获得助理执业医师或乡村助理全科医师资格证书,规范行医。
1.4.3 小鼠体重测定: 分别称量实验组和对照组小鼠初生重(1 d),以及1~16周每周的体重,比较实验组与对照组小鼠各时间点体重平均值并绘制生长曲线图。
由图1和图2可以看出,冻融胚移植所得小鼠(实验组I)的体重自出生起到16周龄都极显著的大于对照组小鼠的体重(P<0.01)。而其后代(实验组II)小鼠则有所不同,其中雄鼠除12~14周龄外,其他周龄均与对照组无显著差异,雌鼠则有所不同了,9周龄与11周龄时体重显著高于对照组(P<0.05),12~16周龄的体重极显著的高于对照组(P<0.01)。
1.4.5 统计学方法: 采用IBM SPSS Statistics 20软件对数据进行处理,进行t检验,P值<0.05表示差异显著,P值<0.01表示差异极显著,否则差异不显著。
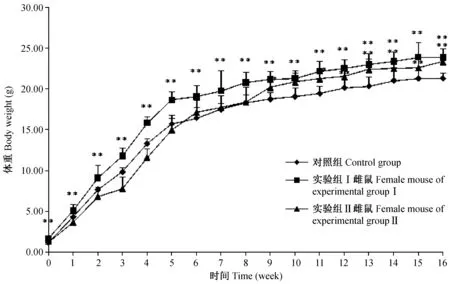
图1 实验组与对照组雌鼠体重比较Fig.1 Comparison of the body weight of female mice between experimental and control groups.

注:与对照组比较,*表示P<0.05,**表示P<0.01.图2 实验组与对照组雄鼠体重比较Note. Compared with the control group, *P<0.05,** P<0.01.Fig.2 Comparison of the body weight of male mice between experimental and control groups
2 结果
3)如图6c所示情况,机体轴线与设计轴线平行,存在偏移量,此时需调节支撑油缸,使掘进机向设计轴线靠拢,转变为图6b状态。
1.4.4 血清生化值测定: 实验组和对照组小鼠饲养至16 周龄,采集血清后测定其血清生化值,测定项目包括谷丙转氨酶ALT、谷草转氨酶AST、总蛋白TP、白蛋白ALB、碱性磷酸酶ALP、血糖Glu、尿素氮BUN、肌酐CREA、血钙Ca、血磷P、总胆固醇CHOl、甘油三酯TG、高密度脂蛋白HDL和低密度脂蛋白LDL这14项,然后实验组与对照组小鼠作比较。
2.2 血清生化比较
由表1可以看出,实验组I小鼠除AST、TP、Ca和TG这些项目与对照组无显著差异外,其余项目均发生了显著或极显著的上调或下调。实验组II小鼠仅AST、TP和Ca与对照组无显著差异,其余项目与对照组相比较发生了显著或者极显著的上调或下调。但是除上述整体观的差异外,各实验组雌雄小鼠的表现又有所不同,实验组I的雌鼠ALT、BUN和CREA,实验组I雄鼠Glu,实验组II雌鼠LDL-C这些项目与对照组相比差异也无显著性。
3 讨论
冷冻过程本身可能会引起重要的细胞内改变,如改变转录因子活性,减少胚胎发育潜能,增加不完整的DNA片段,改变某些基因的表达活性等等[11-13]。这些变化会对子代小鼠生理特性和遗传特性产生影响,周经委[14]等的发现冻胚移植小鼠的体重从出生到12周龄都是高于正常繁育小鼠的,而且冻胚移植小鼠组的脂肪和肌肉含量也是显著高于对照组的。Wang等[15]研究发现冻胚移植小鼠印记基因H19/Igf2的表达与正常组差异有显著性,并发现这是由于该印记基因的调控区域发生变化的结果。也有研究发现冷冻胚胎不会对子代产生影响,如梁琳琳等[16]研究玻璃化冷冻胚胎移植对小鼠子代发育和学习记忆能力的影响,发现玻璃化冷冻对子代小鼠生长发育和记忆功能无明显影响。刘先菊等[17]通过利用生化标记和微卫星检测法观察近交系C57BL/6J小鼠胚胎冷冻后的遗传质量是否发生改变,结果发现玻璃化冷冻(EFS40,straw)C57BL/6J小鼠胚胎移植后所得小鼠的遗传物质并未造成影响,其遗传特性保持稳定。
本实验生长曲线的结果显示实验组I小鼠体重从出生至16周龄均极显著的高于对照组,该结果与周经委[14]的研究结果相同,造成初生重较大的原因可能是由于冻胚复苏移植后胎儿数目较少的缘故,但是断奶以后小鼠体增长仍然居高不下则可能是由于胚胎体外培养与冷冻处理所致。当实验组I小鼠自由交配产生实验组II小鼠以后,却发现除了实验组II雌鼠从11周开始生长速度又快起来以外,其余雌雄小鼠多数周龄的体重与对照组无显著差异,故认为实验组I小鼠自由交配的后代部分纠正了生长过快这一问题,但是雌鼠11周以后体增长仍然快于对照组这一问题值得深入分析。血液生化比较结果显示实验组I和实验组II小鼠与对照组相比除AST、TP和Ca等少数项目没有差异以外,而其余项目都发生了显著或极显著的上调或下调, AST在临床上是肝功能检查的指标,TP反映了肝脏的合成功能,Ca受肾上腺、肾脏和甲状旁腺等多种器官的调节,这3项没有差异表明相关器官组织调节功能正常。我们知道血液生化值是有一个正常范围的,在这个范围之内我们都可以认为该值是正常的,那么血液生化值的差异数据是否代表与该数据相关的组织器官功能的异常,比如影响ALP值的肝脏功能和与影响CREA值的肾脏功能,这需要我们进一步的研究验证。
我们知道,生物体的生长发育涉及许多基因相互作用,胚胎时期基因的微小变化可能对子代产生深远的影响, Mamo等[18]用高密度的基因芯片技术研究了玻璃化冷冻过程对小鼠8细胞胚胎内基因表达的影响,发现其中有628个基因的表达发生改变,这些基因主要调节新陈代谢和应激反应。这些研究表明了胚胎冷冻技术对胚胎的基因层面的影响。我们在实验中也对冻胚后代做了芯片分析并筛选出了大量差异表达基因,后面如何将这种差异性与具体的生理特性变化联系起来需要进一步研究探讨。
本研究选取了体增长和血液生化值这些指标来探讨冻胚后代生理特性的变化,其代表性是有限的,后面还需要在组织层面和分子层面来研究冻胚后代的变化,从而对冻胚后代有更深入的认识。
[1] Polge C, Smith AU. Revival of spermatozoa after vitrification and dehydration at low temperature[J]. Nature, 1949, 164: 666.
[2] Whittingham DG, Leibo SP, Mazur P. Survival of mouse embryos frozen to -196℃ and -269℃[J]. Science, 1972, 178: 411-414.
[3] Polge C, Willadsen SM. Freezing eggs and embryos of farm animals [J]. Elsevier, 1978,15(3):370-373.
[4] Vanderzwalmen P, Bertin G, Debauche CH, et al. Births after vitrification at morula and blastocyst stages: effect of artificial reduction of the blastocoelic cavity before vitrification [J]. Hum Reprod, 2002, 17(3): 744-751.
[5] Mukaida T, Wada S, Takahashi K, et al. Vitrification of human embryos based on the assessment of suitable conditions for 8-cell mouse embryos [J]. Hum Reprod,1998, 13: 2874- 2879.
[6] Mochida K, Hasegawa A, Tagumak K, et al. Cryopreservation of mouse embryos by ethylene glycol-based vitrification [J]. J Vis Exp, 2011.18(57): 3155.
[7] Quinn P, Kerin JF, Warnes GM. Improved pregnancy rate in human in vitro fertilization with the use of medium based on the composition of human tubal fluid [J]. Fertil Steril, 1985, 44: 493-498.
[8] Han MS, Niwa K, Kasai M. Vitrification of rat embryos at various development stages [J]. Theriogenology, 2003, 59(8): 1851-1863.
[9] Lawitts JA, Biggers JD. Culture of preimplantation embryos [J]. Methods Enzymol.1993, 225: 153-164.
[10] 王俊风,李淼,张艺宝,等.两种玻璃化冷冻胚胎方法对不同品系小鼠胚胎冷冻效果比较 [J]. 中国比较医学杂志, 2013, 23(6): 12-15.
[11] Dhali A, Anchamparuthy VM, Butler SP, et al. Gene expression and development of mouse zygotes following droplet vitrification [J]. Theriogenology, 2007, 68(9): 1292-1298.
[12] Boonkusol D, Gal AB, Bodo S, et al. Gene expression profiles and in vitro development following vitrification of pronuclear and 8-cell stage mouse embryos [J]. Mol Reprod Dev. 2006, 73(6): 700-708.
[13] Kader A, Agarwal A, Abdelrazik H, et al. Evaluation of post-thaw DNA integrity of mouse blastocysts after ultrarapid and slow freezing [J]. Fertil Steril. 2009, 91(5): 2087-2094.
[14] 周经委,吴蓉花,郭里,等. 玻璃化冷冻胚胎与新鲜胚胎移植对子代小鼠生长发育的影响 [J]. 医学研究生学报, 2015, 28(6): 569-573.
[15] Wang ZG, Xu L, He F. Embryo vitrification affects the methylation of the H19/Igf2 differentially methylated domain and the expression of H19 and Igf2 [J]. Fert Steril, 2010, 93(8): 2729-2733.
[16] 梁琳琳,张翠莲,李杭生,等.玻璃化冷冻胚胎移植对小鼠子代发育和学习记忆能力的影响 [J]. 郑州大学学报(医学版),2012, 47(1): 33-36.
[17] 刘先菊,黄馨,王艳蓉,等. C57BL/6J胚胎冷冻小鼠的遗传监测和分析研究 [J].实验动物科学, 2010, 27(4): 11-14.
[18] Mamo S, Bodo S, Kobolak J, et al. Gene expression profiles of vitrified in vivo derived 8-cell stage mouse embryos detected by high density oligonucleotide microarrays [J]. Mol Reprod Dev, 2006, 73(11): 1380.
Mensurement and analysis of biological characteristics of C57BL/6J mice and their offsprings after frozen-thawed embryo transfer of C57BL/6J mice
XU Wei-chao1,2, GU Jian-jie3, GE Rong3, LIU Li-jun3, XU Ping2, RUI Rong1
(1. College of Veterinary Medicine, Nanjing Agriculture University, Nanjing 210095, China; 2. Shanghai Institutes for Biological Sciences, SIBS, Shanghai 200031; 3. Shanghai SLAC Laboratory Animal Co. Ltd, Shanghai 201615)
Objective To investigate the changes of average body weight gain and serum biochemical indexes of C57BL/6J mice (B6 mouse) and their offspings after frozen-thawed embryo transfer of B6 mice. Methods The mice were divided into three groups in this study. In the experimental group I (E-I, 30 males and 20 females), 2-cell embryos after in-vitro fertilization were collected, and cryopreserved by EFS method, then obtained the offsprings after transplantation of the recovered embryos to oviduct of recipient mice (ICR mouse). In the experimental group II (E-II, 26 males and 17 females), when the mice from E-I grew to maturity, the offsprings were obtained from natural mating of mice from E-I. In the control group (20 males and 20 females), the offsprings came from conventional feeding and natural mating. The three groups of mice were raised to 16 weeks old, weighing the body weight at a regular time intervals, and the serum biochemical indexes were obtained from 16-week-old mice. Then the changes of average body weight and serum biochemical indexes of the mice were analyzed. Results The average body weight of E-I mice was significantly higher than that of control group at each week-age (P<0.01). The average body weight of E-II female mice was significantly higher than that of the control group in 12-16-week old mice (P<0.01), but the average body weight of E-II male mice showed no significant differences compared with the control group except for few weeks. The serum biochemical indexes of E-I and E-II mice were changed in all items except for AST, TP and Ca. Conclusions There are some effects on the average body weight gain and serum biochemical indexes of C57BL/6J mice and their offspings after frozen-thawed embryo transfer.
Frozen-thawed embryo; Body weight gain; Serum biochemical index; C57BL/6J mice
上海市科委科研计划项目(15140900100,14140900500)。
徐伟超(1991-),男,硕士生,研究方向:动物生殖工程和低温生物学,E-mail:932716206@qq.com。
徐平(1964-),男,研究员,研究方向:实验动物低温生物学和实验动物遗传性疾病模型,Email:pingxu@sibs.ac.cn;芮荣(1962-),男,教授,研究方向:动物生殖调控与产科疾病,Email:rrui@njau.edu.cn。
R-33
A
1671-7856(2017) 04-0069-06
10.3969.j.issn.1671-7856. 2017.04.012
2016-11-09
