尼莫地平对H2O2诱导的PC12细胞凋亡的保护作用
2017-05-17李辉然
李辉然
(山东医学高等专科学校附属医院神经外科,山东 临沂 276000)
研究报告
尼莫地平对H2O2诱导的PC12细胞凋亡的保护作用
李辉然
(山东医学高等专科学校附属医院神经外科,山东 临沂 276000)
目的 探讨尼莫地平对过氧化氢(H2O2)诱导的PC12细胞凋亡的保护作用。方法 PC12细胞随机分为正常组,模型组(200 μmol/L H2O2),尼莫地平低、中、高浓度组(1、10、100 μmol/L尼莫地平+200 μmol/L H2O2)。MTT法检测各组细胞活力,Hoechst染色各组细胞凋亡情况,比色法检测天冬氨酸蛋白水解酶(caspase 3),caspase 9及超氧化物歧化酶(SOD)活性与丙二醛(MDA)含量,western blot分析B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)及p53蛋白。结果 与正常组比较,模型组中细胞活力下降,细胞凋亡率提高,caspase 3及caspase 9提高,SOD活性降低,MDA含量降低,Bcl-2表达量下降,Bax及p53表达量上升,差异均具有统计学意义(P<0.01);与模型组比较,尼莫地平低、中、高浓度组细胞活力提高,细胞凋亡率降低,caspase 3及caspase 9活性降低,SOD活性提高,MDA含量提高,Bcl-2蛋白表达量提高,Bax及p53表达量降低,差异均具有统计学意义(P<0.01)。结论 尼莫地平可通过调控细胞凋亡相关蛋白表达,从而抑制H2O2诱导的PC12细胞凋亡。
尼莫地平;PC12细胞;过氧化氢;凋亡
帕金森氏病、阿尔兹海默症、亨廷症等神经退行性疾病常发于老年人,并伴随着全球老龄化进程,发病率呈逐年上升,给患者及社会带来沉重负担[1]。研究显示氧化应激与神经退行性疾病发生及发展密切相关,在发病过程中氧自由基大量生成,使细胞膜发生过氧化损伤,DNA断裂,最终导致细胞凋亡[2-5]。因此抑制氧化应激所导致的神经细胞凋亡对于神经退行性疾病的治疗具有重要意义。钙通道阻滞剂,又称之为钙拮抗剂,主要是通过阻断Ca2+内流,降低细胞内Ca2+浓度而广泛应用于心脑血管疾病及呼吸系统疾病的治疗[6]。尼莫地平是第二代的二氢吡啶类钙通道阻滞剂,脂溶性高,易于通过血脑屏障进入脑组织,保护脑细胞,因此被广泛的应用于脑出血,蛛网膜下腔出血等脑血管疾病的治疗当中[7]。但是尼莫地平对于退行性疾病的研究报道较少,目前已知尼莫地平对于低氧诱导的PC12细胞毒性,氧糖剥夺及谷氨酸诱导的PC12细胞凋亡具有显著的抑制作用[8, 9],提示尼莫地平对于神经细胞损伤具有一定保护作用。因此本研究将在此基础上进一步探讨尼莫地平对于过氧化氢(H2O2)诱导的PC12细胞凋亡的保护作用及具体机制。
1 材料
1.1 细胞
大鼠PC12细胞购于中国科学院上海细胞库。
1.2 仪器
Tecan Infinite F200/M200型多功能酶标仪购自瑞士Tecan集团公司;迷你双垂直电泳仪,迷你转印电泳仪,ChemiDocTM XRS凝胶成像系统购自美国Bio-Rad公司;AF6000荧光显微镜购自德国Leica公司。
1.3 药品及试剂
尼莫地平片,批号120859,购于山东健康药业有限公司。BCA法蛋白定量试剂盒,Hoechst染色试剂盒,caspase 3及caspase 9活性检测试剂盒购自碧云天生物技术研究所;辣根过氧化物酶标记山羊抗兔IgG (H+L),BCA检测试剂盒,SOD活性检测试剂盒,MDA含量检测试剂盒购自南京建成生物工程有限公司;兔抗Bax,Bcl-2,p53,GAPDH单克隆抗体购自美国Epitmics公司;达尔伯克(氏)必需基本培养基(DMEM)培养基购自美国Gibco公司。
2 方法
2.1 实验分组[9-11]
将处于生长对数期的PC12细胞为5组,正常组,模型组,尼莫地平低、中、高浓度组;其中正常组加不含任何药物的DMEM培养基,模型组加含200 μmol/L H2O2的DMEM培养基,尼莫地平低、中、高浓度组分别加入含1、10、100 μmol/L 尼莫地平及200 μmol/L H2O2的DMEM培养基。
2.2 细胞活力检测
将处于生长对数期的PC12细胞接种于96孔板,培养48 h。按“2.1”分组及给药,继续培养48 h,每孔加入终浓度为5 mg/mL 的MTT 20 μL,4 h后,每孔加入二甲亚砜150 μL,10 min后,酶标仪570 nm处测定A值。
2.3 Hoechst染色检测细胞凋亡
将处于生长对数期的PC12细胞消化接种于6孔板,培养48 h。按“2.1”分组及给药,继续培养48 h,后按照Hoechst染色试剂盒说明书进行操作,染色,固定,显微镜下观察细胞凋亡形态并拍照,并通过Image J软件对荧光强度进行统计。
2.4 比色法检测细胞中Caspase 3及Caspase 9的活性
将处于生长对数期的PC12细胞接种于6孔板,培养48 h。按“2.1”分组及给药,继续培养48 h,后按照caspase 3及caspase 9试剂盒说明书检测其活性,酶标仪405 nm处测定A值。
2.5 比色法检测细胞上清液中SOD活性及MDA含量
将处于生长对数期的PC12细胞接种于6孔板,培养48 h。按“2.1”分组及给药,继续培养48 h,收集上清液,并分别严格按照试剂盒说明书检测SOD活性及MDA含量。
2.6 western blot检测细胞中Bax,Bcl-2及p53蛋白表达
将处于生长对数期的PC12细胞接种于6孔板,培养48 h。按“2.1”分组及给药,继续培养48 h,收集细胞,加入细胞裂解液,裂解30 min,离心,收获蛋白。采用BCA试剂盒检测蛋白浓度。蛋白样品煮沸变性10 min,上样,进行十二烷基硫酸钠凝胶电泳1~2 h,湿法转膜30~40 min。一抗(兔抗Bax,Bcl-2,p53单克隆抗体,小鼠抗GAPDH单克隆抗体,稀释浓度皆为1∶100)孵育,4℃过夜;二抗(辣根过氧化物酶标记山羊抗兔IgG (H+L),稀释浓度为1:200)室温孵育1-2 h。滴加化学发光液,在凝胶成像系统中曝光。用“Quantity One”软件统计各抗体条带灰度值。
2.7 数据分析
3 结果
3.1 尼莫地平对H2O2诱导的PC12细胞活力的影响
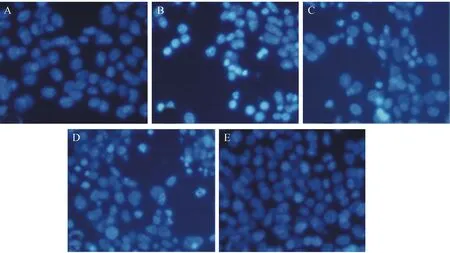
A:正常组;B:模型组;C:尼莫地平低浓度组;D:尼莫地平中浓度组;E:尼莫地平高浓度组注:与正常组比较,**P<0.01;与模型组比较,##P<0.01图2 尼莫地平对H2O2诱导的PC12细胞凋亡的影响Note. A: Normal group; B: Model group; C: Low-dose nimodipine group; D: Moderate-dose nimodipine group; E: High-dose nimodipine group.**P<0.01, Compared with the normal group. ##P<0.01, compared with the model group.Fig.2 Effect of nimodipine on the cell apoptosis induced by H2O2
如图1所示,与正常组(0.69±0.06)%比较,模型组(0.34±0.03)%细胞活力显著降低(P<0.01);与模型组比较,尼莫地平低、中、高浓度组[(0.42±0.04)%,(0.53±0.05)%,(0.66±0.06)%]细胞活力显著上升(P<0.01)。
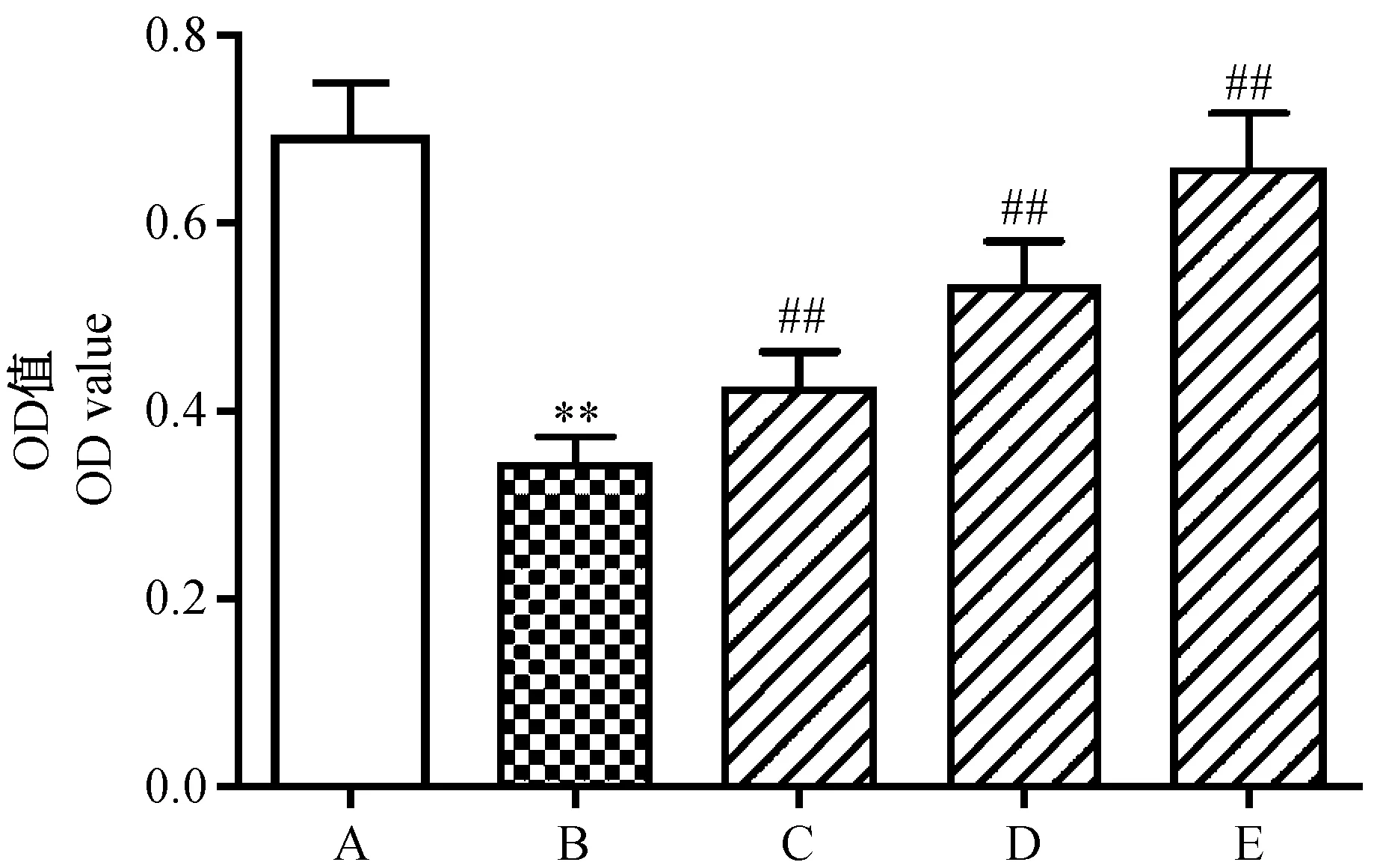
A:正常组;B:模型组;C:尼莫地平低浓度组;D:尼莫地平中浓度组;E:尼莫地平高浓度组与正常组比较,**P<0.01;与模型组比较,##P<0.01图1 尼莫地平对H2O2诱导的PC12细胞活力的影响Note. A: Normal group; B: Model group; C: Low-dose nimodipine group;D: Moderate-dose nimodipine group; E: High-dose nimodipine group.**P<0.01, compared with the normal group.##P<0.01, compared with the model group.Fig.1 Effect of nimodipine on cell viability induced by H2O2
3.2 尼莫地平对H2O2诱导的PC12细胞凋亡的影响
Hoechst染色结果所示,与正常组(3.50±0.30)%比较,模型组(38.49±4.59)%细胞凋亡率显著提高(P<0.01);与模型组比较,尼莫地平低、中、高浓度组[(30.05±3.12)%,(18.43±1.76)%,(7.84±0.76)%]细胞凋亡率显著降低(P<0.01)。见图2。
3.3 尼莫地平对H2O2诱导的PC12细胞中caspase 3及caspase 9活性的影响
与正常组比较,模型组caspase 3及caspase 9活性显著提高(P<0.01);与模型组比较,尼莫地平低、中、高浓度组caspase 3及caspase 9活性显著降低(P<0.01)。见表1。
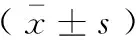
表1 尼莫地平对H2O2诱导的PC12细胞中caspase 3及caspase 9活性的影响
与正常组比较,**P<0.01;与模型组比较,##P<0.01
Note. Compared with the normal group,**P<0.01; Compared with the model group,##P<0.01.
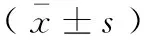
表2 尼莫地平对H2O2诱导的PC12细胞上清液中SOD活性及MDA含量的影响
与正常组比较,**P<0.01;与模型组比较,##P<0.01。
Note.**P<0.01, compared with the normal group;##P<0.01, compared with the model group.
3.4 尼莫地平对H2O2诱导的PC12细胞上清液中SOD活性及MDA含量的影响
与正常组比较,模型组SOD活性显著降低(P<0.01),MDA含量显著提高(P<0.01);与模型组比较,尼莫地平低、中、高浓度组SOD活性显著提高(P<0.01),MDA含量显著降低(P<0.01)。见表2。
3.5 尼莫地平对H2O2诱导的PC12细胞中Bax及Bcl-2蛋白表达量的影响
与正常组比较,模型组中Bcl-2表达量降低(P<0.01),Bax表达量提高(P<0.01);与模型组比较,尼莫地平低、中、高浓度组中Bcl-2表达量提高(P<0.01),Bax表达量降低(P<0.01)。见图3。
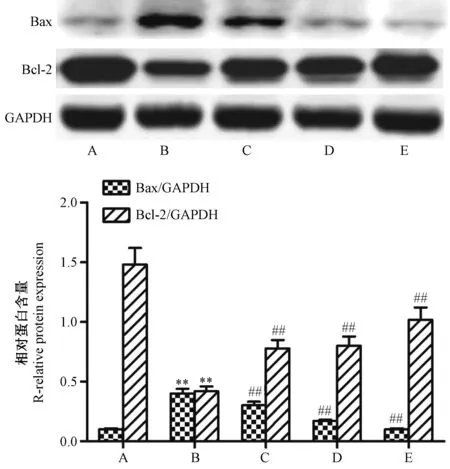
A:正常组;B:模型组;C:尼莫地平低浓度组;D:尼莫地平中浓度组;E:尼莫地平高浓度组与正常组比较,**P<0.01;与模型组比较,##P<0.01图3 尼莫地平对H2O2诱导的PC12细胞中Bax及Bcl-2蛋白表达量的影响Note. A: Normal group; B: Model group; C: Low-dose nimodipine group; D: Moderate-dose nimodipine group; E: High-dose nimodipine group. **P<0.01, compared with the normal group. ##P<0.01, compared with the model group.Fig.3 Effect of nimodipine on expressions of Bax and Bcl-2 protein in PC12 cells induced by H2O2
3.6 尼莫地平对H2O2诱导的PC12细胞中p53蛋白表达量的影响
与正常组比较,模型组中p53表达量提高(P<0.01);与模型组比较,尼莫地平低、中、高浓度组中p53表达量降低(P<0.01)。见图4。

A:正常组;B:模型组;C:尼莫地平低浓度组;D:尼莫地平中浓度组;E:尼莫地平高浓度组与正常组比较,**P<0.01;与模型组比较,##P<0.01图4 尼莫地平对H2O2诱导的PC12细胞中p53蛋白表达量的影响Note. A: Normal group; B: Model group; C: Low-dose nimodipine group; D: Moderate-dose nimodipine group; E: High-dose nimodipine group. **P<0.01, compared with the normal group. ##P<0.01, compared with the model group.Fig.3 Effect of nimodipine on expressions of p53 protein in PC12 cells induced by H2O2.
4 讨论
PC12细胞是来源于大鼠肾上腺嗜络细胞瘤的一种细胞,因其形态、结构及生化功能与神经元非常的类似,所以常常被用来作为研究神经细胞生长、凋亡、发育及功能的细胞培养模型[12, 13]。H2O2作为氧自由基中的一种,也常作为研究细胞氧化应激模型的诱导剂,所以本研究首先结合相关报道[10, 11]及MTT预实验,结果发现200 μmol/L H2O2能使50%左右的PC12细胞凋亡,能显著抑制PC12细胞活力,因此本研究选用此浓度作为作为PC12细胞氧化应激模型的诱导剂量。
尼莫地平属于二氢吡啶类的钙离子拮抗剂,能通过阻断Ca2+电压依赖性的钙通道进入细胞内,降低细胞内Ca2+浓度,同时也能抑制细胞内的Ca2+浓度释放,使细胞内的Ca2+浓度维持在一定浓度。尼莫地平具有很强的脂溶性,易于通过血脑屏障,进入脑组织,发挥脑组织保护作用。临床上尼莫地平常用于脑部疾病的治疗,近些年来体外实验还证实尼莫地平对于低氧诱导的PC12细胞毒性,氧糖剥夺及谷氨酸诱导的PC12细胞凋亡具有显著的抑制作用,从而提示尼莫地平能显著的保护神经细胞[7-9]。所以本研究在此基础上通过MTT法及Hoechst法检测尼莫地平对于H2O2诱导的细胞活力及细胞凋亡率的影响,结果表明尼莫地平能显著的提高H2O2诱导的细胞活力,降低细胞凋亡率,与Bork等[8],Rahbar-Roshandel等[9]结果一致,提示尼莫地平对于氧化应激诱导的PC12细胞损伤具有保护作用。
细胞凋亡由细胞凋亡基因严格控制,其中研究最为广泛的Bcl-2蛋白家族,Bax及Bcl-2是Bcl-2家族常见促凋亡蛋白及抑凋亡蛋白,二者能形成异源二聚体,进而作用于线粒体膜上,促使caspase进行级联反应,最终诱导细胞凋亡。Caspase在正常情况下是以无活性酶原形式存在于细胞内,当受到上游凋亡信号刺激时,caspase的起始因子caspase 9被其它激酶所剪切或者自身发生切割作用后被激活,传递凋亡级联信号,最终传递到caspase家族的执行因子caspase 3,导致细胞凋亡。p53是种常见的抑癌基因,包括野生型及突变型两种,前者能显著的使细胞周期停止,后者对于细胞凋亡无任何影响。研究显示H2O2能显著的上调Bax及p53表达,下调Bax表达,并提高caspase 3及caspase 9活性,通过抑制此变化,能显著的阻断H2O2诱导的PC12细胞凋亡[14-16]。本研究继续探讨尼莫地平对于上述蛋白表达及活性的影响,结果表明尼莫地平能显著降低Bax及p53表达量,提高Bax表达量,并抑制caspase 3及caspase 9的活性,从而提示尼莫地平能通过调控细胞凋亡相关蛋白表达,从而发挥其抵抗H2O2诱导PC12细胞凋亡的作用。
另外氧自由基的过度积累会直接导致细胞膜脂质过氧化,其中MDA是细胞膜脂质过氧化后的副产物,是细胞遭受氧化应激损伤的生物标志物。SOD是细胞内主要的抗氧化酶,能够清除细胞内氧自由基,从而抵抗氧自由基损伤。所以本研究接着利用比色法检测尼莫地平对于SOD活性及MDA含量的影响,结果表明尼莫地平能显著的提高H2O2诱导的PC12细胞上清液中SOD活性,而降低MDA含量,进而提示尼莫地平能提高H2O2诱导的PC12细胞的抗氧化能力,进而发挥其细胞凋亡抑制作用。
综上所述,尼莫地平能显著的抵抗H2O2诱导PC12细胞凋亡,与上调Bcl-2表达,下调Bax、p53表达,提高SOD活性并降低caspase 3,caspase 9活性及MDA含量有关。
[1] 薛小燕, 郭小华, 李敏, 等. 神经退行性疾病发病机制研究进展 [J]. 中国老年学杂志, 2015, 35(11): 3149-3152.
[2] Fischer R, Maier O. Interrelation of oxidative stress and inflammation in neurodegenerative disease: role of TNF [J]. Oxid Med Cell Longev, 2015, 2015: 610813.
[3] Ha KG, Kim JE, Jeong RS, et al. The role of oxidative stress in neurodegenerative diseases [J]. Exp Neurobiol, 2015, 24(4): 325-340.
[4] Espinet C, Gonzalo H, Fleitas C, et al. Oxidative stress and neurodegenerative diseases: a neurotrophic approach [J]. Curr Drug Targets, 2015, 16(1): 20-30.
[5] 赵春阳, 王晓良, 彭英. Nrf2在神经退行性疾病中的作用及激活剂的研究进展 [J]. 药学学报, 2015, 50(4): 375-384.
[6] 全丽, 谢红萍, 龙英杰, 等. 钙通道阻滞剂保护肾脏作用研究进展 [J]. 中国现代医药杂志, 2014, 16(12): 96-98.
[7] 周业旺, 郑金瓯. 尼莫地平治疗蛛网膜下腔出血后脑血管痉挛的研究进展 [J]. 医学综述, 2011(12): 1858-1860.
[8] Bork K, Wurm F, Haller H, et al. Neuroprotective and neuroregenerative effects of nimodipine in a model system of neuronal differentiation and neurite outgrowth [J]. Molecules, 2015, 20(1): 1003-1013.
[9] Rahbar-Roshandel N, Razavi L, Tavakoli-Far B, et al. Mebudipine and dibudipine protect PC12 cells against oxygen-glucose deprivation and glutamate-induced cell death [J]. Pathophysiology, 2008, 15(4): 227-231.
[10] 崔勇, 王艳杰, 赵丹玉, 等. 藏花素对H_2O_2诱导氧化应激细胞模型凋亡的影响 [J]. 中华中医药杂志, 2015, 30(5): 1818-1821.
[11] 陈晓素, 杨晓凯, 林一均, 等. 高良姜素对PC12细胞氧化损伤的保护作用及其机制研究 [J]. 上海中医药大学学报, 2016, 30(3): 93-96.
[12] 李峥, 高项羽, 刘喆, 等. 丙泊酚通过MAPK/ERK信号通路对谷氨酸诱导的神经PC12细胞损伤的抑制作用 [J]. 中国药房, 2016, 27(1): 61-63.
[13] 江芮, 吕浩, 李申, 等. 槲皮苷对过氧化氢诱导PC12细胞损伤的保护作用 [J]. 中风与神经疾病杂志, 2015, 32(8): 688-690.
[14] Liu M, Xu Y, Han X, et al. Potent effects of flavonoid-rich extract from Rosa laevigata Michx fruit against hydrogen peroxide-induced damage in PC12 cells via attenuation of oxidative stress, inflammation and apoptosis [J]. Molecules, 2014, 19(8): 11816-11832.
[15] Huang JY, Yuan YH, Yan JQ, et al. 20C, a bibenzyl compound isolated from Gastrodia elata, protects PC12 cells against rotenone-induced apoptosis via activation of the Nrf2/ARE/HO-1 signaling pathway [J]. Acta Pharmacol Sin, 2016, 37(6): 731-740.
[16] Huang C, Lin Y, Su H, et al. Forsythiaside protects against hydrogen peroxide-induced oxidative stress and apoptosis in PC12 cell [J]. Neurochem Res, 2015, 40(1): 27-35.
Protective effect ofnimodipineon PC12 cell apoptosis induced by H2O2
Li Hui-ran
(Department of Neurosurgery, Affiliated Hospital of Shandong Medical College, Linyi, Shandong 276000, China)
Obejective To explore the protective effect of nimodipine on PC12 cell apoptosis induced by hydrogen peroxide (H2O2). Methods The cells were randomized into five groups: normal group, model group (200 μmol/L H2O2), nimodipine low-, medium- and high-dose groups (1, 10, 100 μmol/L nimodipne+200 μmol/L H2O2). Cell viability was measured by MTT assay. Cell apoptosis was assessed by Hoechst staining. The activity of cysteinyl aspartate specific proteinase 3 (caspase 3), caspase 9 and superoxide dismutase (SOD), the level of malonic aldehyde (MDA) were measured bycolorimetry. The expression of B-cell lymphoma-2 (Bcl-2), Bcl-2 associated X protein (Bax) and p53 were detected by western blot. Results Compared with the normal group, the cell apoptosis rate, the activity of caspase 3 and caspase 9, the MDA level, and the expression of Bax and p53 were significantly increased, the cell viability, SOD activity, and expression of Bcl-2 were decreased in the model group (P<0.01). Compared with the model group, the cell apoptosis rate, the activity of caspase 3 and caspase 9, the level of MDA, and the expression of Bax were decreased; and the cell viability, SOD activity, and the expression of Bcl-2 were increased in the nimodipine low-, medium- and high-dose groups (P<0.01). Conclusions Nimodipine suppresses cell apoptosis induced by H2O2in PC12 cells, which may be related to regulation of expression of cell apoptosis-related proteins.
Nimodipine; PC12 cell line; Hydrogen peroxide; Apoptosis
李辉然(1974-),男,副主任医师,主要研究发现方向:神经外科脑出血及脑肿瘤, E-mail:13605398296 jmqf01@163.com。
R-33
A
1671-7856(2017) 04-0014-06
10.3969.j.issn.1671-7856. 2017.04.003
2016-11-20
