三维可视化技术在肝门部胆管癌术前评估中的应用*
2017-05-17余璠鲁正
余 璠 鲁 正
三维可视化技术在肝门部胆管癌术前评估中的应用*
余 璠 鲁 正
目的:探讨三维可视化技术在肝门部胆管癌术前评估中的应用价值。方法:收集2014年3月至2016年4月蚌埠医学院第一附属医院38例肝门部胆管癌手术患者临床资料,将所有患者分为两组,对照组术前未行三维可视化重建(n=20),观察组术前行三维可视化重建(n=18)。分析两组术前诊断结果与术中实际情况的相符程度,并比较两组相关手术指标。结果:在肿瘤纵向和门静脉、肝动脉垂直方向侵犯评估中,观察组和对照组都具有较高的准确率,二者无显著性差异。而在肝门部解剖分型上,观察组中所有患者分型与术中实际吻合,吻合率高于对照组(100%vs.70%,P<0.05),同时对肝体积的预估和实测更加精确(r=0.986,P<0.001)。此外,与对照组相比,观察组平均术中出血量、手术时间明显减少(P<0.05),R0切除率无明显差异。结论:三维可视化技术能精准完成肝门部胆管癌术前评估。
计算机辅助三维成像术前评估肝门部胆管癌
肝门部胆管癌(hilarcholangiocarcinoma,HCCA),是指发生于肝总管、左右肝管或其汇合部的胆管黏膜上皮癌,全世界发病率为1/100 000~2/100 000,但发病率有明显上升的趋势[1]。根治性手术是使HCCA患者长期生存甚至治愈的唯一可能手段[2],但由于肝门部胆管、血管解剖复杂,变异概率高,肿瘤邻近血管易侵犯,且常合并阻塞性黄疸,受损的肝功能限制了切肝范围等因素存在,HCCA手术切除率低且整体预后不佳[3],精准的术前评估是提高肝门部胆管癌手术切除率、降低手术死亡率的前提[4]。传统的影像学评估方法因为缺乏整体感和立体感,在判读过程中容易产生偏差[5]。近年来三维可视化技术(three-di⁃mensional visualization technology)(简称3D技术)出现并应用于临床,具有视觉立体直观等优点,在HC⁃CA术前评估方面显示出较高的临床价值及应用前景[6],但其可靠性还有待于在临床实践中进一步验证。本研究通过回顾性分析蚌埠医学院第一附属医院肝胆外科自2014年3月至2016年4月38例HCCA手术患者临床资料,探讨3D技术在HCCA术前评估中的应用价值。
1 材料与方法
1.1 一般资料
为排除其他因素对研究结果产生影响,选择纳入标准为:1)肝功能Child-Pugh分级均为A~B级;2)Bismuth-CorletteⅡ、Ⅲ、Ⅳ型肝门部胆管癌患者,且不伴有远处转移,术后病理均证实为胆管癌。排除标准:1)术前肝功能分级C级,或患者伴有其他合并疾病难以耐受大手术的病例。2)拒绝行手术治疗的患者。纳入研究患者共38例,术前基于3D技术进行手术评估和手术规划患者18例(观察组),应用CT影像资料行术前规划患者20例(对照组),两组患者的临床病理特征相似(表1)。该研究获得本院伦理委员会批准,所有患者均签署知情同意书。
1.2 方法
1.2.1 三维重建方法所有患者均行肝脏三期薄层64排CT扫描(层厚1.25 mm),扫描图像以DICOM格式储存传输,观察组患者DICOM文件导入深圳旭东公司开发的腹部三维可视化系统进行重建,将各期CT数据进行程序化图像分割、配准,重建对象包括肝脏、肝动、静脉系统、门静脉系统,肿瘤位置,计算肝脏各段体积,合成三维模型用于术前评估。
1.2.2 术前评估内容肿瘤进展程度:HCCA可沿胆管纵向侵犯以及突破胆管向邻近门静脉、肝动脉垂直方向侵犯,分为两个方向进行评估。1)纵向侵犯评估以Bismuth-Corlette分型进行评级,观察组患者在3D模型中剔除其他组织,仅显示肿瘤和胆道系统,旋转视野获得纵向侵犯信息。对照组中通过阅读CT资料通过胆管的狭窄、腔内占位等征象来判断。2)垂直方向评估对照组判断采用Baek分型[7]作为评估肝动脉、门静脉侵犯程度标准。观察组判断方法在3D模型中单独显示肿瘤与门静脉或肝动脉,多角度观察肿瘤与血管位置关系。侵犯程度分级:0级,血管显示良好(血管无侵及);Ⅰ级,血管有压迹或推移(肿瘤与血管紧密相邻);Ⅱ级,肿瘤与血管融合成块、完全包裹血管。
围肝门部脉管分型:胆管解剖分型采用Couniaud分型方法[8],门静脉分型采用Cheng分型方法[9],肝动脉变异分型采用Michels分型方法[10]。
肝体积的计算:在观察组中,通过软件模块自动测算出肝脏各段体积,术后对切除肝脏利用排水法得出肝体积,将术前三维重建测算出的肝体积与术后实际结果进行对比。
1.2.3 手术方案规划在计算机中完成手术方案设计,手术方案应同时满足以下条件:1)达到多维度的R0切缘;2)剩余肝体积至少要大于标准肝体积的30%;3)确保预保留侧肝脏入、出肝血流和胆汁引流通畅。
1.2.4 手术方法根据术前评估信息制定手术方案,施行半肝、扩大半联合尾状叶肝切除、肝外胆管切除、肝十二指肠韧带内骨骼化清扫和胆管-空肠Roux-en-Y吻合术。手术方法:常规选择右上腹反“L”形切口进腹,探查有无腹腔转移病灶、远处淋巴结转移。骨骼化清扫肝十二指肠韧带,充分游离待切除侧肝脏,选择预切除侧区域血流阻断方式,沿肝缺血线离断肝实质,将标本整块切除,术中行快速冷冻检查明确上下切缘是否达到R0切除级别,将断面胆管整形后,行胆肠Roux-en-Y吻合。1.2.5术后观察指标收集并记录两组患者术中出血量、手术时间、R0切除率,以及术后并发症如胆瘘、切口感染、肺部感染、腹腔积液、肝功能不全的发生情况。
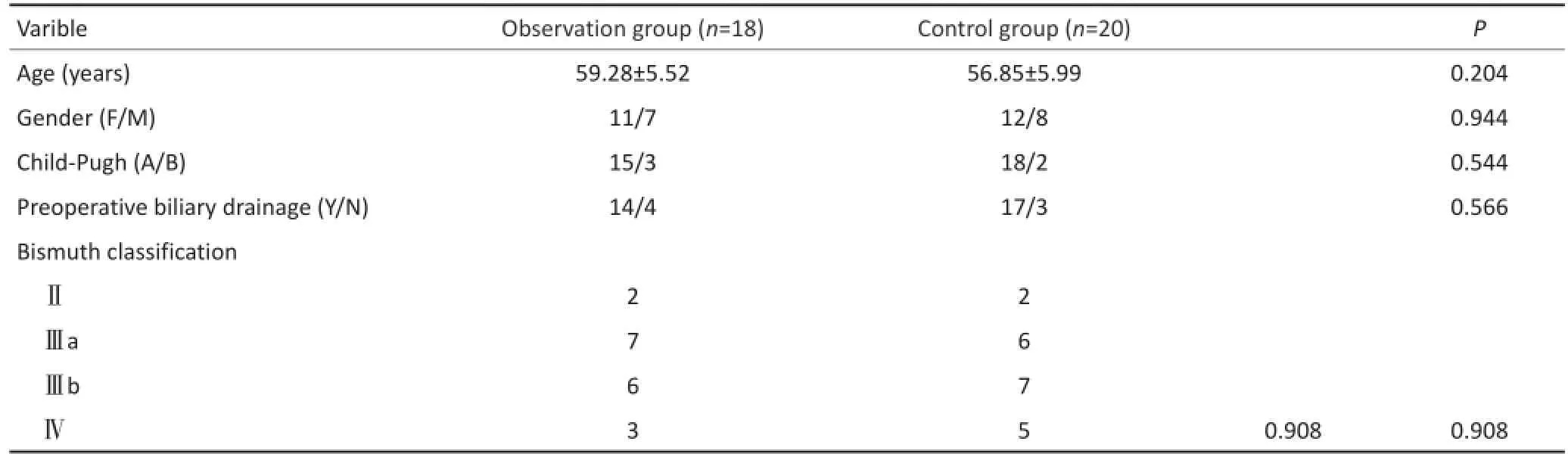
表1 两组患者的术前一般临床资料比较Table1 Comparison of the clinicopathological characteristics between the two groups of patients
1.3 统计学处理
采用SPSS 22.0软件包进行统计学分析。计量资料用x±s形式表示,两组中计量资料比较采用t检验,计数资料采用χ2检验。观察组中通过3D技术测算切肝体积与术后实际体积比较采用相关性检验。P>0.05为差异有统计学意义。
2 结果
2.1 术前评估结果
2.1.1 进展程度评估将两组术前评估分别与术后实际结果对照:1)纵向进展准确率观察组纵向评估准确率达88.9%(16/18);对照组中评估准确率为85%(17/20),两组评估准确率差异无统计学意义(P= 0.552);2)垂直方向进展准确率观察组中门静脉、肝动脉侵犯评估准确率分别为:94.4%(17/18)、88.9%(16/18)。对照组中门静脉、肝动脉侵犯评估准确率分别为90%(18/20)、85%(17/20),两组评估准确率差异均无统计学意义(P=0.541,0.552)。
2.1.2 肝门部脉管解剖分型观察组中术前发现肝动脉解剖变异6例,门静脉变异4例;胆管解剖变异2例,观察组所有术前评估分型结果与术中探查结果完全吻合(图1),分型准确率达到100%;对照组中术前发现肝动脉变异2例,门静脉变异1例,胆管解剖变异1例,经术中确认有2例肝动脉、3例门静脉、1例胆管变异未在术前得到预判,分型准确率为70%,两组准确率差异具有统计学意义(P=0.014)。
2.1.3 肝体积测算观察组18例患者中术前预估肝体积(516.6±105.2)mL,实际切除肝体积为(545.2±122.2)mL,两者之间存在高相关性(t=0.986,P<0.001)。
2.2 手术规划与实际结果
对照组患者手术规划与实际术式情况为:左半肝联合尾状叶切除3例,右半肝联合尾状叶切除7例,扩大左半肝联合尾状叶切除3例,扩大右半肝联合尾状叶切除6例,1例患者术前拟行右半肝联合尾状叶切除因术中发现盆腔转移放弃转行而姑息性胆道内引流术。观察组所有患者均按术前拟定方案完成手术,具体情况如下:左半肝联合尾状叶切除6例,右半肝联合尾状叶切除8例(图2),扩大左半肝联合尾状叶切除1例,扩大右半肝联合尾状叶3例。
2.3 手术相关指标
观察组术中出血量和手术时间均少于对照组,差异有统计学意义(P<0.05),观察组R0切除率高于对照组,但差异无统计学意义(表2,P>0.05)。观察组术后并发症发生情况:胆瘘1例,腹腔积液1例,肺部感染1例,并发症发生率为22.2%(3/18);对照组中患者发生胆瘘2例,腹腔积液2例,肺部感染1例,并发症发生率为25%(5/20)。观察组术后并发症总体发生率低于对照组,但差异无统计学意义(P>0.05)。发生术后并发症的患者,均通过保守治疗后痊愈。
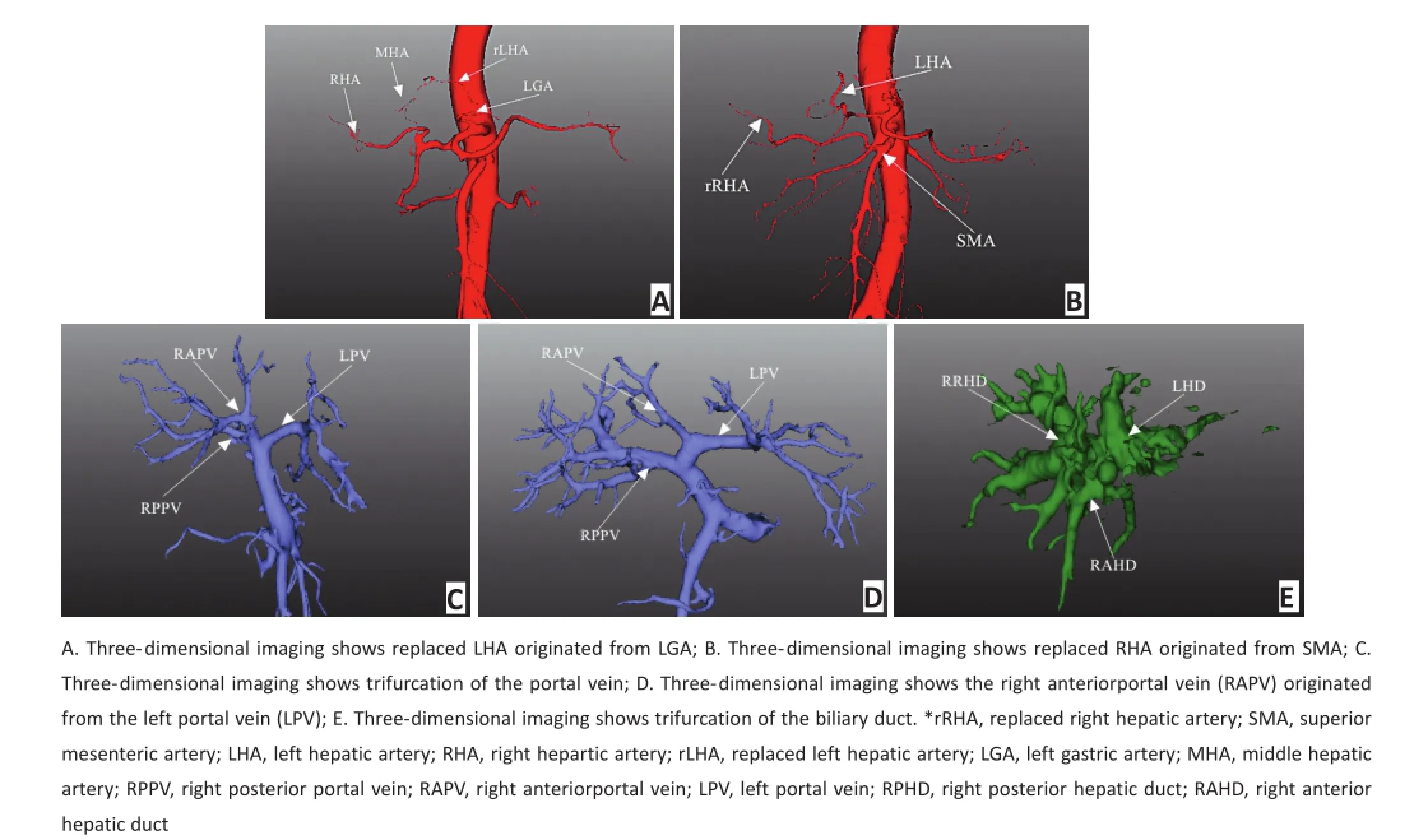
图1 三维重建显示肝门部解剖变异Figure1 Three‐dimensional imaging reconstruction shows the anatomical variation of hepatic hilum

图21 例Ⅲa型患者资料Figure2 Data of one patient with Bismuth‐Corlette type IIIa
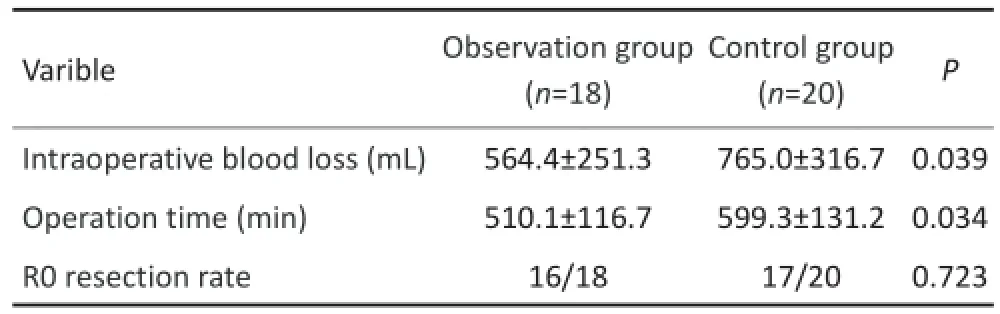
表2 两组患者手术情况比较Table2 Comparison of the operative parameters between the two groups
3 讨论
根治性手术切除是HCCA患者治愈和获得长期生存的首选治疗方式[11],但迄今为止根治性HCCA手术仍是外科学具有挑战性的难题。要提高R0切除率,术前需对肿瘤进展范围、肝门区脉管解剖、预留肝脏体积等进行精准评估。传统二维影像方法需要外科医生在大脑中进行“空间重建”,该过程常因不同医生的经验差异而产生不同程度偏差。通过3D技术将癌灶浸润范围和肝门部解剖精确标定在个体化肝脏三维构象中,在HCCA术前进行精准评估,很好地体现了“精准胆道外科”理念[12]。
纵向进展评估以往是以直接胆道造影作为“金标准”,准确率可达到90%以上[13],但因有创性及诱发胆管炎风险限制其在临床上的广泛应用,本研究观察组评估准确率88.9%;通过3D技术可以在近乎无创下任意角度观察胆管系统,特别是其特有90°头侧视野可以有效防止胆管遮挡问题,在纵向评估方面达到近似胆道造影的准确率。在垂直方向评估上,据统计多排CT对右肝动脉侵犯评估准确率达到94.4%,门静脉评估准确率达到87%[14]。本研究中虽然观察组准确率要高于对照组,但是差异无统计学意义,在肿瘤进展评估方面3D技术虽然增加了直观性,但目前在还原组织结构亚微观水平细节相比二维诊断方法并未获得质的飞跃,如肿瘤血管侵犯情况,手术医生对肿瘤侵犯血管具体层次了解,术中能否将其从血管外膜可靠剥离,目前影像及3D技术均不具备完整描绘细节的精度。
Saito等[15]指出术前明确肝门解剖变异,有助于避免术中损伤肝脏脉管。据统计肝动脉、门静脉、胆管变异概率分别为21%、17%、32%[16]。术前判断肝门部脉管解剖分型对手术决策非常重要,如本研究中发现MichelsⅢ型肝动脉病例有如下解剖特点:替代右肝动脉起始位置较低且深,廓清时可能将其误认为门静脉右侧肿大的淋巴结或神经束;因替代肝右动脉是供应右肝唯一的动脉,误伤后将会造成右肝及肝内胆道的缺血,甚至肝脓肿的形成;而门静脉C型变异,即门静脉右前支直接发自门静脉主干,而门静脉右后支汇入门静脉左支。在这种变异存在时,右半肝切除时,必须分离出门静脉左支和右前支,将门静脉左支置带保护后,才可以切断门静脉右前支。
Endo等[17]指出,尽管CT、MRI肿瘤进展评估准确性有了很大提高,手术有效性并没有随之获得改善,其中不可忽视的原因是通过断层影像很难辨识出肝门区解剖结构,而3D技术在该方面显示出极大的优越性。我们有以下体会:在术前已明确患者个体化解剖信息的情况下,手术分离过程中将会遇到哪支血管,是否可以结扎或必须保留均会心中有数,手术进度就会加快,发生误损伤、出血的概率也会很低。
准确计算剩余肝脏体积对于确保肝切除手术安全至关重要。相对于常规CT或MRI积分测量方法不易完成分段肝体积测量,而3D技术可以通过门脉流域算法精准测出各肝段体积,而且与术后实际情况具有高相关性,精准肝体积的测量为实现精准肝切除提供了可靠的保证。
在3D技术下可以进行虚拟仿真手术,应用切割功能进行虚拟肝脏切线设计,在仿真切肝的同时显示出该方案的残余肝脏体积,以及断面的胆管、血管信息。根据残余肝脏体积我们可以选择应用术前预处理手段如减黄、PVE等手段等提高切肝安全性;而断面胆管信息可以指导进行胆管重建技术,由于肝内胆管不同的汇合方式,断面常存在数支胆管,术前预判可以减少术后胆瘘发生的可能性,同时测算各胆管残端的距离,如果距离较近,为减少吻合口数目,可将邻近胆管整形缝合形成共同开口再与空肠进行吻合;最后根据断面血管信息,如该血管是必须保留的,那么就可以在术前做好充分的血管重建准备基础上,术中从容地进行血管切除重建,从而保证了入、出肝血管结构的完整性。
3D技术可以精准定位病灶累及范围,直观显示肝门部脉管解剖,为术前精确诊断、手术安全保障提供了有力的支持。相信在不远的将来,3D技术将会成为HCCA精准术前评估的“利器”。
[1]Huang ZQ.Hilar cholangiocarcinoma[J].Chinese Journal of Digestive Surgery,2013,12(3):166‐169.[黄志强.肝门部胆管癌[J].中华消化外科杂志,2013,12(3):166‐169.]
[2]Chinese anti‐cancer association of China.Guideline for the diagnosis and therapy of hilar cholangiocarcinoma(2015)[J].Chinese Journal of Hepatobiliary Surgery,2015,21(8):505‐511.[中国抗癌协会.肝门部胆管癌规范化诊治专家共识(2015)[J].中华肝胆外科杂志,2015,21 (8)505‐511.]
[3]Goenka MK,Goenka U.Palliation:Hilarcholangiocarcinoma[J].World Journal of Hepatology,2014,6(8):559‐569.
[4]Zeng N,Fang CH,Fan YF,et al.The construction of three‐dimensional visualization platform and its application in diagnosis and treatment for hilar cholangiocarcinoma[J].Chin J Surg,2016,54(9):680‐685.[曾宁,方驰华,范应方,等.肝门部胆管癌三维可视化精准诊疗平台构建及临床应用[J].中华外科杂志,2016,54(9):680‐685.]
[5]Department of surgery Chinese Medical Association.Diagnosis and treatment of hilar cholangiocarcinoma healing guide(2013 Edition)[J]. ChinJ Surg,2013,51(10):865‐871.[中华医学会外科学分会胆道外科学组.肝门部胆管癌诊断和治疗指南(2013版)[J].中华外科杂志,2013, 51(10).]
[6]Chinese Society of Digital Medicine.Complex three‐dimensional vi‐sualization of liver cancer expert consensus[J].Chinese journal of Practical Surgery,2017,37(1):53‐59.[中华医学会数字医学分会.复杂性肝脏肿瘤三维可视化精准专家共识[J].中国实用外科杂志,2017, 37(1):53‐59.]
[7]Baek SY,SheaforDH,Keogan MT,et al.Two‐dimensional multiplanar and three‐dimensional volume‐rendered vascular CT in pancreatic carcinoma:interobserver agreement and comparison with standard helical techniques[J].AJR AmJ Roentgenol,2012,176(176):1467‐1473.
[8]Blumgart LH.Surgery of the liver,biliary tract,and pancreas(4th edition)[M].2006:16‐21.
[9]Cheng YF,Huang TL,Lee TY,et al.Variation of the intrahepatic portal vein;angiographic demonstration and application in living‐related hepatic transplantation[J].Transplant Proc,1996,28(3):1667‐8.
[10]Fang CH.Digital hepatic surgery[M].Beijing:People's Military Medical Press,2014:139‐162.[方驰华.数字化肝脏外科学[M].北京:人民军医出版社,2014:139‐162.]
[11]Weiss MJ,Cosgrove D,Herman JM,et al.Multimodal treatment‐strategies for advanced hilarcholangiocarcinoma[J].Langenbecks Ach Surg,2014,399(6):679‐692.
[12]Dong JH,Ye S.Continuous improvement of curative effect of hilar cholangiocarcinoma by precise liver surgical technique[J/OL].Chin J Oper Proc Gen Surg(Electronic Edition),2015,9(5):1‐4.[董家鸿,叶晟.不断提高肝门部胆管癌切除的精准化水平[J].中华普外科手术学杂志电子版,2015,9(5):1‐4.]
[13]Reitz S,Slam K,Chambers LW.Biliary,pancreatic,and hepatic imaging for the general surgeon[J].Surg Clin North Am,2011,91(1):59‐92.
[14]Okumoto T,Sato A,Yamada T,et al.Correct diagnosis of vascular en‐casement and longitudinal extension of hilarcholangiocarcinoma by four‐channel multidetector‐row computed tomography[J].Tohoku J Exp Med,2009,217(217):1‐8.
[15]Saito S,Yamanaka J,Miura K,et al.A novel 3D hepatectomy simulation based on liver circulation:application to liver resection and trans‐plantation[J].Hepatology,2005,41(6):1297‐1304.
[16]Radtke A,Nadalin S,Sotiropoulos GC,et al.Computer‐Assisted op‐erative planning in adult living donor liver transplantation:a new way to resolve the dilemma of the middle hepatic vein[J].World J Surg, 2007,31(1):175‐185.
[17]Endo I,Shimada H,Sugita M,et al.Role of three‐dimensional imaging in operative planning for hilar cholangiocarcinoma[J].Surgery,2007, 142(5):666‐675.
(2016‐10‐27收稿)
(2017‐03‐19修回)
Application of three-dimensional visualization technology in preoperative assessment of hilar cholangiocarcinoma
Fan YU,Zheng LU
Department of Hepatobiliary Surgery,The First Affiliated Hospital of Bengbu Medical College,Bengbu 233000,China
Zheng LU;E‐mail:luzhengdr@163.com
Objective:To investigate the application of three‐dimensional visualization technology in preoperative assessment of hilar cholangiocarcinoma.Methods:Thirty‐eight patients with hilar cholangiocarcinoma who underwent surgery from March 2014 to April 2016 were enrolled in the retrospective study.Among the cases,an observational group of 18 patients had preoperative three‐dimensional visualization surgical planning,while a control group of 20 patients did not have the visualization surgical plan.The preoperative diagnostic results were analyzed with the actual intraoperative findings.Related surgicall indicators between the two groups were compared.Results: No significant difference in the accuracy rates of longitudinal and vertical infiltration of cholangiocarcinoma between was observed the observational group and control group.While the vascular and ductal branching pattern of all patients are consistent with intraoperative findings,the coincidence rate was higher in the observational group than that in the control group(100%vs.70%,P<0.05).The estimated liver volumes were also exactly consistent with the actual liver volume(r=0.986,P<0.001).In comparison with the control group,the average intraoperative blood loss and operative time of the observational group were significantly lower.However,the potential curative resection between the two groups exhibited no significant difference.Conclusion:Three‐dimensional visualization technology can accurately complete the preoperative evaluation of hilarcholangiocarcinoma.
computer‐assisted three‐dimensional imaging,preoperative assessment,hilar cholangiocarcinoma

10.3969/j.issn.1000-8179.2017.08.249
余璠专业方向为肝门部胆管癌外科综合治疗。E-mail:yufan110664@163.com
蚌埠医学院第一附属医院肝胆外科(蚌埠市233000)
*本文课题受安徽省科技攻关项目(编号:1604a0802088)资助
鲁正luzhengdr@163.com
This work was supported by the Anhui Science and Technology Project(No.1604a0802088)
