LETM2在食管鳞癌中的表达及其作用*
2017-05-17胡晓玲翟元芳毕炀辉程彩霞孔鹏洲
胡晓玲 翟元芳 杨 洁 王 娟 毕炀辉 杨 斌③ 程彩霞④ 宋 彬⑤ 张 玲 孔鹏洲
·基础研究·
LETM2在食管鳞癌中的表达及其作用*
胡晓玲①②翟元芳②杨 洁②王 娟②毕炀辉②杨 斌②③程彩霞②④宋 彬②⑤张 玲②孔鹏洲②
目的:探讨LETM2在食管鳞癌(esophageal squamous cell carcinoma,ESCC)中的表达,研究LETM2对ESCC细胞系KYSE150和ECA109增殖和侵袭迁移的影响。方法:免疫组化(immunohistochemistry,IHC)检测90例ESCC及癌旁组织LETM2蛋白表达差异,RT-PCR和Western blot检测ESCC细胞系LETM2表达情况,慢病毒敲低KYSE150和ECA109细胞中LETM2表达。MTT和克隆形成技术检测LETM2对ESCC细胞增殖和克隆形成能力的影响,流式细胞术检测细胞周期变化,Transwell法分析LETM2敲低后细胞迁移侵袭能力的差异。结果:在ESCC组织中LETM2的表达显著高于癌旁组织,LETM2通过抑制ESCC细胞G1期向S期转化进而抑制细胞增殖,但对侵袭和迁移能力影响不大。结论:LETM2可能作为驱动基因促进ESCC的发生发展,是ESCC的关键遗传变异,可能作为ESCC早诊早治的分子标志物。
食管鳞癌LETM2增殖侵袭迁移细胞周期
我国是全球范围内食管癌高发区之一,发病率居于第8,死亡率位于第6[1]。组织学类型主要以鳞癌为主,世界上约70%的食管鳞癌(esophageal squa⁃mous cell carcinoma,ESCC)发生在我国[2-3]。由于早期ESCC缺乏特异性症状和诊断指标,发现时往往已经是中晚期,预后极差,目前我国ESCC的5年生存率仅为15%~25%[4-5]。因此,找到ESCC发生发展的相关遗传变异因素,寻找早期诊断的肿瘤标志物对提高ESCC的临床预后具有重要意义。
本课题组前期对收集的山西省肿瘤医院31例ESCC病例进行全基因组测序,发现LETM2(leucine zipper-EF-hand containing transmembrane protein 2,LETM2)基因所在区域存在拷贝数扩增。LETM2定位于染色体8p11.23,属于线粒体蛋白,主要在精母细胞和精子中表达[6]。然而对LETM2在ESCC中的表达及其功能尚无研究报道。本文研究结果显示,与正常组织相比,LETM2在ESCC组织中高表达,在LETM2表达较高的食管鳞癌细胞KYSE150和ECA109细胞系敲低LETM2后显著抑制细胞生长,而细胞侵袭迁移能力变化不大,提示在ESCC的发生发展过程中,LETM2可能起促进作用。
1 材料与方法
1.1 材料
人ESCC细胞株KYSE150、ECA109、EC9706由中国工程院詹启敏院士馈赠,TE-1、KYSE180、KYSE140、KYSE510、KYSE410均购自中科院上海细胞库。90例人ESCC组织和癌旁组织取自2011年至2014年在山西省肿瘤医院手术患者。所取标本均提前和患者及/或家属进行沟通,在征得患者及/或家属同意并签署《知情同意书》后再进行取材。实验所需RMPI 1640培养液和新生胎牛血清购自美国Hyclone公司,质粒抽提试剂盒购自美国Qiagen公司。所用质粒Plko.1-puro-shRNA-LETM2由美国普尔普乐公司合成。PMDG、PAPSX质粒均由本室保存。RNA提取所用试剂及PCR试剂盒由美国Takala公司提供,由上海生工合成所用引物。兔抗人LETM2抗体购自美国Abclam公司,羊抗兔二抗购自武汉三鹰公司。Western blot所用试剂购自美国Sigma公司。
1.2 方法
1.2.1 免疫组织化学法①切片常规脱蜡;②3% H2O215 min阻断内源性过氧化物酶;③抗原暴露;④4℃孵育过夜;⑤复温1 h;⑥二抗37℃孵育20 min;⑦DAB显色;⑧将细胞核用苏木素复染,盐酸酒精分化多余苏木素,氨水返蓝;⑨梯度酒精和二甲苯脱水;⑩中性树胶封片,显微镜下观察结果。
1.2.2 细胞培养采用含10%胎牛血清的RMPI 1640培养液培养KYSE150和ECA109细胞,置于5% CO2孵箱37℃培养,根据细胞状态更换培养液,当细胞长到80%~90%融合度时进行传代。
1.2.3 慢病毒感染HEK-293细胞转染前一天接种于6孔板,第二天细胞长到70%融合度时,将Plko.1-puro-GFP-shRNA-LETM2、PMDG、PAPSX三种质粒按1:2:1共8 μg与Lipofectamine2000 16 μL混合转染,48~72 h收集上清,过滤后加到贴壁培养的KYSE150和ECA109细胞中。感染48 h后加入嘌呤霉素筛选获得稳定敲除LETM2的KYSE150和ECA109细胞系,命名为LETM2sh1和LETM2sh2,阴性对照则转染无意义乱码序列,命名为NC。敲低序列LETM2-sh1:5'-CGCACCTTC⁃TACCTGATAGAT-3'和LETM2-sh2:5'-CCAGTTA⁃CATCATCACCCATA-3'。
1.2.4 实时定量PCR(real-time polymerase chain re⁃action,RT-PCR)收集细胞沉淀,RNA提取后逆转录为cDNA,再进行PCR扩增。反应体系为25 μL,SYBR®Premix Ex TaqTM(2×)12.5 μL,Primer(10 μM)1 μL,ROX Reference Dye II(50×)0.5 μL,cDNA 1μL,ddH2O 10.5 μL,根据Genebank中LEMT2序列及GAP⁃DH序列,设计PCR特异性扩增引物。序列如下:LETM2上游引物:5'-GGAGGGGTTCTTGCACTACT-3',下游引物:5’-GAATTGATGCAACCTGGCCA-3'。GAPDH上游引物:5'-CAGCCTCAAGATCATCAGCA-3',下游引物:5'-GTCTTCTGGGTGGCAGTGAT-3'。
1.2.5 蛋白质印迹法(Western blot)①胰酶消化;②收集细胞;③裂解液冰上裂解;④离心收集上清;⑤Bradford法测蛋白浓度;⑥SDS-PAGE凝胶电泳;⑦恒压8 V转膜过夜;⑧5%脱脂奶粉封闭;⑨一抗二抗孵育;⑩显影并进行分析。
1.2.6MTT取96孔板将各组细胞用0.25%胰酶消化,离心,计数后接种,5×103个细胞/孔,每孔加200 μL 10%FBS培养基,于24、48、72、96、120 h后每孔加入20 μL MTT(5 mg/ml),37℃孵箱孵育4 h后每孔加入200 μL DMSO,振荡15 min后在490 nm吸光度下检测光密度值。
1.2.7 克隆形成实验取6孔板接种相应各组细胞,5×102个/孔,每孔加2 mL培养基,14~20天后,PBS清洗后用4%多聚甲醛进行固定,0.1%结晶紫染色,计数有效克隆(≥50个细胞)。
1.2.8Transwell实验将相应各组细胞0.25%胰酶消化,计数后Transwell小室上室内加5×104个细胞/孔,200 μL基础培养基,下室加600 μL 10%FBS完全培养基,24 h后4%多聚甲醛固定,0.1%结晶紫染色,观察穿过上室下层薄膜的细胞并计数拍照。
1.2.9 流式细胞术细胞PBS洗涤,胰酶消化,收集沉淀,70%冰乙醇固定,去除乙醇,0.01%DNase-free RNase A 37℃处理10 min,0.05%PI 4℃染色20 min。应用FACSCalibur流式细胞分析仪分析细胞周期。
1.3 统计学方法
数据处理采用SPSS 18.0软件分析,所有实验数据均以x±s表示,秩和检验应用于LETM2在ESCC组织和癌旁组织表达情况比较,其他实验数据两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 在ESCC组织中LETM2表达高于正常组织
利用免疫组织化学法检测ESCC组织芯片中ES⁃CC组织与癌旁组织LETM2蛋白表达情况,发现ES⁃CC组织中LETM2表达高于癌旁组织,差异具有统计学意义(图1,P<0.05)。
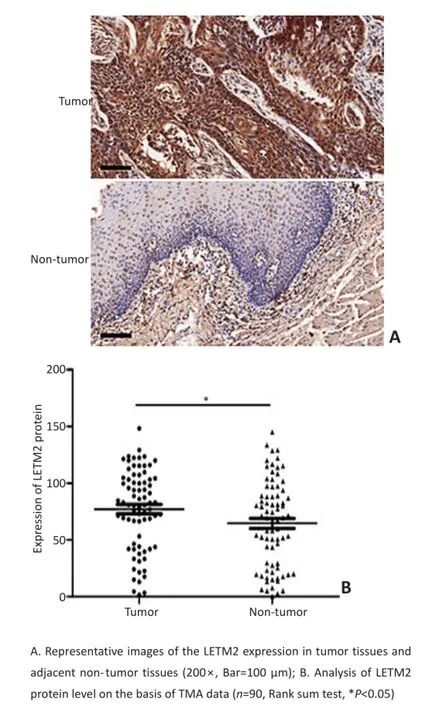
图1 在ESCC组织中LETM2表达高于相邻正常组织Figure1 LETM2 was frequently upregulated in the ESCC tissues than in the adjacent non‐tumor tissues
2.2 在KYSE150和ECA109敲除LETM2成功
RT-PCR和Western blot比较食管鳞癌细胞株KYSE150、ECA109、EC9706、TE-1、KYSE180、KYSE140、KYSE510和KYSR410中LETM2表达量,选择LETM2表达量比较高的KYSE150和ECA109用于行敲除实验。RT-PCR和Western blot实验结果显示在KYSE150和ECA109采用慢病毒转染Plko.1-puro-shRNA-LETM2后,LETM2基因表达与NC组相比明显降低(图2)。
2.3LETM2对ESCC细胞增殖的影响
经MTT法检测结果显示,与对照组相比,敲低LETM2后,KYSE150和ECA109细胞增殖能力明显降低,在48、72、96、120 h差异均有统计学意义(图3A)。
克隆形成实验显示在KYSE150和ECA109细胞敲低LETM2后,与对照组相比形成克隆数下降,差异具有统计学意义(图3B)。
2.4LETM2对ESCC细胞侵袭迁移的影响
细胞迁移和侵袭实验结果显示,敲低LETM2后,KYSE150和ECA109细胞侵袭迁移能力虽有所降低,但差异无统计学意义。
2.5LETM2对ESCC细胞周期的影响
采用流式细胞技术检测LETM2是否通过改变ESCC细胞周期而影响细胞增殖。结果显示在KYSE150和ECA109细胞敲低LETM2后,与对照组相比,G1期上升,S期下降,差异具有统计学意义(表1)。
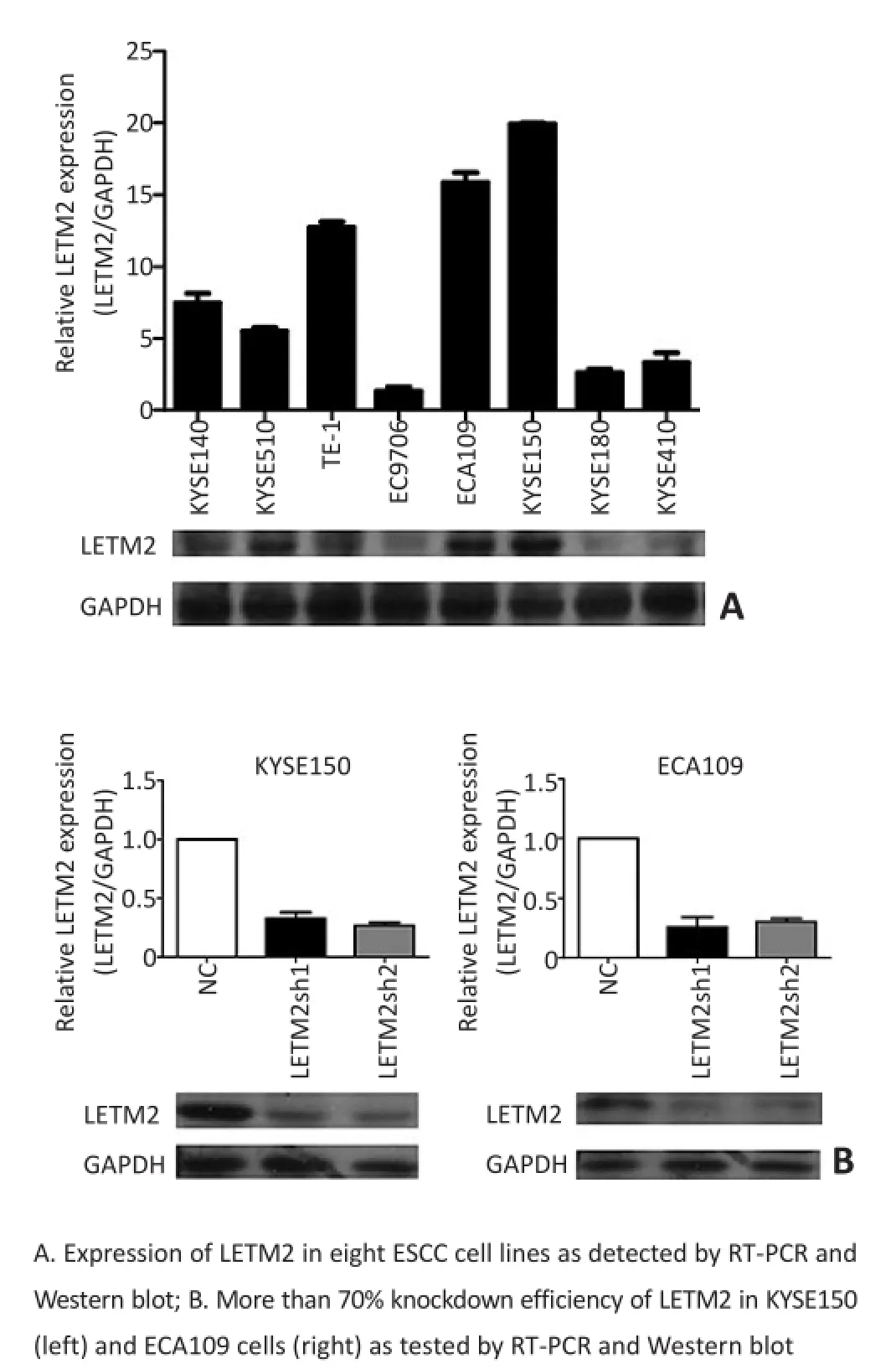
图2 在KYSE150和ECA109敲除LETM2成功Figure2 Effective knockdown of LETM2 in KYSE150 and ECA109 cell lines
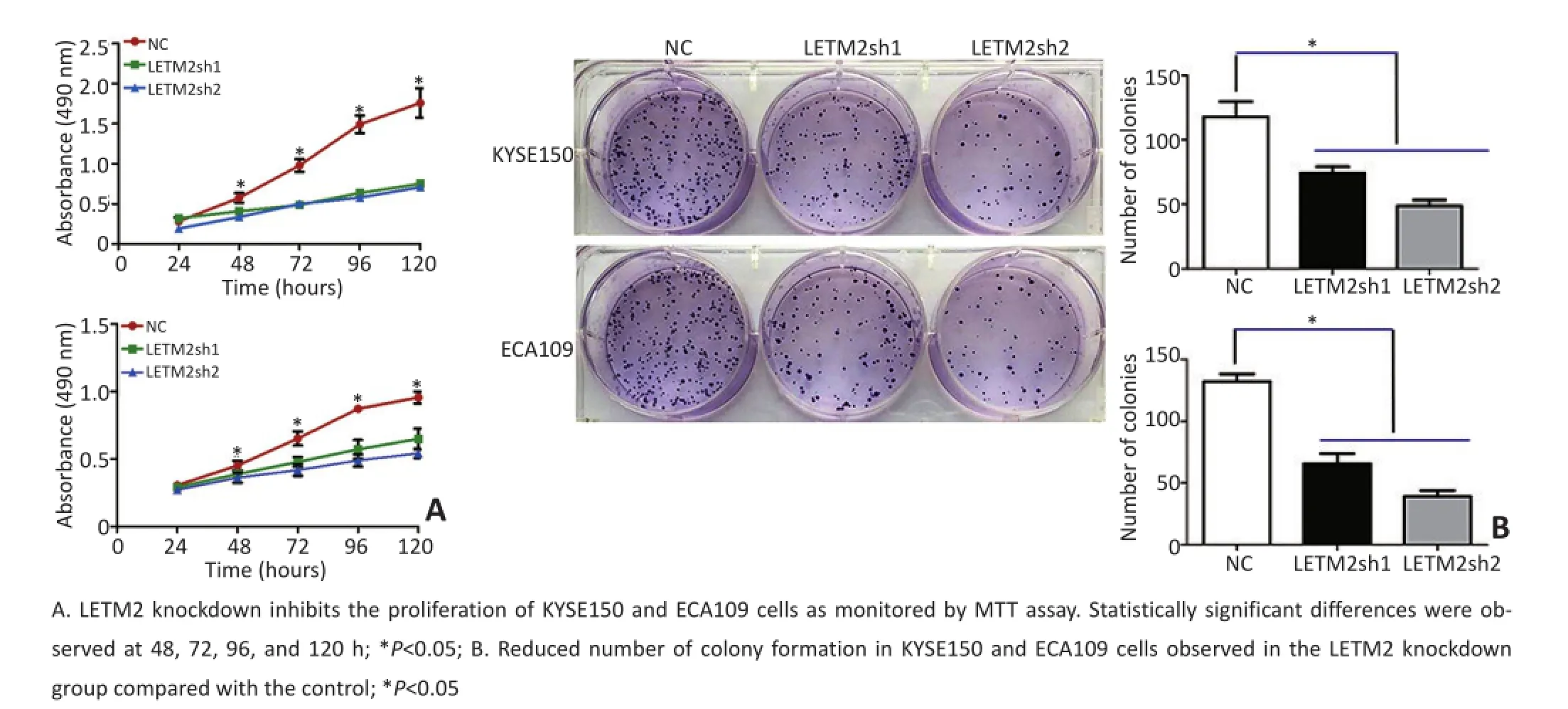
图3 敲低LETM2抑制ESCC细胞增殖和克隆形成Figure3 Inhibition of ESCC cell growth and colony formation by the LETM2 knockdown
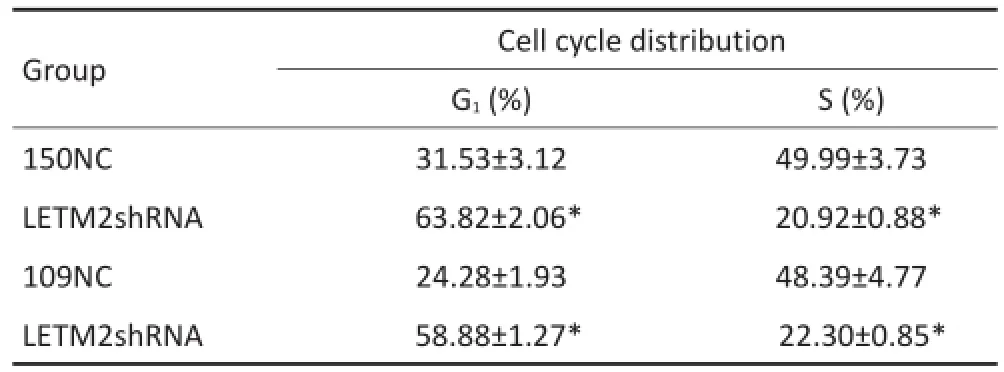
表1 在KYSE150和ECA109细胞敲除LETM2后细胞周期检测Table1 Cell cycle distribution of LETM2 knockdown in KYSE150 and ECA109 cells
3 讨论
肿瘤与遗传因素间的关系逐渐被人们重视,基因组技术的不断发展给相关研究带来了契机。随着第二代测序技术的发展和完善,肿瘤基因组学研究有了质的突破,由原来的假说为导向转变为以数据为导向的研究,能够客观地反映在疾病发生进展过程中组学层面所发生的变化。而且,第二代测序技术具有高通量、“一揽子”的优点,可能发现全新的肿瘤相关遗传变异和分子信号通路。
本课题组对前期收集的31例食管鳞癌病例进行全基因组测序,找到了与食管鳞癌相关的基因组序列组成与结构的变化,包括单核苷酸变异(single nucleotide variation,SNV)、插入与缺失(insertion and deletion,Indels)、结构变异(structure variation,SV)和拷贝数变化(copy number variation,CNV)等。Meerkat方法分析了全基因组测序数据发现ESCC基因组局部区域存在扩增现象,LETM2所在区域即为其中之一[7]。
LETM2即亮氨酸拉链EF-hand结构域跨膜蛋白2,是最近新发现的定位于线粒体内膜的在酵母和人类之间高度保守的蛋白。线粒体功能的正常是细胞保持正常生理活动所必需,其功能紊乱会引起癌症等疾病发生[6]。线粒体功能紊乱可以影响癌细胞的生长、凋亡和能量代谢,目前对LEMT2的研究甚少,只有Dutt等[6]曾报道其在非小细胞肺癌存在扩增。目前对LETM1的研究相对较多,LETM1最先被发现可以诱发沃尔夫综合征(Wolf-Hirschhorn Syn⁃drome),并且与癫痫的发病相关[8-10]。近期有研究表明,在宫颈癌中LEMT1表达增加可抑制细胞凋亡,可能通过激活PI3K-Akt信号通路来促进肿瘤发生发展[11]。另有研究发现,在肝癌的发生发展过程中LEMT1发挥重要作用,可能作为肝癌分子治疗靶点[12-13]。在乳腺癌、结肠癌、肺癌、卵巢癌均存在LETM1高表达现象,并且与乳腺癌临床特征和生存期存在相关性[14-16]。作为LEMT1类似物,本文通过全基因组测序发现LEMT2在ESCC组织中存在拷贝数扩增,免疫组织化学结果发现LEMT2在ESCC中显著高表达,提示在ESCC的发生进展过程中LETM2发挥关键作用。在LEMT2高表达的食管鳞癌细胞系敲低LEMT2后,抑制细胞G1期向S期转化进而抑制细胞增殖和克隆形成,但对侵袭迁移影响不大。
因此,LEMT2在ESCC发生发展中可能作为驱动基因进而影响ESCC进程,但对于其在ESCC发展中的具体分子机制还需在后续的研究中进一步探讨。
[1]Wheeler JB,Reed CE.Epidemiology of esophageal cancer[J].Surg Clin North Am,2012,92(5):1077‐1087.
[2]Tran GD,Sun XD,Abnet CC,et al.Prospective study of risk factorsfor esophageal and gastric cancers in the Linxian general popula‐tion trial cohort in China[J].Int J Cancer,2005,113(3):456‐463.
[3]Pennathur A,Gibson MK,Jobe BA,et al.Oesophageal carcinoma [J].Lancet,2013,381(9864):400‐412.
[4]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12): 2893‐2917.
[5]Enzinger PC,Mayer RJ.Esophageal cancer[J].N Engl J Med,2003, 349(23):2241‐2252.
[6]Dutt A,Ramos AH,Hammerman PS,et al.Inhibitor‐sensitive FGFR1 amplification in human non‐small cell lung cancer[J].PLoS One, 2011,6(6):e20351.
[7]Cheng C,Zhou Y,Li H,et al.Whole‐genome sequencing reveals di‐verse models of structural variations in esophageal squamous cell carcinoma[J].Am J Hum Genet,2016,98(2):256‐274.
[8]Endele S,Fuhry M,Pak SJ,et al.LETM1,a novel gene encoding a putative EF‐hand Ca(+)‐binding protein,flanks the Wolf‐Hirschhorn syndrome(WHS)critical region and is deleted in most WHS pa‐tients[J].Genomics,1999,60(2):218‐225.
[9]Shao J,Fu Z,Ji Y,et al.Leucine zipper‐EF‐hand containing trans‐membrane protein 1(LETM1)forms a Ca2+/H+antiporter[J].Sci Rep, 2016,27(6):34174.
[10]Yang WX,Pan H,Li L,et al.Analyses of genotypes and phenotypes of ten chinese patients with wolf‐hirschhorn syndrome by multi‐plex ligation‐dependent probe amplification and array comparative genomic hybridization[J].Chin Med J(Engl),2016,129(6):672‐628.
[11]Gao A,Piao L.Clinical significance of LETM1 protein expression in colonic cancer[J].World Chinese Journal of Digestology,2014,22( 5):718‐723.[高爱花,朴龙镇.LETM1蛋白在结肠癌组织中表达及临床意义[J].世界华人消化杂志,2014,22(5):718‐723.]
[12]Zhou B,Jiang N,Liao R,et al.Expression of LETM1 in hepatocellular carcinoma and its effect on proliferation and apoptosis in hepato‐cellular carcinoma cell line SMMC‐7721[J].Acta Acad Med Mil Tert, 2016,38(17):1942‐1947.[周宝勇,蒋宁,廖锐,等.LETM1在肝癌中的表达及其对SMMC‐7721细胞增殖和凋亡的影响[J].第三军医大学学报,2016,38(17):1942‐1947.]
[13]Lee YY,McKinney KQ,Ghosh S,et al.Subcellular tissue proteomics of hepatocellular carcinoma for molecular signature discovery[J].J Proteome Res,2011,10(11):5070‐5083.
[14]Piao L,Li Y,Kim SJ,et al.Association of LETM1 and MRPL36 contrib‐utes to the regulation of mitochondrial ATP production and necrot‐ic cell death[J].Cancer Res,2009,69(8):3397‐3404.
[15]Li N,Zheng Y,Xuan C,et al.LETM1 overexpression is correlated with the clinical features and survival outcome of breast cancer[J]. Int J Clin Exp Pathol,2015,8(10):12893‐12900.
[16]Wang CA,Liu Q,Chen Y,et al.Clinical implication of leucine zipper/ EF hand‐containing transmembrane‐1 overexpression in the prog‐nosis of triple‐negative breast cancer[J].Exp Mol Pathol,2015,98 (2):254‐259.
(2016‐12‐23收稿)
(2017‐04‐07修回)
Expression and function of LETM2 in esophageal squamous carcinoma
Xiaoling HU1,2,Yuanfang ZHAI2,Jie YANG2,Juan WANG2,Yanghui BI2,Bin YANG2,3,Caixia CHENG2,4,Bin SONG2,5,Ling ZHANG2,Pengzhou KONG2
1Department of Pharmacology,2Translational Medicine Research Center,Key Laboratory of Cellular Physiology,Ministry of Education, Shanxi Medical University,Taiyuan 030001 China;3Department of General Surgery,Shanxi Provincial Cancer Hospital,Taiyuan 030013, China;4Department of Pathology,5Department of Oncology,The First Hospital,Shanxi Medical Univesity,Taiyuan 030001,China
Pengzhou KONG;E‐mail:kongpzh@163.com
Objective:To analyze the expression of LETM2 in KYSE150 and ECA109 cell lines and its effect on the proliferation,migra‐tion,and invasion of esophageal squamous cell carcinoma(ESCC).Methods:The expression level of the LETM2 protein in 90 paired hu‐man ESCC tissues and matched adjacent normal tissues was determined through immunohistochemistry.The expression level of LETM2 in ESCC cell lines was detected by real‐time PCR and Western blot.The expression levels of LETM2 in KYSE150 and ECA109 cell lines were knocked down using lentivirus.MTT assays were performed to examine the effect of LETM2 on the proliferation of ESCC cells.Colony formation assay was used to detect the colony formation ability.Flow cytometry was performed to analyze the cell cycle. The effect of LETM2 depletion on the migration and invasion of ESCC cells was determined by Transwell assay.Results:LETM2 expres‐sion was frequently upregulated in the ESCC tissues than in the adjacent normal tissues.The suppressed exogenous expression of LETM2 led to the inhibition of cell proliferation and colony formation.However,cell migration and invasion were not affected.The re‐sults on the cell cycle distribution revealed that LETM2 knockdown acts as a negative regulator of the cell cycle at the G1to S phase transition.Conclusion:LETM2 acts as a tumor‐driven gene in the development and progression of ESCC.This finding suggests that LETM2 can be used as an efficient prognosis biomarker and a potential therapeutic target for ESCC.
ESCC,LETM2,proliferation,invasion,migration,cell cycle

10.3969/j.issn.1000-8179.2017.08.460
①山西医科大学基础医学院药理教研室(太原市030001);②转化医学研究中心细胞生理学省部共建教育部重点实验室;③山西省肿瘤医院;④山西医科大学第一医院病理科;⑤山西医科大学第一医院肿瘤内科
*本文课题受国家自然科学基金项目(编号:81502135),山西医科大学博士启动基金(编号:03201006),山西医科大学青年基金(编号:057487)资助
孔鹏洲kongpzh@163.com
胡晓玲专业方向为肿瘤病因学。
E-mail:hxl0351@163.com
