抑瘤素M通过诱导衰老抑制肝癌细胞增殖*
2017-05-17张艳艳吴国珍焦晓磊李雅玥高英堂朱争艳杨斌
张艳艳 骆 莹 吴国珍 王 鹏 焦晓磊 李雅玥 高英堂 朱争艳 杨斌
抑瘤素M通过诱导衰老抑制肝癌细胞增殖*
张艳艳①骆 莹②③④吴国珍①王 鹏②③④焦晓磊②③④李雅玥②③④高英堂②③④朱争艳②③④杨斌②③④
目的:通过分析抑瘤素M(oncostatin M,OSM)对肝癌细胞生长的效应,研究其影响细胞增殖的分子机制。方法:OSM处理SMMC-7721和HepG2肝癌细胞系,观察细胞的增殖速率和形态变化,结合特异性β-半乳糖苷酶染色和细胞周期分析,研究OSM是否通过诱导肝癌细胞进入衰老状态来抑制其增殖;进一步通过监测细胞周期抑制蛋白p16、p21、p27和癌基因c-Myc的表达变化,分析OSM诱导细胞衰老的原因。结果:OSM可以抑制肝癌细胞系生长,且抑制率呈现一定剂量依赖性;细胞形态变化和β-半乳糖苷酶染色进一步证实OSM可诱导细胞衰老。细胞周期分析表明OSM阻滞肝癌细胞于G0/G1期,并伴随p21和p27周期抑制蛋白的表达增高。最后,通过分析STAT3信号途径下游癌基因c-Myc的转录与蛋白水平,表明OSM可能是通过癌基因的激活而诱导细胞的衰老。结论:由癌基因激活而导致的细胞衰老,是机体的一种防御机制。OSM通过激活STAT3信号途径、上调癌基因c-Myc表达的同时,也加速了细胞的衰老,从而最终表现为对肝癌细胞增殖的抑制作用。
肝癌细胞抑瘤素M细胞衰老c-Myc增殖
抑瘤素M(oncostatin M,OSM)属于白细胞介素-6家族成员,是由活化的T淋巴细胞、单核细胞和巨噬细胞等分泌产生的一种多功能的细胞因子[1]。OSM最初是在黑色素瘤中被发现可以抑制肿瘤细胞生长并因此被命名,然而作为一种多功能的细胞因子,OSM在器官发育、组织损伤与再生等方面也起到重要的调控作用[2]。在分子途径上,OSM通过与细胞膜受体gp130结合,激活下游STAT3、MAPK和PI3K等多种信号通路[3-4]。因此在不同的环境下,OSM对细胞增殖或分化可能起着不同甚至完全相反的作用。已有研究报道,在肝癌发展的早期,血清中OSM含量增高,肝组织中的OSM受体表达也升高[5-6],然而这种OSM信号增强对肿瘤形成的具体作用亟需进一步研究。本研究主要通过体外实验研究OSM对肝癌细胞的效应和机制,并据此提出OSM对早期肝癌的形成可能具有抑制作用。
1 材料与方法
1.1 材料
1.1.1 临床资料2012年11月至2015年1月健康对照组和肝病患者88例均选自天津医科大学第三中心医院。其中健康对照组15例,年龄47(37~59)岁;乙型肝炎患者15例,年龄44(28~56)岁;肝硬化患者15例,年龄45(32~47)岁;肝癌患者43例,年龄54(30~71)岁。
1.1.2 主要试剂肝癌细胞系(SMMC-7721、HepG2)购自中国科学院上海生物化学研究所,用DMEM/F12(Gibco,美国)完全培养基,置于37℃、5% CO2培养箱内贴壁培养;主要试剂包括:胰酶(Gibco,美国);重组人抑瘤素M(Peprotech,美国);鼠抗人单克隆β-actin(sigma,美国);兔抗人单克隆p16、p21、p27和c-Myc抗体(Abcam,美国);羊抗鼠单克隆抗体、羊抗兔单克隆抗体(cell signal technology,美国);TriZol(Invitrogen,美国);HiFiScript cDNA第一链合成试剂盒、蛋白酶抑制剂混合物、RIPA裂解液、BCA蛋白定量试剂盒、蛋白示踪上样缓冲液(5×)、显影定影试剂盒(康为世纪,北京);PCR引物由北京曼特德曼生物科技有限公司合成。
1.2 方法
1.2.1 酶联免疫吸附实验用人OSM酶联免疫吸附测定试剂盒(Elabscience)检测血清。
1.2.2 细胞增殖实验将肝癌细胞系以5×103个/mL接种在96孔板中,置于培养箱中培养1 d后,加入不同浓度OSM(2.5、10、50 ng/mL)培养6 d,将其置于长时间动态观察仪(Incu Cyte Zoom,Essen BioScience,美国)中,每12 h拍照记录1次细胞汇合度,生成细胞生长曲线。
1.2.3 免疫印迹提取细胞总蛋白,BCA法测定蛋白浓度,取25 μg样品在十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)上进行变性电泳;湿法转膜后将PVDF膜置于5%脱脂奶粉封闭2 h,加一抗(1:1 000)后4℃过夜孵育,洗涤后加入相应的二抗(1:4 000),室温孵育1 h;采用ECL化学发光显色,经显影、定影后扫描条带。
1.2.4 细胞周期将肝癌细胞系以5×103个/mL接种在6孔板,待其24 h贴壁后,加入10 ng/mL OSM,放置在培养箱中培养6 d,并设置无药对照组。收集细胞,PBS洗2次,70%乙醇4℃过夜固定,然后弃乙醇,PBS洗3次,加入4 μL RNase和0.4 mL碘化丙啶混合液,轻轻吹打混匀细胞,避光染色20 min,流式细胞仪(BD,FACSCanto II,USA)检测细胞周期变化。
1.2.5RT-qPCRTRIzol法提取细胞总RNA,逆转录cDNA参照试剂使用说明书。荧光定量PCR反应在ViiATM7 96孔板上进行,扩增体系为25 μL,包含20 μL SYBR Green PCR master mix、1 μL Ex Taq HS、2 μL cDNA模板、正反向引物各1 μL,DEPC水补足至25 μL。反应条件为:95℃3 min预变性;72℃10 s、95℃15 s、60℃32 s,共40次循环;PCR引物序列如表1所示;数据分析用2-ΔΔT法比较表达差异。

表1RT-PCR引物序列Table1 Primer sequences of RT‐PCR
1.2.6 衰老相关-β半乳糖苷酶染色使用衰老相关-β半乳糖苷酶染色试剂盒(cell signal technology),将培养细胞以5×103个/mL接种在6孔板中,用10 ng/mL OSM处理细胞7 d后加入固定液,在室温下固定15 min。PBS冲洗培养板2次后,在每个培养孔中加入1 mL β-半乳糖苷酶染色液,干燥培养箱中37℃过夜孵育,显微镜下观察染色情况。
1.3 统计学分析
应用SPSS 17.0软件进行统计学分析。将各组数据分别进行正态分布检验。正态分布计量资料以x±s表示,两组间比较采用t检验,多组间比较采用方差分析。非正态分布计量资料以中位数和四分位数间距表示,多组间比较采用Kruskal-Wallis检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 ELISA测定血清中OSM浓度
利用多个独立样本Kruskal-Wallis检验发现各组之间差异具有统计学意义(P<0.001)。然后采用秩和检验进行两两之间比较,结果如图1所示:健康对照和乙型肝炎患者中的OSM水平无明显差异(P=0.852),而在肝硬化、肝癌患者中均显著升高(P<0.001)。表明血清中OSM升高在肝癌的进程中具有一定的阶段特异性。
2.2 OSM抑制肝癌细胞生长
为研究OSM对肝癌细胞的作用效应,首先用系列浓度(2.5、10.0、50.0 ng/mL)的OSM处理肝癌细胞系SMMC-7721和HepG2,连续观测6 d细胞生长情况,结果显示OSM可抑制细胞增殖,并呈一定剂量依赖性(图2)。
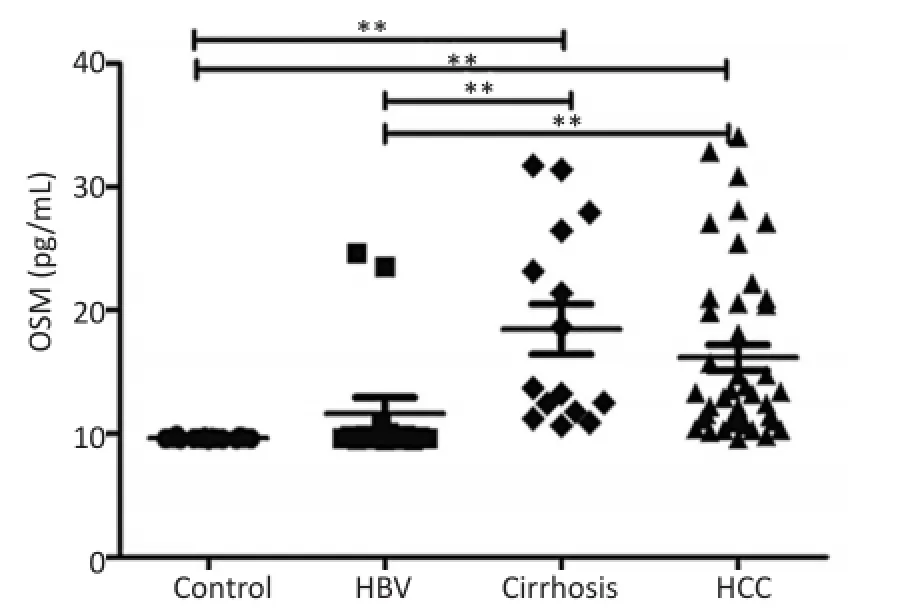
图1 不同类型肝病患者中血清OSM含量Figure1 OSM levels in the serum of patients with different liver diseases
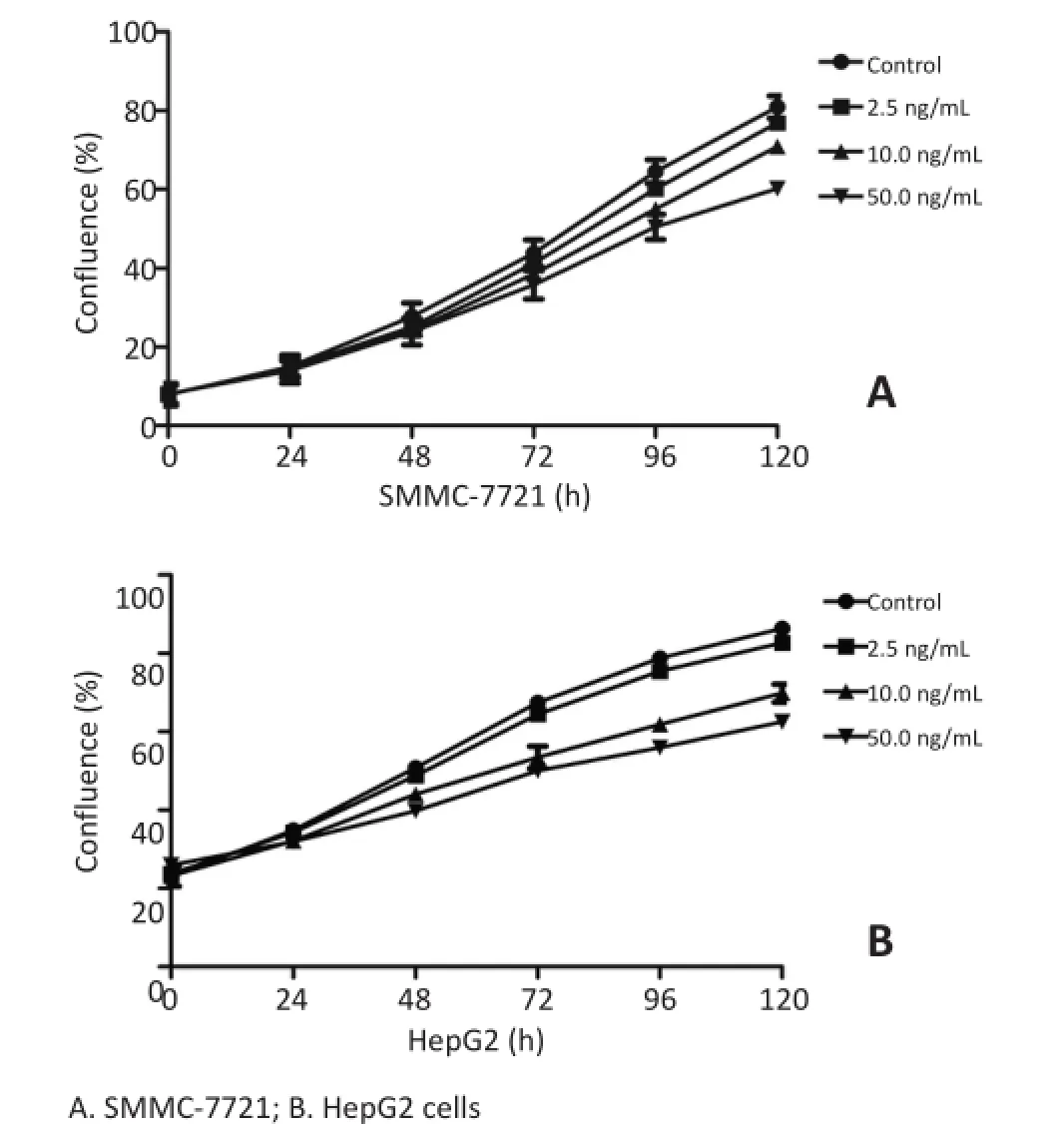
图2 OSM处理肝癌细胞系生长曲线Figure2 Growth curve of liver cancer cell lines treated with OSM
2.3 OSM诱导肝癌细胞衰老
在OSM抑制细胞增殖的同时,观察发现随着OSM作用时间的延长(3 d以后),随着细胞增殖速率下降,其形态也逐渐发生变化,开始呈现增大和扁平状、胞质内颗粒状物增多等细胞衰老的特征(图3A)。进一步通过衰老相关的β-半乳糖苷酶染色实验显示,在OSM处理7 d的HepG2细胞中,呈深绿色阳性染色的细胞数量明显增加(图3B)。上述实验结果提示,OSM抑制肝癌细胞增殖主要是通过诱导细胞衰老。
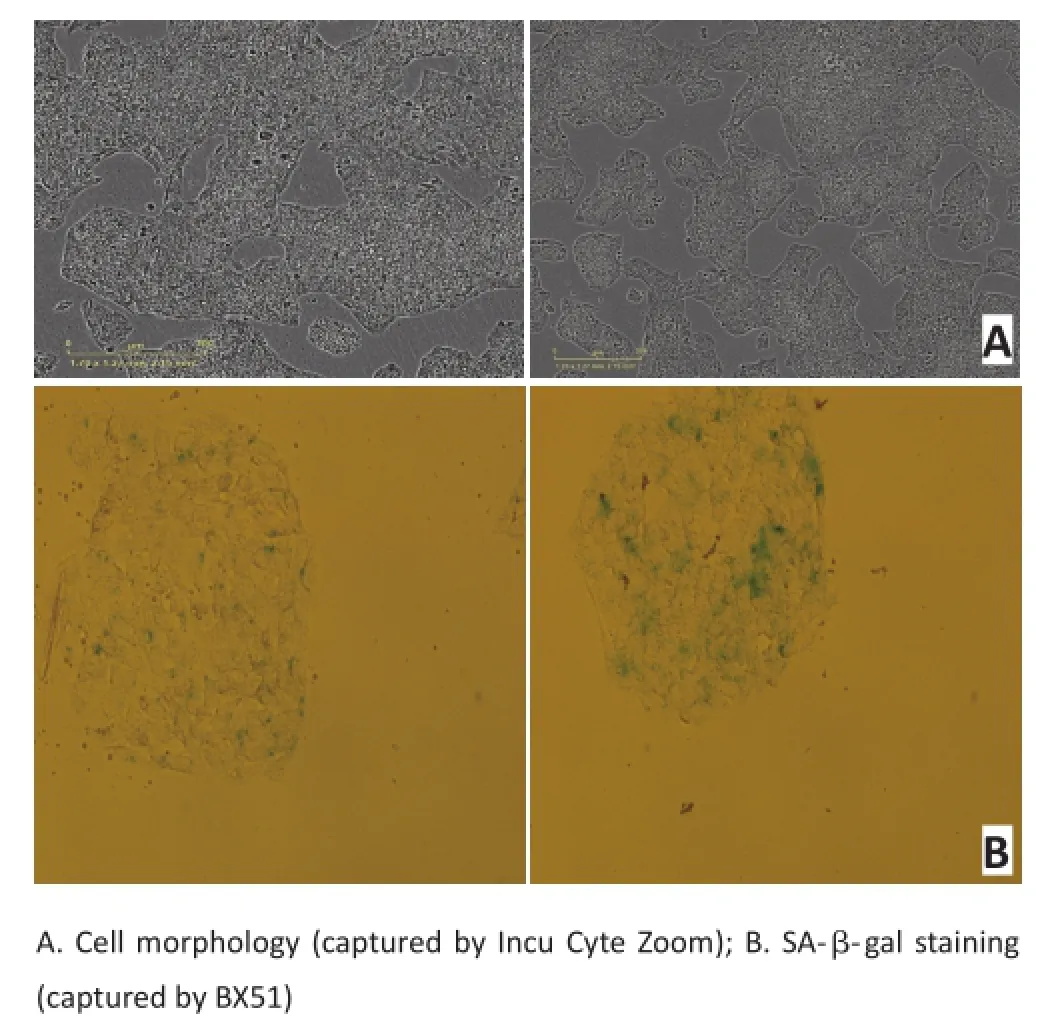
图3 OSM诱导HepG2细胞衰老(×400)Figure3 Senescence‐like characteristics induced by OSM in HepG2 cells (×400)
2.4 OSM阻滞细胞周期在G0/G1期
除形态变化外,衰老细胞的另一个重要特征是逐渐退出细胞周期,永久性停滞于G0期。为分析OSM作用肝癌细胞后的周期变化趋势,用OSM(10 ng/mL)处理SMMC-7721、HepG2细胞6 d后进行流式细胞术分析。结果表明,经药物处理过后G0/G1期的细胞数量升高,而S期的细胞量减少,即OSM可以将细胞周期阻滞于G0/G1期,从而抑制细胞增殖(图4)。
2.5 OSM上调周期依赖性激酶抑制剂p21、p27表达
细胞周期的阻滞常会伴随周期依赖性激酶(cy⁃clin-dependent kinases)抑制剂的激活,主要包括p16、p21和p27等蛋白的表达增强。本研究中,OSM可促进p21和p27在转录和蛋白两个层次都呈现表达升高,特别是p21的表达还呈现明显的剂量依赖性(图5)。由于p21是重要抑制基因p53下游的靶基因,p21表达增高提示OSM可能间接激活p53蛋白的抑癌功能。
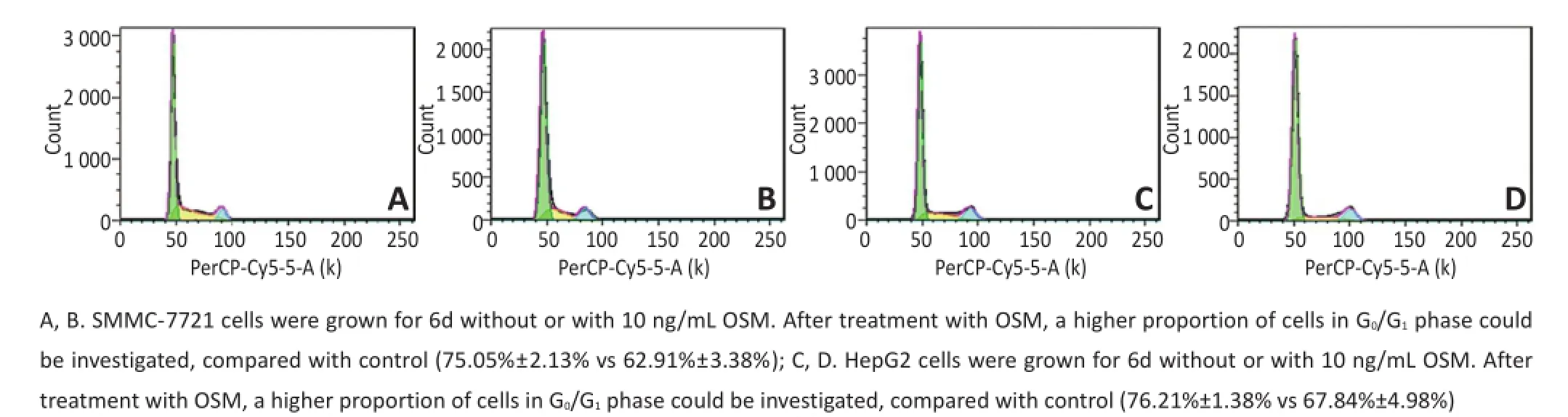
图4 OSM诱导肝癌细胞G0/G1期阻滞Figure4 Prolonged cycle arrest at G0/G1induced by OSM in live cancer cells
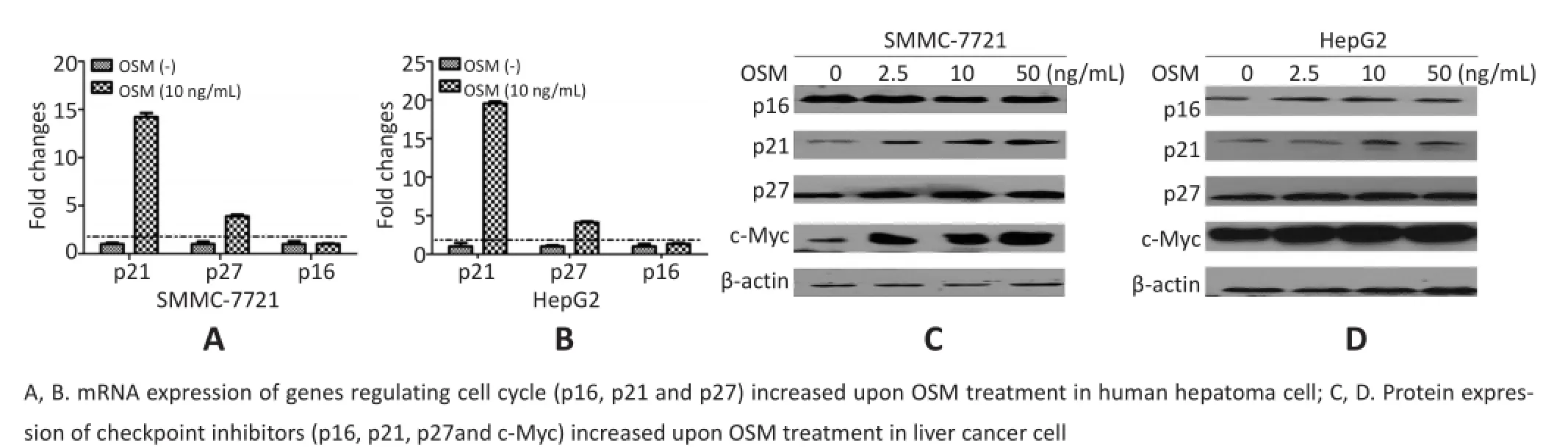
图5 细胞周期相关基因表达检测Figure5 Expression of genes regulating cell cycle
2.6 OSM上调癌基因c-Myc的表达
细胞衰老的一个内在因素是癌基因的异常激活,这种形式的衰老也称作癌基因诱导的细胞衰老(oncogeneinduced senescence)。为了探寻OSM促进细胞衰老的关键环节,本研究分析OSM可能激活的MAPK、STAT3和PI3K信号途径,其中癌基因c-Myc是STAT3下游的一个重要靶基因。进一步通过RT-qPCR和Western blot实验证实OSM处理SMMC-7721和HepG2细胞,均促进了c-Myc蛋白的积累(图5)和mRNA表达,且后者的增高程度还呈现一定的OSM剂量依赖性(图6)。上述研究结果提示,OSM处理导致的肝癌细胞衰老,可能是细胞对癌基因c-Myc激活的应答,而这一过程是通过p53-p21信号途径来介导的。

图6 RT-qPCR检测肝癌细胞中c-Myc的表达Figure6 c‐Myc expression quantified by RT‐qPCR in liver cancer cells
3 讨论
抑瘤素M曾因能够抑制黑色素瘤细胞生长而得名,但随后的研究逐渐表明,这一细胞因子的效应并非是单一的:对有些类型的肿瘤细胞表现为抑制,而对另一些类型则表现为促进增殖。这些现象反映出OSM作用机制的复杂性,但随着研究的积累,也发现OSM这两种完全相反的效应与癌症的发展阶段或恶性程度具有一定的相关性。总体来说,对于正常上皮细胞和一些早期肿瘤,OSM发挥抗增殖、抑制癌症进展的作用[7];而对于恶性程度或转移性较高的肿瘤,OSM表达的增高却与不良预后相关[8]。这种现象与转化生长因子-β(TGF-β)对肿瘤细胞的效应极为相似[9]。本研究中OSM抑制肝癌增殖中的分子机制,可以为上述两种不同效应提供一种可能的解释。
OSM诱导肝癌细胞进入衰老状态,类似现象在OSM处理正常乳腺上皮细胞中也会出现[10]。引起细胞衰老的内在因素之一是癌基因激活,而OSM所激活STAT3信号途径下游一个重要的癌基因就是c-Myc[11]。c-Myc是促进细胞增殖的重要转录因子,而且与Ras癌基因导致细胞衰老一样[12],c-Myc的异常增强表达同样可以通过这一途径抑制细胞的增殖[13]。但是,癌基因激活而导致细胞衰老是需要一定前提条件的。其中一个最重要的条件就是需要细胞具有激活p53或(和)Rb这类周期负调控蛋白的能力[14]。然而对已处于进展期的癌细胞,这些蛋白的基因往往会发生突变或失活。如约50%的癌症患者中都存在p53的功能丧失。这也就解释了为何OSM对于已发展成为晚期阶段的肿瘤大多表现为进一步的促进增殖。这一机制在肝癌细胞中也得到了有力的证实:OSM抑制正常肝细胞的增殖,但是如果通过转入人乳头瘤病毒(HPV)的E6、E7基因,抑制细胞的p53和Rb蛋白活性,肝细胞则会在OSM刺激下持续增殖[15]。
本研究对OSM抑制肝癌细胞现象和机制探讨,具有两点临床意义。首先,如果将肝硬化作为肝癌发展的前期阶段,这一时期OSM的升高除了作为提示疾病发展的潜在标志物外,同时在生理上也可能起到抑制早期癌变的作用。其次,OSM虽然在体外实验中表现出肿瘤细胞的抑制,但由于其同时也激活了癌基因c-Myc的表达,因此要作为一种治疗手段还存在一定风险。
[1]Tanaka M,Miyajima A.Oncostatin M.A multifunctional cytokine [J].Rev Physiol Biochem Pharmacol,2003,149(6):39‐52.
[2]Zarling JM,Todaro GJ.Oncostatin M.a growth regulator produced by differentiated histiocytic lymphoma cells[J].Proc Natl Acad Sci U S A,1986,83(24):9739‐9743.
[3]Chevilier S,Fourcin M,Robledo O,et al.Interleukin‐6 family of cy‐tokines induced activation of different functional sites expressed by gp130 transducing protein[J].J Biol Chem,1996,271(25):14764‐14772.
[4]Heinrich PC,Behrmann I,M Ller‐newen G,et al.IL‐6‐type cytokine signalling through the gp130/JAK/STAT pathway[J].Biochem J, 1998,334(pt 2):297‐314.
[5]Levy MT,Trojanowska M,Reuben A.Oncostatin M:a cytokine up‐regulated in human cirrhosis,increases collagen production by hu‐man hepatic stellate cells[J].J Hepatol,2000,32(2):218‐226.
[6]Znoyko I,Sohara N,Spicer SS,et al.Expression of oncostatin M and its receptors in normal and cirrhotic human liver[J].J Hepatol, 2005,43(5):893‐900.
[7]Grenier A,Dehoux M,Boutten A,et al.Oncostatin M production and regulation by human polymorphonuclear neutrophils[J].Blood,1999, 93(4):1413‐1421.
[8]Koskela K,Pelliniemi TT,Rajam KA,et al.Serum oncostatin M in multiple myeloma:impact on disease severity and prognosis[J]. Eur J Haematol,2000,65(1):52‐56.
[9]Kajdaniuk D,Marek B,Borgiel‐Marek H,et al.Transforming growth factor beta1(TGFbeta1)in physiology and pathology[J].Endokrynol Pol,2013,64(5):384‐396.
[10]Kan CE,Cipriano R,Jackson MW.c‐MYC functions as a molecular switch to alter the response of human mammary epithelial cells to oncostatin M[J].Cancer Res,2011,71(22):6930‐6939.
[11]Zhang F,Li C,Halfter H,et al.Delineating an oncostatin M‐activated STAT3 signaling pathway that coordinates the expression of genes involved in cell cycle regulation and extracellular matrix deposition of MCF‐7 cells[J].Oncogene,2003,22(6):894‐905.
[12]Benanti JA,Galloway DA.The normal response to RAS:senescence or transformation[J]?Cell Cycle,2004,3(6):715‐717.
[13]Van RJ,Felsher DW.Myc and a Cdk2 senescence switch[J].Nat Cell Biol,2010,12(1):7‐9.
[14]Ben‐Porath I,Weinberg RA.The signals and pathways activating cel‐lular senescence[J].Int J Biochem Cell Biol,2005,37(5):961‐976.
[15]Levy G,Bomze D,Heinz S,et al.Long‐term culture and expansion of primary human hepatocytes[J].Nat Biotechnol,2015,33(12):1264‐1271.
(2016‐11‐30收稿)
(2017‐04‐06修回)
(编辑:郑莉校对:孙喜佳)
Inflammatory cytokine oncostatin M suppresses growth of liver cancer cells by inducing senescence
Yanyan ZHANG1,Ying LUO2,3,4,Guozhen WU1,Peng WANG2,3,4,Xiaolei JIAO2,3,4,Yayue LI2,3,4,Yingtang GAO2,3,4,Zhengyan ZHU2,3,4,Bin YANG2,3,4
1Clinical School of Tianjin Medical University at Tianjin Third Central Hospital;2Hepatobiliary Disease Institute,Tianjin Third Central Hos‐pital;3Tianjin Key Laboratory of Artificial Cells;4Artificial Cell Engineering Technology Research Center of National Health and Family Planning Commission of the People's Republic of China,Tianjin 300170,China
Zhengyan ZHU;E‐mail:zhuzhengyan59@163.com
Objective:To provide a possible mechanism underlying oncostatin M(OSM)‐induced tumor growth by investigating the ef‐fects on growth of liver cancer cells and its molecular pathway.Methods:Cell growth rates were analyzed after OSM treatment in hu‐man liver cancer cell lines‐SMMC‐7721 and HepG2.Cellular senescence based on growth arrest and morphologic phenotype of cells was detected by senescence‐associated β‐galactosidase(SA‐β‐gal)staining.Cell cycle profile was examined by flow cytometry.The ex‐pression of key regulators of cell proliferation including cyclin‐dependent kinase inhibitors(p16,p21,and p27)and c‐Myc were ana‐lyzed at the level of mRNA and protein.Results:OSM suppressed cell proliferation in a dose‐dependent manner.Upon drug treatment, morphological changes of cells notably implicated a senescent phenotype,which was further supported by the positive SA‐β‐gal stain‐ing.Meanwhile,OSM induced an increased proportion of cells at G0/G1phase,which corresponded to the elevated expression of p21 and p27 at mRNA and protein levels.Unexpectedly,oncogene c‐Myc was also dramatically upregulated upon OSM treatment.Conclusion:As a key regulator of cell proliferation and survival,c‐Myc can be upregulated though the OSM‐activated STAT3 pathway.While in short term,such hyperactive oncogene would induce cellular senescence as a barrier to transformation in cells with intact p53 machin‐ery.These findings suggest that the elevated OSM during the earliest stages of liver cancer might serve as a tumor suppressor.
liver cancer cells,oncostatin M,senescence,c‐Myc,proliferation

10.3969/j.issn.1000-8179.2017.08.382
①天津医科大学三中心临床学院生物化学与分子生物学专业(天津市300170);②天津市三中心医院,天津市肝胆疾病研究所;③天津市人工细胞重点实验室;④卫生部人工细胞工程技术研究中心
*本文课题受天津市科委应用基础与前言技术研究计划项目(编号:15JCQNJC45700,15JCQNJC11500)和天津市卫生行业重点攻关项目(编号:12KG107,12KG108)资助
朱争艳zhuzhengyan59@163.com
This work was supported by the Municipal Key Project of Tianjin Health Bureau(No.112KG107,12KG108)and the Application Founda‐tion and Advanced Technology Program of Tianjin Municipal Science and Technology Commission(No.15JCQNJC45700,15JCQN‐JC11500)
张艳艳专业方向为生物化学与分子生物学研究。
E-mail:yyzhang1113@163.com
