外泌体与肺癌脑转移瘤关系的研究进展
2017-05-17孙红军林瑜亮综述荔志云审校
党 莹 孙红军 林瑜亮 综述 荔志云 审校
·综述·
外泌体与肺癌脑转移瘤关系的研究进展
党 莹 孙红军 林瑜亮 综述 荔志云 审校
外泌体(extracellular vesicles,EVs)是各类细胞(尤其是肿瘤细胞)释放的一种能介导遗传物质传递的磷脂双层膜的囊泡样小体。外泌体中含有受体、蛋白质和核酸,具有携带肿瘤遗传物质,调节肿瘤微环境,促进肿瘤血管生成及介导肿瘤细胞转移等功能。目前研究发现外泌体与肺癌脑转移瘤关系密切。外泌体介导的肺癌脑转移主要包括调节脑部预转移巢微环境,破坏血脑屏障,调节瘤细胞病理特征等过程。外泌体与肺癌脑转移瘤关系的研究为肺癌脑转移瘤的发生发展、临床诊断和治疗研究提供了更多分子靶点。
肺癌脑转移瘤外泌体转移巢转移机制靶向治疗
肺癌脑转移瘤是临床最常见的脑转移瘤,约占脑转移瘤的19.9%[1],其中首诊的肺癌患者中约10%,在肺癌治疗的进程中约40%患者继发脑转移。肺癌脑转移瘤患者的预后较差,其中位生存期为4~5个月。研究发现外泌体(extracellular vesicles,EVs)在调节脑部预转移巢微环境、破坏血脑屏障、调节瘤细胞病理学等过程中起着重要作用[2]。因此,EVs在肺癌脑转移瘤的发生、发展中起关键性作用,其相关分子标记物可为肺癌脑转移瘤的诊断提供重要信息,是肺癌脑转移瘤的潜在治疗靶点。本文将对EVs与肺癌脑转移瘤关系的研究进展进行综述。
1 外泌体
EVs具有脂质双层膜结构,直径为30~100 nm[3];EVs中含有细胞特异性的蛋白、脂质和核酸,能作为信号分子靶向特定细胞并改变其细胞功能,尤其在肿瘤转移方面发挥着重要作用。由于EVs含有原癌细胞遗传物质,且表面含有特异性受体结构,可特异性地与特定组织细胞结合后发生融合,并使其获得癌细胞特性[4]。
2 肺癌脑转移瘤
原发性肺癌细胞是肺癌脑转移瘤的起源细胞,病灶通常位于灰质和白质的交界处,高达65%的肺癌患者最终将发展为脑转移瘤[5]。肺癌脑转移瘤患者治疗预后极差,未经治疗患者的中位生存时间仅1~2个月。肺癌脑转移瘤患者的主要临床症状是神经症状,包括局灶性神经系统的变化和一般继发性颅内压增高的症状,表现为头痛、共济失调、癫痫发作、语音障碍等,其相关的症状与转移灶的位置和转移程度有关。肺癌脑转移瘤最主要的诊断方式首选增强MRI,另外非增强MRI或CT主要用于颅内的转移瘤的鉴别诊断,病灶通常为颅内多发,位于灰质和白质的交界处,病变周围伴有大量血管源性水肿带;如果诊断仍有疑问,应考虑活检。目前肺癌脑转移瘤的标准治疗方案包括最大程度接受全脑放疗(EGFR抑制剂±WBRT)和化疗,其总体中位生存期为3~5个月[6]。
3 EVs与肺癌脑转移性的关系
肺癌脑转移瘤的发生发展是多机制、多环节、多步骤的过程,其中EVs介导的机制是目前研究较多,也是较重要的机制之一。EVs介导的肺癌脑转移环节主要包括肺癌细胞外泌体的合成、分泌,EVs进入肺间质、体循环,并促使脑组织预转移巢的形成(图1)。[7]
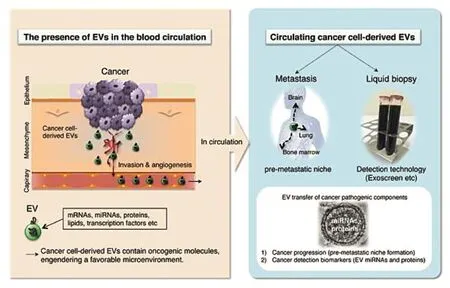
图1 EVs介导癌细胞转移的途径[7]Figure1 The pathway of cancer cell metastasis mediated by extracellular vesiclesr[7]
3.1 破坏血脑屏障
血脑屏障是限制生物大分子被动扩散的天然屏障,因此肺癌脑转移的关键环节是破坏血脑屏障。目前研究发现肺癌细胞及EVs能通过血脑屏障,其具体的分子机制仍然不清楚。Tominaga等[8]研究发现,肿瘤来源的EVs识别并结合至血脑屏障内皮细胞,通过调节肌动蛋白动力学的变化来改变血脑屏障通透性,并促进脑转移。体外实验研究发现,EVs中的miRNA-181c通过下调3-磷酸肌醇依赖性蛋白激酶(PDPK1),PDPK1进一步降解导致丝切蛋白(cofilin)的磷酸化的下调,导致活性丝切蛋白诱导肌动蛋白的下调[8];另外Zhou等[9]研究发现,肺癌细胞来源的EVs中miRNA-105下调血管内皮细胞紧密连接蛋白-1(ZO-1);上述两种机制共同解离血脑屏障血管内皮细胞紧密连接结构,最终导致血脑屏障破坏。
3.2 EVs调节脑部预转移巢微环境
目前研究证明,EVs在调节癌细胞和微环境相互作用方面起着重要作用。EVs是介导肺癌脑转移巢微环境中瘤细胞间信号交流,也是促进癌细胞进展的重要介质之一[10]。另外,癌细胞分泌的EVs进入转移巢微环境中,诱导肌成纤维细胞向肿瘤血管内皮细胞分化并形成肿瘤血管[11],同时对转移巢微环境进行免疫调节。
3.2.1 EVs调节转移巢基质细胞原发肿瘤细胞的EVs进入血液循环到达预转移巢,调节并重塑预转移巢中基质细胞及基质形成转移巢,最终诱导癌细胞到微环境形成转移病灶。EVs对转移巢基质细胞的调节在转移病灶形成过程中起关键作用。研究发现,含microRNA-494和microRNA-542-3p的EVs可上调细胞外基质金属蛋白酶MMP2、MMP3、MMP9等,降解并重塑预转移巢基质微环境[12]。EVs含有基质金属蛋白酶,进入预转移巢并启动蛋白水解级联反应,降解细胞外基质。Antonyak等[13]发现,EVs能调节正常成纤维细胞转变为肿瘤相关成纤维细胞,并通过调节转谷氨酰胺酶活性增强其生存力,其中转谷氨酰胺酶能使微环境中纤维黏连蛋白发生交联,另外纤维黏连蛋白能提高整合素的活性和增强下游蛋白激酶活性(如局部黏着斑激酶)。
3.2.2 EVs诱导癌细胞的血管生成血管生成是肿瘤进展的重要环节之一,肿瘤血管网可提供瘤细胞氧气和营养物质,并促进肿瘤细胞向远处器官转移。EVs有助于促进肿瘤血管的生成。转移性癌细胞分泌、释放的EVs决定肿瘤微环境的“生态效益”。Fujita等[14]研究发现,肺癌干细胞分泌释放的EVs能促进脑部预转移巢血管的生成。转移性癌细胞分泌、释放的含miR-210的EVs转运至预转移巢微环境的内皮细胞,并抑制特异性靶基因的表达,从而增强血管生成。有研究发现,转移性肺腺癌细胞分泌的富含miR-210的EVs,通过下调其目标ephrin A3促进人脐静脉内皮细胞(HUVECs)血管的形成[15];同时EVs的miR-210可提供中性鞘磷脂酶2(nSMase2)与预转移巢内皮细胞受体效应部分结合,激活和刺激内皮细胞迁移,促进血管生成,此外血管生成有助于癌细胞进一步转移。
3.3 EVs改变肿瘤细胞生物学特性
EVs所携带的基因在受体细胞可转化为蛋白质、t-RNA以及反义RNA,进一步调节靶基因的表达,从而诱导肿瘤细胞的恶性进展[16]。EVs可促进肿瘤细胞进展。研究表明,EVs通过暴露跨膜受体激活转移巢内瘤细胞表面受体,使其内含的蛋白、核酸进入瘤细胞内[17],参与DNA甲基化、组蛋白修饰、非编码RNA修饰等表观遗传的调控,从而改变肿瘤细胞生物学行为。
3.3.1 EVs与癌细胞DNA修饰p53是基因组的守护者,调节多种细胞监视途径[18]。超过50%的肿瘤中,p53发生基因突变或者丢失。EVs通过miRNA等表观遗传调控机制激活瘤细胞p53,增强p53、CAV1和CHMP4C的表达,使癌细胞产生耐药,同时p53基因促进TSAP6和CHMP4C等重要基因的转录,进一步促进靶细胞生产分泌大量EVs至肿瘤微环境中[19]。因此,转移巢内p53及EVs的动态监测是观察肿瘤进展的重要指标之一。
3.3.3 EVs的非编码RNA修饰非编码RNA根据其长度分为长链非编码RNA(long noncoding RNAs,lncRNAs)和非编码小RNA(small noncoding RNAs,sncRNAs),其中sncRNAs包括miRNAs。研究发现,肿瘤患者循环中含有由外泌体分泌的肿瘤相关的非编码RNA,且性质比较稳定[24],因此,非编码RNAs可作为诊断癌症的非侵入性的生物标志物之一。EVs中的非编码RNAs是促进细胞间沟通以及改变癌症微环境的重要介质,EVs中lncRNAs和miRNA可为癌症诊断与预后评估提供生物学信息。1)EVs通过miRNA调节肿瘤微环境:miRNAs是非编码小分子RNA,为22~25个核苷酸,与mRNA通过碱基配对后,引起靶mRNA的降解或翻译抑制,以对基因进行转录后表达水平调控。相关研究发现,超过50%的miRNA基因定位于肿瘤相关区域和脆性位点,提示miRNA与肿瘤的发病机制密切相关。转移癌细胞相关的miRNA是EVs的特殊类型:转移性黑色素瘤细胞的EVs释放高水平的prominin-1,促进了转移的进展[25];转移性胃癌,EVs中的let-7 miRNA家族选择性的被分泌到细胞外环境中,并在进入预转移巢前诱导其转移表型[26];敲除bsp73asml和CD44v4-v7基因的大鼠在转移型肺腺癌中miR-494和miR-542-3p水平明显低于过表达bsp73asml大鼠[27];EVs中的miR-650、miR-151,miR-19b、miR-29c,和miR-151与肺癌的侵袭和转移相关,并刺激了肺癌转移病灶的形成[28]。转移巢中miR-105和miR-210破坏细胞间的紧密连接并促进肿瘤细胞的转移[29]。此外研究发现,脑转移癌细胞可释放miRNA-181c进一步破坏血脑屏障[30]。因此EVs中与转移相关的miRNAs被推荐用于癌症诊断及预后的评估。2)EVs通过lncRNAs调节肿瘤微环境:lncRNAs是长度超过200个核苷酸、100kb以内的内源性细胞内RNA,且不编码蛋白质,主要参与基因转录和转录后调控[31]。越来越多的证据表明IncRNAs与肺癌脑转移瘤有关。研究发现EVs的miRNAs(LncRNA)是选择性的分泌。EVs中lncRNA通过细胞-细胞间交流调节癌细胞的微环境,一方面有利于癌细胞更好地适应动态变化的环境,另一方面可能会促进肿瘤生长、转移和耐药[32]。研究发现来自肝癌细胞的外泌体lncRNAtuc339与肿瘤的生长、黏附以及细胞周期进程密切相关[33]。宫颈癌和乳腺癌的EVs中lncRNA MALAT1[18],与肿瘤转移和侵袭相关。lncRNA-MALAT1是目前研究用于临床上诊断非小细胞肺癌以及肺癌脑转移的重要生物标志物之一。
4 问题与展望
全球癌症流行病学调查显示:8.5%~9.6%的癌症患者发生脑转移,其中肺癌脑转移瘤占脑转移瘤的19.9%[34]。非小细胞肺癌是肺癌脑转移的主要类型,其中以肺腺癌脑转移为主。目前对于肺癌脑转移瘤主要治疗以手术和放疗为主,以术后化疗为辅助治疗,尚无确切有效的治疗方法。因此,研究肺癌脑转移的相关机制,进行靶向性治疗是目前治疗肺癌脑转移的研究热点。
研究证明肿瘤细胞EVs与肿瘤的转移密切相关。对于肺癌脑转移瘤,颅脑微环境的改变及其肺癌细胞EVs的定向迁移非常重要。EVs在肿瘤微环境中扮演着重要角色,直接或间接参与了肿瘤微环境中细胞间的信号转导、肿瘤的发生和发展过程。肺癌细胞分泌的EVs中含有癌基因、能够调控表观遗传编程分子,并脱落到肿瘤微环境以促进肿瘤的进展[35]。EVs参与了DNA甲基化、组蛋白修饰、转录后调控和RNA调控。EVs所传递的相关物质进一步反映了细胞的状态,源于肿瘤细胞的EVs可能改变肿瘤并促进肿瘤抑制基因在受体细胞中的表达。因此,体液(包括血液)中的EVs可以作为癌症的生物标志物,这些生物标志物的检测可能被用于癌症的诊断或预后评估。Fabbri等[36]研究发现由肺癌细胞分泌的miR-21及miR-29a作为配体并在免疫细胞中与Toll样受体(Toll-like receptor,TLR)家族成员(如鼠TLR7及人TLR8等)结合,进一步引发由TLR介导的炎症反应,促进肺癌细胞的生长。此外,EVs源性miRNA也作为TLR的旁分泌激动剂,是肿瘤微环境的关键调节因子,与肿瘤免疫系统的信息交流和肿瘤的生长及转移密切相关。
EVs作为靶标系统将有效推动肿瘤医学的发展,需深入探讨EVs与肺癌脑转移瘤之间的关系,进一步深入理解EVs结构以及与调控蛋白之间交互作用的内在机制。总之,越来越多EVs结构区域和修饰方式的确定,EVs在肺癌脑转移瘤调控过程中的作用会越来越明确。随着对肺癌脑转移瘤过程中EVs的深入研究,EVs的监测可为其易感或高危人群的筛选、临床诊断、分子分期、预后评估、复发或转移预测判断、疗效评价等提供更加有力的证据,尤其可为肺癌脑转移瘤预防策略的制定和风险评价体系的建立提供新思路。
[1]Owonikoko TK,Arbiser J,Zelnak A,et al.Current approaches to the treatment of metastatic brain tumours[J].Nat Rev Clin Oncol,2014, 11(4):203‐222.
[2]Fujita Y,Kuwano K,Ochiya T,et al.The impact of extracellular vesicle‐encapsulated circulating microRNAs in lung cancer research[J].Biomed Res Int,2014,2014:486413.
[3]Yuan A,Farber EL,Rapoport AL,et al.Transfer of microRNAs by em‐bryonic stem cell microvesicles[J].PLoS One,2009,4(3):e4722.
[4]Taylor DD,Gercel‐Taylor C.The origin,function,and diagnostic po‐tential of RNA within extracellular vesicles present in humanbiological fluids[J].Front Genet,2013,4:142.
[5]Sperduto PW,Wang M,Robins HI,et al.A phase 3 trial of whole brain radiation therapy and stereotactic radiosurgery alone versus WBRT and SRS with temozolomide or erlotinib for non‐small cell lung cancer and 1 to 3 brain metastases:Radiation Therapy Oncology Group 0320 [J].Int J Radiat Oncol Biol Phys,2013,85(5):1312‐1318.
[6]MaS,XuY,DengQ,et al.Treatment of brainmetastasis fromnon‐small cell lung cancer with whole brain radiotherapy and Gefitinib in a Chinese population[J].Lung cancer,2009,65(2):198‐203.
[7]Fujita Y,Yoshioka Y,Ochiya T.Extracellular vesicle transfer of cancer pathogenic components[J].Cancer science,2016,107(4):385‐390.
[8]Tominaga N,Kosaka N,Ono M.Brain metastatic cancer release mi‐croRNA‐181 c‐containing extracellular vesicles capable of destructing blood‐brain barrier[J].Nat Commun,2015,6:6716.
[9]Zhou W,Fong MY,Min Y.Cancer‐secreted miR‐105 destroys vascular endothelial barriers to promote metastasis[J].Cancer Cell,2014,25(4): 501‐515.
[10]Zhang L,Zhang S,Yao J,et al.Microenvironment‐induced PTEN loss by exosomal microRNA primes brain metastasis outgrowth[J].Nature, 2015,527(7576):100‐104.
[11]Kosaka N,Iguchi H,Hagiwara K,et al.Neutral sphingomyelinase 2 (nSMase2)‐dependent exosomal transfer of angiogenic microRNAs regulate cancer cell metastasis[J].J Biol Chem,2013,288(15):10849‐10859.
[12]Rana S,Malinowska K,Zöller M.Exosomal tumor microRNA modulates premetastatic organ cells[J].Neoplasia,2013,15(2):281‐293.
[13]Antonyak MA,Li B,Boroughs LK.Cancer cell‐derived microvesicles induce transformation by transferring tissue transglutaminase and fibronectintorecipient cells[J].Proc Natl AcadSci USA,2011,108(12): 4852‐4857.
[14]Fujita Y,Yoshioka Y,Ochiya T.Extracellular vesicle transfer of cancer pathogenic components[J].Cancer Science,2016,107(4):385‐390. [15]Steinkraus BR,Toegel M,Fulga TA.Tiny giants of gene regulation: experimental strategies for microRNA functional studies[J].Wiley Interdisciplinary Rev Dev Biol,2016,5(3):311‐362.
[16]Chiba M,Kimura M,Asari S.Exosomes secreted from human colorectal cancer cell lines contain mRNAs,microRNAs and natural antisense RNAs,that can transfer into the human hepatoma HepG2 and lung cancer A549 cell lines[J].Oncol Rep,2012,28(5):1551‐1558.
[17]Paladini L,Fabris L,Bottai G,et al.Targeting microRNAs as key mod‐ulators of tumor immune response[J].J Exp Clin Cancer Res,2016,35: 103.
[18]Gezer U,Özgür E,Cetinkaya M,et al.Long non‐coding RNAs with low expression levels in cells are enriched in secreted exosomes[J].Cell Biol Int,2014,38(9):1076‐1079.
[19]Liu YR,Tang RX,Huang WT,et al.Long noncoding RNAs in hepato‐cellular carcinoma:Novel insights into their mechanism[J].J WorldHepatol,2015,7(28):2781.
[20]Vigetti D,Viola M,Karousou E,et al.Epigenetics in extracellular matrix remodelingandhyaluronanmetabolism[J].FEBSJ,2014,281(22):4980‐4992.
[21]Okugawa Y,Grady WM,Goel A.Epigenetic alterations in colorectal cancer:emerging biomarkers[J].Gastroenterology,2015,149(5):1204‐1225.
[22]Mathivanan S,Fahner CJ,Reid GE,et al.ExoCarta 2012:database of exosomal proteins,RNA and lipids[J].Nucleic Acids Res,2012,40(D1): D1241‐D1244.
[23]Sharma A.Bioinformatic analysis revealing association of exosomal mRNAs and proteins in epigenetic inheritance[J].J Theor Biol,2014, 357:143‐149.
[24]Ma R,Jiang T,Kang X.Circulating microRNAs in cancer:origin,function and application[J].J Exp Cancer Res,2012,31:38.
[25]Thamm K,Graupner S,Werner C,et al.Monoclonal antibodies 13A4 and AC133 Do not recognize the canine ortholog of mouse and human stem cell antigen prominin‐1(CD133)[J].PLoS ONE,2016,11(10): e0164079.
[26]Ohshima K,Inoue K,Fujiwara A,et al.Let‐7 microRNA family is se‐lectively secreted into the extracellular environment via exosomes in a metastatic gastric cancer cell line[J].PLoS ONE,2010,5(10):e13247.
[27]Rana S,Malinowska K,Zöller M.Exosomal tumor microRNA modulates premetastatic organ cells[J].Neoplasia,2013,15(3):281‐295.
[28]Grange C,Tapparo M,Collino F,et al.Microvesicles released from human renal cancer stem cells stimulate angiogenesis and formation of lung premetastatic niche[J].Cancer research,2011,71(15):5346‐5356.
[29]Kosaka N,Iguchi H,Hagiwara K,et al.Neutral sphingomyelinase 2 (nSMase2)‐dependent exosomal transfer of angiogenic microRNAs regulate cancer cell metastasis[J].J Biol Chem,2013,288(15):10849‐10859.
[30]Tominaga N,Kosaka N,Ono M,et al.Brain metastatic cancer cells release microRNA‐181c‐containing extracellular vesicles capable of destructing blood‐brain barrier[J].Nat Commun,2015,6:6716.
[31]Perkel JM.Visiting"noncodarnia"[J].Biotechniques,2013,54(6):301, 303‐304.
[32]Qian Z,Shen Q,Yang X,et al.The Role of extracellular vesicles:An epigenetic view of the cancer microenvironment[J].Biomed Res Int, 2015,2015:649161.
[33]Kogure T,Yan IK,Lin WL,et al.extracellular vesicle‐mediated transfer of a novel long noncoding RNA TUC339 a mechanism of intercellular signaling in human hepatocellular cancer[J].Genes cancer,2013,4(7‐8):261‐272.
[34]Owonikoko TK,Arbiser J,Zelnak A,et al.Current approaches to the treatment of metastatic brain tumours[J].Nature Reviews Clinical Oncology,2014,11(4):203‐222.
[35]McDermott R,Gabikian P,Sarvaiya P,et al.MicroRNAs in brain me‐tastases:big things come in small packages[J].J Mol Med,2013,91(1): 5‐13.
[36]Fabbri M,Paone A,Calore F,et al.MicroRNAs bind to Toll‐like receptors to induce prometastatic inflammatory response[J].Proc Nati Acad Sci, 2012,109(31):E2110‐E2116.
(2017‐01‐20收稿)
(2017‐03‐13修回)
(编辑:杨红欣校对:郑莉)
Research progress on relationship between brain metastasis from lung cancer and extracellular vesicles
Ying DANG,Hongjun SUN,Yuliang LIN,Zhiyun LI
Department of Neurosurgery,Lanzhou General Hospital,Lanzhou 730050,China
Zhiyun LI;E‐mail:lizhiyun456@163.com
Extracellular vesicles(EVs)are vesicles like body of phospholipid bilayer membrane,which are able to mediate the transfer of genetic material.There are receptors,proteins and nucleic acids in the body,with carrying tumor genetic material,regulating tumor microenvironment,promoting tumor angiogenesis and mediating tumor cell metastasis.At present,it is found that there is a close re‐lationship between the secretion and the metastasis of lung cancer.The main aspects of the brain metastasis of the lung cancer medi‐ated by the exocrine body include the regulation of the microenvironment of the brain,the destruction of the blood‐brain barrier,and the regulation of tumor cell pathology.The study on the relationship between the tumor and the metastasis of lung cancer may pro‐vide more molecular targets for the development,diagnosis and treatment of lung cancer.
brain metastases from lung cancer;extracellular vesicle;metastatic niche;transfer mechanism;target therapy

10.3969/j.issn.1000-8179.2017.08.080
党莹专业方向为颅内肿瘤的基础与临床研究。E-mail:dangy052@163.com
兰州总医院神经外科(兰州市730050)
荔志云lizhiyun456@163.com
