61例淋巴瘤患者自体外周血造血干细胞动员方案临床分析*
2017-05-17王超雨赵海丰杨洪亮赵智刚王晓芳王亚非张翼鷟
王超雨 夏 冰 许 雯 田 晨 赵海丰 杨洪亮 赵智刚 王晓芳 王亚非 于 泳 张翼鷟
61例淋巴瘤患者自体外周血造血干细胞动员方案临床分析*
王超雨 夏 冰 许 雯 田 晨 赵海丰 杨洪亮 赵智刚 王晓芳 王亚非 于 泳 张翼鷟
目的:比较化疗+G-CSF与化疗+G-CSF+GM-CSF方案对淋巴瘤患者外周血造血干细胞动员采集及造血重建的效果差异。方法:回顾性分析2008年5月至2016年10月天津医科大学肿瘤医院血液科收治的61例行自体外周血造血干细胞移植(au⁃tologous peripheral blood stem cell transplantation,APBSCT)的淋巴瘤患者,分别采用化疗+G-CSF或化疗+G-CSF+GM-CSF方案动员外周血造血干细胞的临床资料。分析动员采集效果及移植后造血重建、发热、抗生素应用等情况。结果:动员期间所有患者白细胞计数均降至1.0×109/L以下,血小板计数降至40×109/L以下。化疗+G-CSF组患者采集CD34+细胞数的成功率明显低于化疗+ G-CSF+GM-CSF组(52.5%vs.90.5%,P=0.003)。所有患者移植后均顺利完成造血重建,无移植相关死亡。化疗+G-CSF组和化疗+G-CSF+GM-CSF组中性粒细胞、血小板恢复时间及回输后发热、抗生素使用情况差异均无统计学意义(P>0.05)。结论:化疗+ G-CSF+GM-CSF组动员CD34+细胞产率虽然明显高于化疗+G-CSF组,然而移植成功率、中性粒细胞恢复时间、血小板恢复时间及不良反应均无显著性差异,本研究认为化疗+G-CSF+GM-CSF动员方案并未优于化疗+G-CSF动员方案。
淋巴瘤自体外周血造血干细胞移植动员G-CSFGM-CSF
以化疗为主的综合治疗方案是治疗中、高度恶性淋巴瘤的有效方法之一,但常规方案对具有预后不良因素的恶性淋巴瘤疗效不佳。自20世纪70年代开始,临床上尝试应用自体骨髓移植(autologous bone marrow transplantation,ABMT)结合大剂量放化疗治疗恶性淋巴瘤,疗效令人瞩目并受到广泛关注[1-2]。20世纪90年代开始,关于自体外周血造血干细胞移植(autologous peripheral blood stem cell trans⁃plantation,APBSCT)治疗恶性淋巴瘤的临床研究多于ABMT,APBSCT具有采集造血干细胞安全方便、移植后造血及免疫功能恢复快,一定程度上减少肿瘤细胞污染、移植相关死亡率低等优点。迄今为止,APB⁃SCT依然是治疗中高度恶性、难治、复发淋巴瘤的有效方法[3-4]。然而,自体外周血造血干细胞动员后采集数量是移植成功的最关键因素,受患者疾病类型、既往治疗史、动员和采集方案等多种因素影响,外周血造血干细胞的动员和采集效果存在较大差异。临床上多应用CD34+细胞数作为外周血造血干细胞的指标。本研究对天津医科大学肿瘤医院血液科收治的61例恶性淋巴瘤患者自体外周血造血干细胞动员情况进行了回顾性分析。
1 材料与方法
1.1 病例资料
回顾性分析2008年5月至2016年10月天津医科大学肿瘤医院血液科进行外周血造血干细胞动员采集的淋巴瘤患者61例,其中男性33例、女性28例,中位年龄30(6~64)岁;初治52例,复发难治9例;在61例淋巴瘤患者中,霍奇金淋巴瘤(Hodgkin's lym⁃phoma,HL)9例、弥漫大B细胞淋巴瘤-非特指型(diffuse large B-cell lymphoma-NOS,DLBCL-NOS)19例、原发纵隔大B细胞淋巴瘤(primary mediastinal large B-cell lymphoma,PMBCL)6例、原发中枢大B细胞淋巴瘤(primary large B-cell lymphoma,CNS-DLB⁃CL)2例、滤泡细胞淋巴瘤(follicular cell lymphoma,FL)2例、伯基特淋巴瘤(Burkitt's lymphoma,BL)1例、淋巴浆细胞淋巴瘤/华氏巨球蛋白血症(lymphoid cell lymphoma,LPL/Waldenstrom'smacroglobulinemia,WM)1例、惰性淋巴瘤向大B细胞淋巴瘤(large B-cell lymphoma,B-DLCL)转化4例、T淋巴母细胞淋巴瘤(T-lymphoblastic lymphoma,T-LBL)5例、间变大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)7例、NK/T细胞淋巴瘤(NK/T cell lymphoma,NKTCL)4例、Castleman's病(Castleman's disease,CD)1例。其中40例患者以化疗+G-CSF为动员方案,21例以化疗+G-CSF+GM-CSF为动员方案。所有淋巴瘤患者均参照2008年世界卫生组织(WHO)造血与淋巴组织肿瘤分类标准经病理组织学确诊。临床分期按Ann Arbor分期进行,Ⅰ/Ⅱ期11例,Ⅲ/Ⅳ期50例;有B症状者(无其他原因体温>38℃持续3 d以上、6个月内体质量减轻10%以上、盗汗)28例,无B症状者33例;其中有12例患者骨髓受累。所有患者行干细胞动员采集前均进行常规或大剂量化疗。明确诊断到动员的中位时间为7(4~87)个月。所有患者行干细胞移植前均达完全缓解(complete response,CR)或部分缓解(partial response,PR),移植前所有患者行骨髓活检及骨髓涂片检查证实骨髓增生正常(表1)。
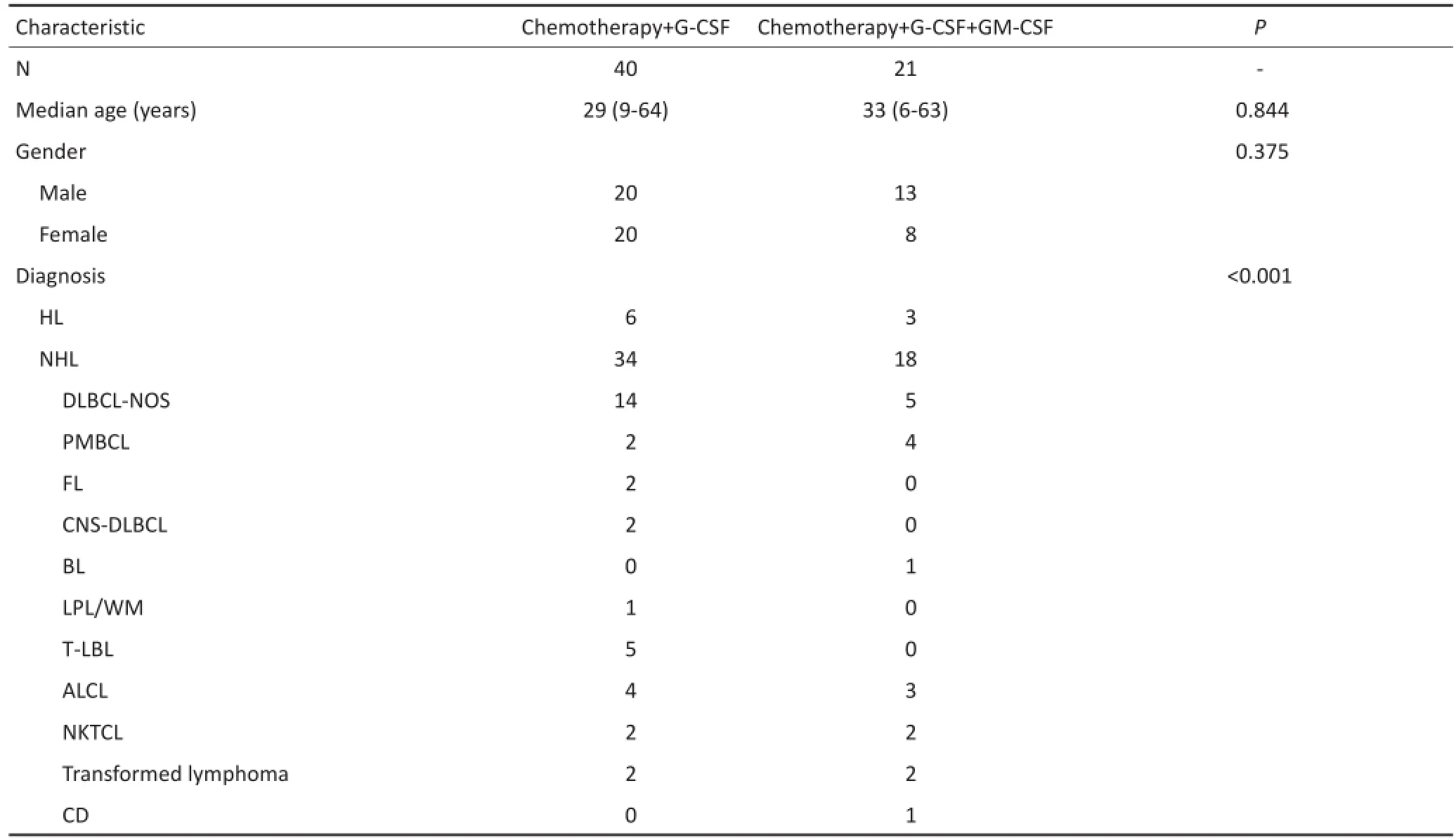
表161 例淋巴瘤患者临床资料例Table1 Clinical characteristics of 61 lymphoma patientsn
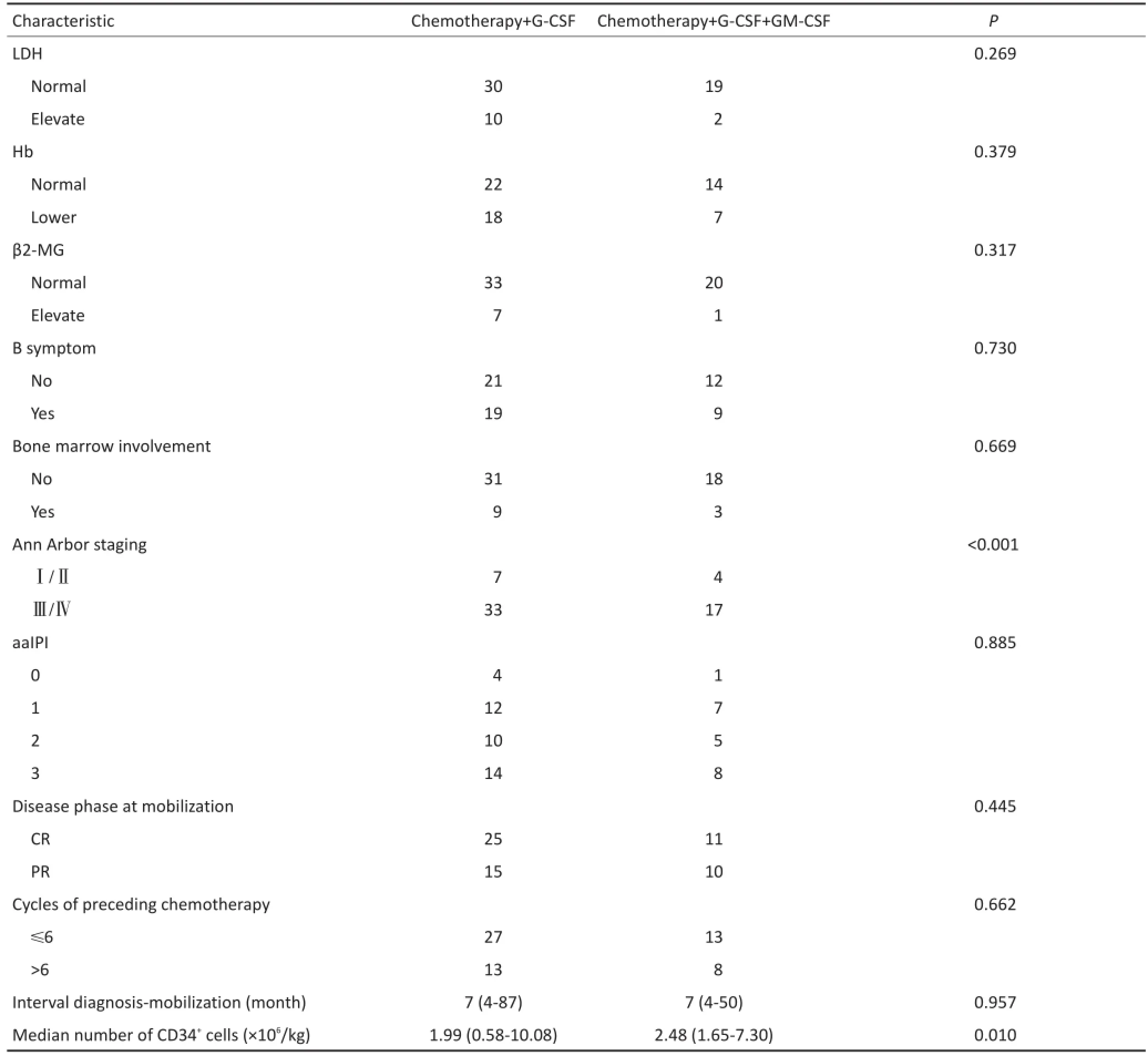
表1 61例淋巴瘤患者临床资料例(续表1)Table1 Clinical characteristics of 61 lymphoma patientsn
1.2 方法
1.2.1 外周血造血干细胞动员61例淋巴瘤患者中,49例患者动员化疗方案为COEP,用药及剂量为:环磷酰胺(CTX)2.5~3.0 g/m2分2 d静脉滴注,依托泊苷(VP-16)100 mg第1~5天,长春地辛(VDS)4 mg第1天,泼尼松(Pred)100 mg第1~5天;其中7例联合利妥昔单抗(美罗华,375 mg/m2,-1 d和+8 d)。其余12例患者根据具体病情,选择相应的大剂量化疗方案(CTX单药6例,DA-EPOCH 4例,ESHAP 2例)。其在两组内的分布是均衡的。当白细胞计数降至低谷,开始回升时给予动员剂皮下注射,至干细胞采集结束。化疗+G-CSF组动员剂剂量为G-CSF 10 μg/kg·d;化疗+G-CSF+GM-CSF组为G-CSF 5 μg/kg·d,GM-CSF 5 μg/kg·d。
1.2.2 外周血造血干细胞采集和保存当患者白细胞计数升高至4.0×109/L以上时采集单个核细胞。根据获得CD34+细胞数情况,连续采集1~3 d。干细胞采集全部使用美国Baxter CS 3000 plus血细胞分离机,常规使用ACD抗凝。每次循环血量设为患者血容量的2.5倍(8 000~12 000 mL),设定流速50~55 mL/min。采集完毕后应用流式细胞仪测定采集物中CD34+细胞百分比,并计数采集物内有核细胞总数,CD34+细胞百分比与采集物有核细胞总数乘积即为采集CD34+细胞总数(106/Kg)。此研究将获得CD34+细胞数≥2×106/kg判定为采集成功,反之为采集失败。将所采集的外周血造血干细胞根据MNC计数结果,向干细胞液中加入保护剂:浓度为5%二甲基亚砜(DMSO),3%羟乙基淀粉(HES)和人血清蛋白(HSA)。调整细胞浓度为(8.0~29.9)×107/mL,不经程序降温,直接于-80℃冰箱冻存。干细胞回输在预处理结束后24~36 h进行,将冻存干细胞直接从-80℃冰箱取出,在水浴40~42℃快速解冻后立即快速回输。外周血造血干细胞回输72 h后开始使用G-CSF 10 μg/kg·d促进造血重建。
1.2.3 预处理及移植30例患者均采用BEAC方案进行预处理,BCNU 300 mg/m2,-6 d;VP-16 75 mg/m2,-5~-2 d;Ara-C100mg/m2q12h,-5~-2d;CTX1.5g/m2,-5~-2 d;5例联合应用利妥昔单抗(美罗华375 mg/m2,-1 d、+8 d)。其中13例患者采用BEAM方案行预处理,BCNU 300 mg/m2,-6 d;VP-16 150 mg/m2,-5~-2 d;Ara-C150mg/m2,q12h,-5~-2d;MEL140mg/m2,-2d口服;2例联合应用利妥昔单抗(美罗华375mg/m2,-1d、+8d)。8例患者采用CBV方案行预处理,CTX 1.5 g/m2×4 d,-6~-3 d;BCNU 300 mg/m2·d,-7 d;VP-16(100~150)mg/m2,q12 h×3 d,-6~-4 d;其中1例联合应用利妥昔单抗和西达本胺(美罗华375 mg/m2,-1 d、+8 d、西达苯胺10 mg/d,-13~-1 d)。5例患者采用改良TBI/CY预处理方案。5例患者采用改良BU/CY方案行预处理。在61例患者中,有5例接受含有全身放疗(TBI)的预处理方案(TBI 700~900 cGy),分2次完成。
1.3 统计学分析
采用SPPS 21.0软件对数据进行统计学分析。对变量资料进行描述性统计及Shapiro-Wilk正态性检验,非正态分布数据以中位数(最小值,最大值)表示,正态分布数据用x±s表示。单因素分析的组间数据比较采用秩和检验、Mann-Whitney U检验或Kruskal-Wallis H检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 外周血造血干细胞总体动员及采集效果
61例患者共行106例次外周血造血干细胞的采集,获得的CD34+细胞中位数为2.16(0.58-10.08)× 106/kg,采集成功率为65.6%(40/61)。化疗+G-CSF组采集CD34+细胞中位数为1.99(0.58-10.08)×106/kg,采集成功率为52.5%(21/40);化疗+G-CSF+GM-CSF组采集CD34+细胞中位数为2.48(1.65-7.30)×106/kg,采集成功率为90.5%(19/21)。
2.2 影响外周血造血干细胞采集结果的单因素分析2.2.1性别和年龄对CD34+细胞采集结果的影响61例患者中,其中男性33例、女性28例;年龄≤60岁58例,年龄>60岁3例。患者性别和年龄对CD34+细胞数及CD34+细胞采集成功率均无显著性影响(均P>0.05,表2)。
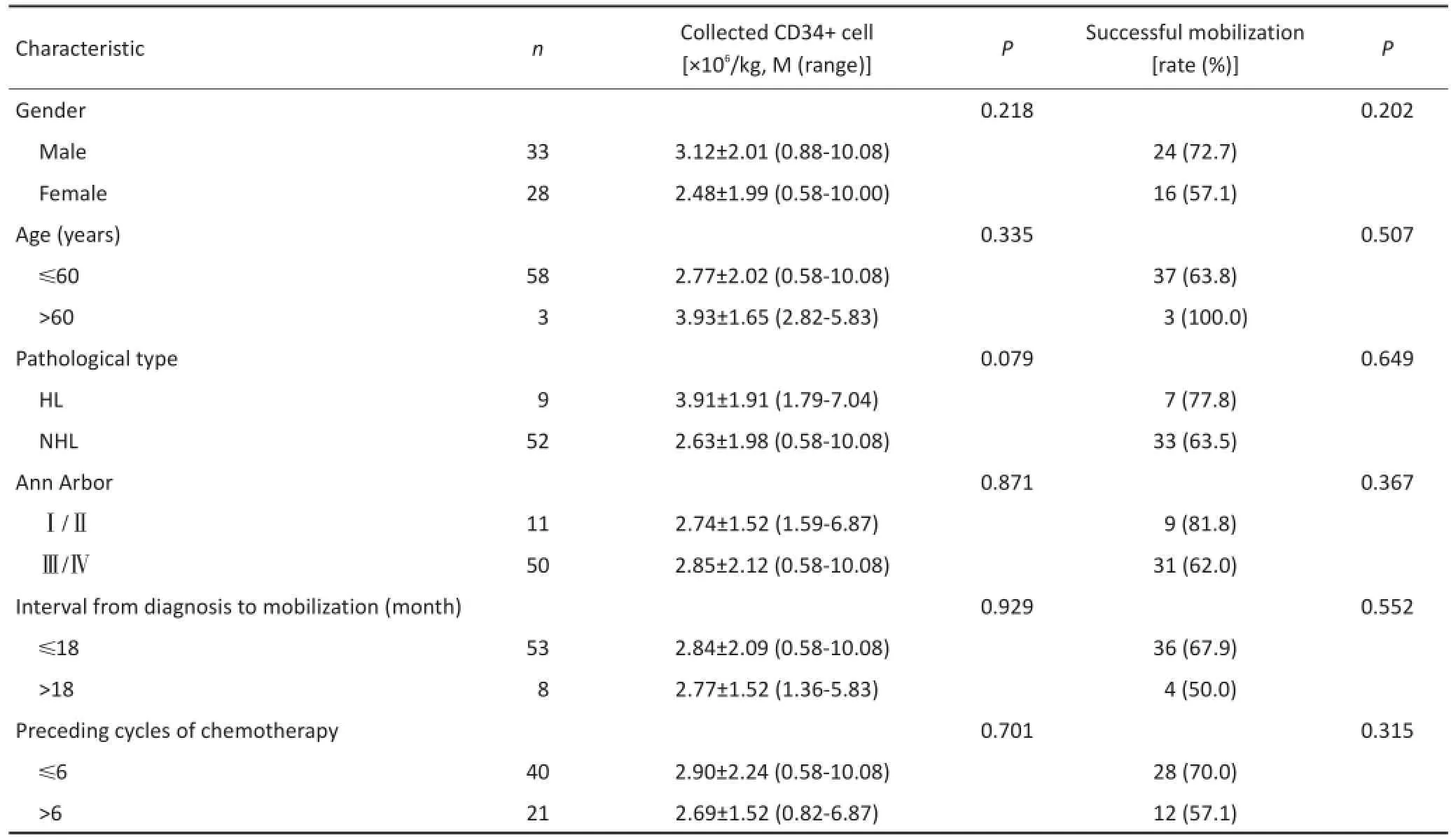
表2 各因素对CD34+细胞采集结果的影响Table2 Effect of different factors on the result of CD34+cell collection
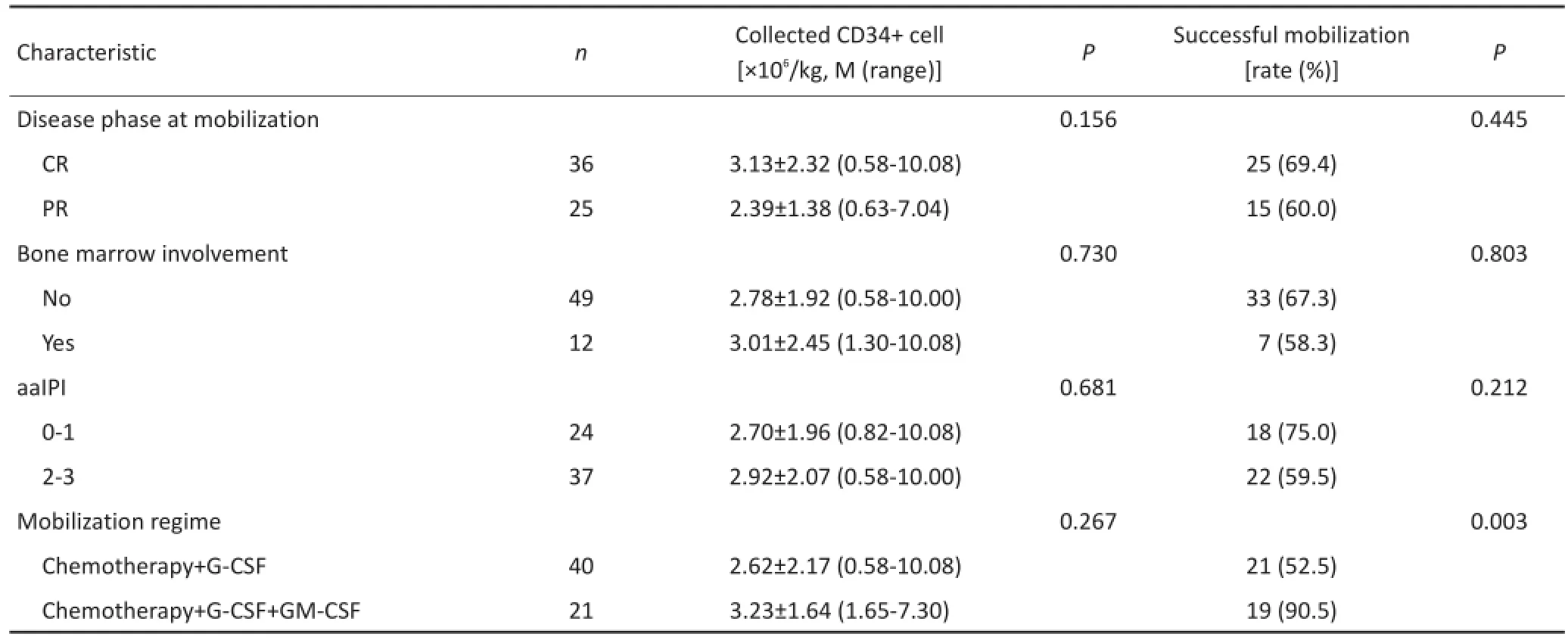
表2 各因素对CD34+细胞采集结果的影响(续表2)Table2 Effect of different factors on the result of CD34+cell collection
2.2.2 病理类型和分期对CD34+细胞采集结果的影响在61例患者中HL 9例,NHL 52例;Ann Arbor分期Ⅰ/Ⅱ期11例,Ⅲ/Ⅳ期50例。NHL与HL之间,NHL各病理类型以及不同分期之间CD34+细胞采集数及CD34+细胞采集成功率相比较,差异均无统计学意义(均P>0.05,表2)。
2.2.3 确诊到动员间隔时间和动员前化疗次数对CD34+细胞采集结果的影响确诊到动员间隔时间≤18个月为53例,>18个月为8例;动员前化疗次数≤6次为40例,>6次为21例。确诊到动员间隔时间和动员前化疗次数对CD34+细胞采集数及CD34+细胞采集成功率均无显著性差异(均P>0.05,表2)。
2.2.4 动员前疾病缓解状态,骨髓受累与否,aaIPI评分对CD34+细胞采集结果的影响61例淋巴瘤患者中,动员前CR为36例,PR为25例;骨髓受累12例,骨髓无受累49例;aaIPI评分0~1分为24例,2~3分为37例(表1)。比较各组患者所获得CD34+细胞数及CD34+细胞采集成功率,差异均无统计学意义(均P>0.05,表2)。
2.2.5 动员方案对CD34+细胞采集结果的影响61例患者中,化疗+G-CSF组40例,化疗+G-CSF+GM-CSF组21例。化疗+G-CSF+GM-CSF组患者采集成功率明显优于化疗+G-CSF组(90.5%vs.52.5%,P=0.003,表2)。2.3不良反应及合并症
全部患者未发生移植相关死亡。动员期间3例患者采集前有肌肉酸痛、骨骼胀疼感,4例伴有头痛,但可耐受,1例患者出现皮肤散在出血点,4例患者体温升高,1例患者合并轻微肺感染,2例有轻度腹泻,几乎所有患者均出现不同程度恶心、呕吐、食欲减低、乏力症状,给予对症支持及抗感染治疗后上述症状均消失。
2.4APBSCT后造血功能重建、发热及应用抗生素情况
所有患者移植后均获得造血重建,且不同动员方案之间相比较,回输后发热时间、回输后抗生素应用时间、造血重建时间差异均无统计学意义(均P>0.05,表3)。
2.5 采用不同预处理方案患者APBSCT后造血功能重建、发热及抗生素应用情况
不同预处理方案患者均获得移植成功,不同预处理方案之间中性粒细胞恢复至0.5×109/L的天数有差异趋势(P=0.064),而采用改良TBI/CY作为预处理方案的患者中性粒细胞恢复至0.5×109/L的天数明显长于采用BEAM或CBV作为预处理方案的患者(P值分别为0.037和0.006),采用BEAC作为预处理方案的患者中性粒细胞恢复至0.5×109/L的天数明显长于采用CBV作为预处理方案的患者。血小板恢复至20×109/L的天数、回输后发热持续天数及回输后抗生素应用持续天数在不同预处理方案之间未见显著性差异(均P>0.05)。同时各组之间不良反应亦未见显著性差异,且不良反应均在可控制范围之内(表4)。

表3 61例淋巴瘤患者不同动员方案APBSCT造血功能重建、发热及抗生素应用的差异性比较Table3 Hematopoietic reconstruction,fever,and antibiotic use in 61 patients with lymphoma:comparison of APBSCT
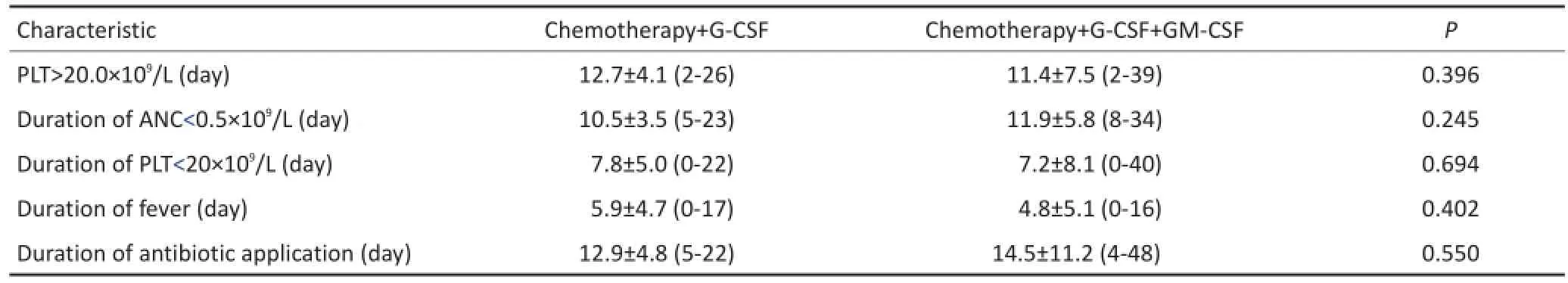
表3 61例淋巴瘤患者不同动员方案ASCT造血功能重建、发热及抗生素应用的差异性比较(续表3)Table3 Hematopoietic reconstruction,fever,and antibiotic use in 61 patients with lymphoma:comparison of APBSCT
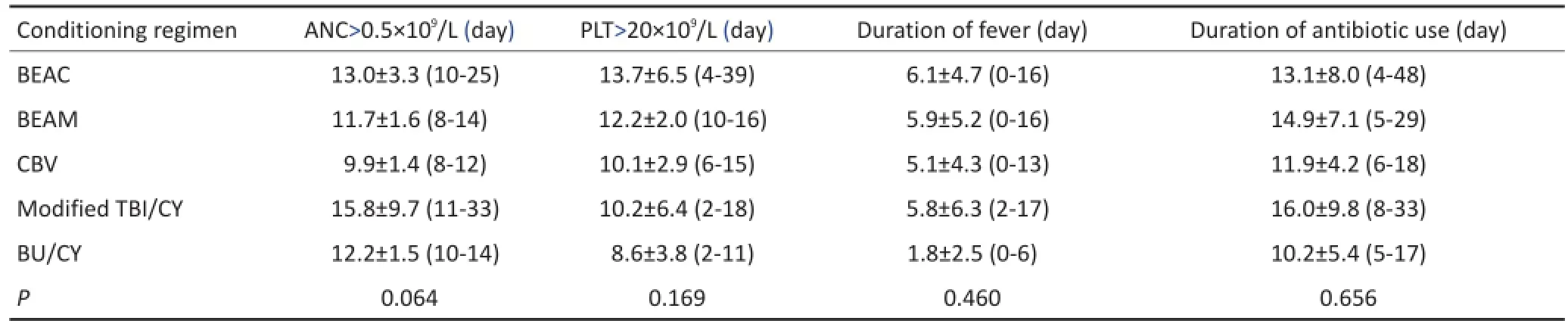
表4 不同预处理方案患者间APBSCT后造血功能重建、发热及抗生素应用的差异性比较Table4 Hematopoietic reconstruction,fever,and antibiotic use after APBSCT with different conditioning regimens
3 讨论
大剂量化疗后联合细胞因子是目前临床上主要的外周血造血干细胞动员方法。大剂量化疗后,正常造血细胞受到破坏,骨髓造血功能被一过性抑制,骨髓平衡被打破,骨髓抑制期后反馈性造血活跃,骨髓造血系统对动员剂的反应大大增强,从而增加造血干细胞输出数量。同时,化疗也可能导致正常的骨髓-血屏障被破坏,干细胞更易释放入外周血。在造血干细胞增殖阶段,G-CSF通过与其受体相互作用,影响表面黏附分子的表达及功能,下调骨髓微环境中内皮细胞黏附分子的表达,选择性或特异性地刺激造血干细胞增殖和分化,最终达到干细胞动员目的[5]。目前,APBSCT仍为治疗恶性淋巴瘤的有效手段,即在患者治疗的特定时期采集自体外周血造血干细胞经体外保存及特殊处理后,当患者接受超大剂量放、化疗后予以回输以促进其造血系统的恢复和重建。动员采集足够的CD34+细胞是APBSCT治疗的关键,研究认为输注CD34+细胞数≥2×106/kg是进行单次APBSCT较为安全的界限值[6-7]。但有5%~46%的患者进行自体外周血采集时不能达到移植所需细胞量。因为动员到采集的过程环节众多,影响因素复杂,目前并没有建立标准或最佳的动员方案及流程[8]。研究表明,增加输注CD34+细胞数不仅能缩短移植后中性粒细胞、血小板植入时间,而且可能获得更好的总生存(overall survival,OS)[9]。本研究根据Mayo Clinic标准[10],将获得CD34+细胞数≥2×106/kg定义为采集成功,反之定义为采集失败。
本研究分析结果发现,除动员方案对CD34+细胞采集数及CD34+细胞采集成功率的影响有显著性差异外,性别、年龄、病理类型、Ann Arbor分期、确诊到动员间隔时间、动员前化疗次数、动员前疾病缓解状态、骨髓受累与否和aaIPI评分等对干细胞采集数量影响并不显著。有研究提示年龄可能影响干细胞采集成功率,这是因为老年患者自身骨髓储备较年轻人差,加上化疗所致的骨髓抑制,造血重建更慢,造成干细胞的动员采集更加困难[11-12]。因此,对于老年患者,要慎重选择APBSCT治疗。年龄≥60岁的患者,可能需要2次动员采集。因此,首次动员采集宜尽早进行。然而,本研究并未发现年龄对CD34+细胞采集具有显著影响。
对同一种化疗方案联合不同细胞因子对于干细胞采集的影响鲜有报道分析。本研究发现,化疗+GCSF+GM-CSF组采集CD34+细胞成功率明显优于化疗+G-CSF组(P=0.003)。可能因为GM-CSF可以改变移植物细胞组分,联合G-CSF可高效地动员干细胞,具体机制仍未明确。然而,移植成功率、中性粒细胞植入时间、血小板植入时间、移植相关不良反应在两组之间均未见显著性差异。Stadtmauer等[13]联合应用G-CSF和GM-CSF动员PBSC,测定CFU-GM和CD34+细胞的基础含量,分别与单用G-CSF和单用GM-CSF进行对比,结果G-CSF组和GM-CSF组的CFU-GM含量均增加24~31倍,而GCSF+GM-CSF联合应用组CFU-GM含量可增加68~80倍。提示G-CSF和GM-CSF对造血祖细胞的增殖有协同作用。Lane等[14]研究也显示,G-CSF+GM-CSF联合组比单用G-CSF组可有效地收集CD34+细胞和CFU-GM,同时还证明可动员更多早期干细胞。然而,韩晓苹等[15]研究发现,化疗联合G-CSF+GM-CSF动员方案与化疗联合G-CSF动员方案比较,MNC、CD34+细胞数及造血重建均无明显差别。至于移植后造血重建,化疗+G-CSF组与化疗+G-CSF+GM-CSF组比较差异并无统计学意义。两组中性粒细胞重建时间为12.7 d和12.2 d(P=0.655),两组血小板重建时间分别为12.7 d和11.4 d(P=0.396)。两组干细胞回输后发热持续时间及抗生素应用天数亦差异无统计学意义(P>0.05)。移植后全部患者未因造血重建时间延长,甚至植入失败发生严重感染和致命性出血。
通过本次回顾性研究可以发现,对于淋巴瘤患者而言,化疗+G-CSF+GM-CSF方案动员CD34+细胞产率虽然明显高于化疗+G-CSF,但是移植成功率、中性粒细胞恢复时间、血小板恢复时间以及不良反应在统计学上均无显著性差异,由于自体移植的终极目的是增加移植成功率和减少移植相关不良反应,本研究并未在这些方面显示出明显差异。因此,本研究认为化疗+G-CSF+GM-CSF动员方案并未优于化疗+G-CSF动员方案。但由于影响干细胞采集因素众多,还需要不断总结和摸索,以及进行更多的前瞻性研究,以便早期发现并识别干细胞动员采集可能失败的人群,第一时间发起补救治疗,从而增加成功采集的概率。本研究为回顾性研究,数据上可能不太均衡,因此在结论的可靠性方面还亟待进一步的前瞻性对照研究验证。
[1]Milpied N,Ifrah N,Kuentz M,et al.Bone marrow transplantation for adult poor prognosis lymphoblastic lymphoma in firstcomplete remission[J].Br J Haematol,1989,73(1):82‐87.
[2]Rapoport AP,Liffon R,Constine LS,et al.Auto‐transplantationfor re‐lapsed or refractory non‐Hodgkin's lymphoma(NHL):long‐term fol‐low‐up and analysis ofprognostic factors[J].Bone Marrow Trans‐plant,1997,19(9):883‐890.
[3]Stiff PJ,Unger JM,Cook JR,et al.Autologous transplantationas con‐solidation for aggressive non‐Hodgkin's lymphoma[J].N Engl J Med,2013,369(18):1681‐1690.
[4]Nagle SJ,Woo K,Schuster SJ,et al.Outcomes of patients withre‐lapsed/refractory diffuse large B‐cell lymphoma with progression of lymphoma after autologous stem cell transplantation inthe ritux‐imab era[J].Am J Hematol,2013,88(10):890‐894.
[5]Hopman RK,Dipersio JF.Advances in stem cell mobilization[J]. Blood Rev,2014,28(1):31‐40.
[6]Wuchter P,Ran D,Bruckner T,et al.Poor mobilization of hematopoietic stem cells‐definitions,incidence,risk factors,and impact on outcome of autologous transplantation[J].Biol Blood Marrow Transplant,2010, 16(4):490‐499.
[7]Jang JE,Cheong JW,Kim SJ,et al.Selection of a mobilization regi‐ men for multiple myeloma based on the response to induction therapy:granulocyte‐colony stimulating factor(G‐CSF)alone ver‐sus high‐dose cyclophosphamide plus G‐CSF[J].Leuk Lymphoma, 2016,57(6):1389‐1397.
[8]Duong HK,Savani BN,Copelan E,et al.Peripheral blood progenitor cell mobilization for autologous and allogeneic hematopoietic cell transplantation:guidelines from the American Society for Blood andMarrow Transplantation[J].Biol Blood Marrow Transplant,2014, 20(9):1262‐1273.
[9]Stiff PJ,Micallef I,Nademanee AP,et al.Transplanted CD34(+)cell dose is associated with long‐term platelet count recovery following autologous peripheral blood stem cell transplant in patients with non‐Hodgkin lymphoma or multiple myeloma[J].Biol Blood Mar‐row Transplant,2011,17(8):1146‐1153.
[10]Gertz MA,Wolf RC,Micallef IN,et al.Clinical impact and resource utilization after stem cell mobilization failure in patients with multi‐ple myeloma and lymphoma[J].Bone Marrow Transplant,2010,45 (9):1396‐1403.
[11]Wang GR,Chen WM,Li YC,et al.A retrospective analysis of autolo‐gous peripheral blood hematopoietic stem cell mobilizations and collections in 149 multiple myeloma patients[J].Chin J Hematol, 2015,36(5):367‐371.[王国蓉,陈文明,李燕郴,等.149例多发性骨髓瘤患者自体外周血造血干细胞动员采集的回顾性分析[J].中华血液学杂志,2015,36(5):367‐371.]
[12]Sun W,Gao M,Xie R,et al.Analysis of factors influencing peripheral blood stem cell collection of 151 lymphoma cases[J].J Exp Hema‐tol,2016,24(2):416‐421.[孙巍,高敏,谢嵘,等.151例淋巴瘤外周血造血干细胞采集影响因素分析[J].中国实验血液学杂志,2016,24 (2):416‐421.]
[13]Stadtmauer EA,Schneider CJ,Silberstein LE,et al.Peripheral blood progenitor cell generation and harvesting[J].Semin Oncol,1995, 22:291‐300.
[14]Lane TA,Law P,Maruyama M,et al.Harvesting and enrichment of hematopoietic progenitor cells mobilized into the peripheral blood of normal donors by granulocyte‐macrophage colony‐stimulating factor(GM‐CSF)or G‐CSF:potential role in allogeneic marrow transplantation[J].Blood,1995,85:275‐282.
[15]Han XP,Zhang BL,Lou FD,et al.Comparison of efficacy between chemotherapy+G‐CSF and chemotherapy+G‐CSF+GM‐CSF in mobili‐zation of peripheral blood progenitor cells(PBSC)and engraftment [J].J Chin PLA Postgraduate Medi School,2000,21(3):229‐232.[韩晓苹,张伯龙,楼方定,等.化疗+G‐CSF与化疗+G‐CSF+GM‐CSF动员外周血干细胞效果和造血功能重建的对比观察[J].军医进修学院学报,2000,21(3):229‐232.]
(2016‐12‐20收稿)
(2017‐03‐14修回)
(编辑:孙喜佳校对:杨红欣)
Clinical analysis of autologous peripheral blood hematopoietic stem cell mobilization regimen in 61 lymphoma patients
Chaoyu WANG,Bing XIA,Wen XU,Chen TIAN,Haifeng ZHAO,Hongliang YANG,Zhigang ZHAO,Xiaofang WANG,Yafei WANG,Yong YU, Yizhuo ZHANG
Department of Hematology,Tianjin Medical University Cancer Institute and Hospital;National Clinical Research Center for Cancer;Key Laboratory of Cancer Prevention and Therapy,Tianjin;Tianjin's Clinical Research Center for Cancer;Tianjin 300060,China
Yizhuo ZHANG;E‐mail:yizhuozhang111@163.com
Objective:To compare the efficacy between chemotherapy with granulocyte colony‐stimulating factor(G‐CSF)and chemo‐therapy with G‐CSF and granulocyte‐macrophage colony‐stimulating factor(GM‐CSF)for the mobilization of peripheral blood hemato‐poietic stem cells and hematological recovery post‐transplantation in patients with malignant lymphoma.Methods:Autologous pe‐ripheral blood hematopoietic stem cell mobilization data of 61 malignant lymphoma patients who were treated with chemotherapy plus G‐CSF or chemotherapy plus G‐CSF and GM‐CSF from May 2008 to October 2016 were included in this study.The mobilization effi‐cacy and hematopoietic recovery were analyzed.Results:During mobilization,White blood cells(WBC)of all patients decreased to 1.0×109/L and platelets(PLT)dropped to 40×109/L.The successful mobilization rates of CD34+cell are 52.5%in chemotherapy plus G‐CSF group and 90.5%in chemotherapy plus G‐CSF+GM‐CSF group(P=0.003).All patients successfully underwent hematopoietic recon‐struction without transplantation‐related mortality.Conclusion:Although chemotherapy with G‐CSF+GM‐CSF can significantly in‐crease the effect of autologous peripheral blood hematopoietic stem cell mobilization,the reconstruction of hematopoietic function after transplantation and side reaction between the two groups are the same.Thus,chemotherapy with G‐CSF+GM‐CSF is not superior to chemotherapy with G‐CSF in mobilizing autologous peripheral blood hematopoietic stem cells.
malignant lymphoma,autologous peripheral blood stem cell transplantation,mobilization,granulocyte colony‐stimulating factor,granulocyte‐macrophage colony‐stimulating factor

10.3969/j.issn.1000-8179.2017.08.442
王超雨专业方向为血液系统肿瘤的内科治疗。E-mail:wangchaoyu1990@126.com
天津医科大学肿瘤医院血液科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心(天津市300060)*本文课题受国家自然科学基金项目(编号:81600163、81570201)资助
张翼鷟yizhuozhang111@163.com
This work was supported by the National Natural Science Foundation of China(No.81600163 and 81570201)
