肿瘤相关性低磷骨软化病的诊断和治疗
2017-05-16段亮弓立群刘军李勇段大鹏李伟伟
段亮,弓立群,刘军,李勇,段大鹏,李伟伟
(陕西省人民医院骨外一科,陕西 西安 710068)
肿瘤相关性低磷骨软化病的诊断和治疗
段亮,弓立群,刘军,李勇,段大鹏,李伟伟
(陕西省人民医院骨外一科,陕西 西安 710068)
目的 分析、探讨肿瘤相关性低磷骨软化病(tumor induced osteomalacia,TIO)患者的临床特点、诊断及外科治疗,提高对该病的认识。方法 分析8例TIO患者的临床资料和实验室及影像学检查特点,其中男5例,女3例,年龄32~54岁,平均(43±7)岁,病程(115±85)个月。结果 8例患者均符合低磷骨软化的临床诊断,均成年起病;低血磷,尿磷水平高,血钙正常偏低水平,碱性磷酸酶升高,甲状旁腺激素基本正常。奥曲肽显像有1例阴性,7例提示生长抑素受体高表达。2例行CT检查,6例行MRI检查,2例行彩超检查,2例行全身骨扫描检查,4例行PET-CT检查。明确定位后行手术治疗,术后病理明确诊断。结论 TIO有典型的临床特点,明确TIO肿瘤部位是外科治疗的前提,奥曲肽显像结合超声、CT及MRI有助于肿瘤的发现和定位,完整手术切除肿瘤是治疗的关键。
肿瘤相关性低磷骨软化病;外科诊断;手术治疗
低磷骨软化症是由于低磷血症和活性D生成不足造成的以骨骼矿化不良、骨软化或佝偻病为主要特征的一组疾病。临床上有3种类型:X连锁显性遗传低磷软骨病(X-chain of low blood phosphorus rickets,XLH)、常染色体显性遗传低磷骨软骨病(autosomal dominant hereditary low phosphorus rickets,ADHR)、肿瘤相关性低磷骨软化病(tumor induced osteomalacia,TIO)[1]。TIO是由于肿瘤引起肾脏排磷增加而造成的获得性低血磷性骨软化症,需与甲状旁腺功能亢进、范可尼综合征、X伴抗维生素D低磷性佝偻病等疾病鉴别。临床表现为骨质疏松、乏力、骨痛,严重者可出现肢体及身高短缩、牙齿脱落、骨折(尤以四肢及脊柱)、骨骼畸形,生化特点为血磷降低,碱性磷酸酶升高,尿磷排出增多,血钙基本正常,血1,25(OH)2D3水平降低或正常,甲状旁腺激素水平基本正常。但迄今为止,临床医生对TIO认识不足,误诊颇多。因此,收集确诊为TIO的8例患者临床资料,分析其临床、实验室及影像学检查特点,以提高对此病的认识和外科治疗水平。
1 资料与方法
1.1 一般资料 本组共8例,为2012年3月至2014年7月我院骨外科诊断的TIO患者7例及外院回顾性资料分析1例,生化检查及术后病理支持低磷骨软化症诊断。肿瘤切除术后血磷不同程度升高,患者不适症状在2周~3个月有明显改善。其中男5例,女3例,年龄32~54岁,平均(43±7)岁,病程(115±85)个月。临床表现:骨痛(尤以四肢关节及腰背部)、双下肢无力、下地自理困难、身高变矮、病理性骨折、关节变形、胸廓畸形、牙齿脱落。肿瘤部位:位于股骨头内3例,股骨大转子2例,外踝1例,胫骨中段1例,胫前肌-腓骨长肌间1例。病理回报:6例符合磷酸盐尿性间叶性肿瘤,其中1例局部生长活跃,提示低度恶性;1例骨髓腔内增生;1例骨髓腔内被脂肪组织取代(见表1)。

表1 8例患者一般情况、病变部位及病理诊断±s)
1.2 辅助检查
1.2.1 实验室检查 手术前血磷(0.46±0.17)mmol/L,碱性磷酸酶(303.43±160.43)U/L。手术后第3天血磷开始增高,至术后等7天血磷恢复至(1.69±2.03)mmol/L(正常值0.97~1.61 mmol/L)。术后碱性磷酸酶恢复至正常范围。
1.2.2 影像学检查 8例患者均行锝-99 m标记奥曲肽显像(99T cm-OCT)检查(见表1);其中3例患者为再次明确部位行MRI或增强检查,2例行全身骨扫描,2例行彩超检查(位于软组织肿瘤),4例行PET-CT检查。
1.2.3 手术方法 编号1在全麻下行左侧人工全髋关节置换术、左股骨中上段截骨矫形、锁定钢板内固定术;编号2在硬膜外麻醉下行右侧胫骨中段肿瘤刮除术、打压植骨术;编号3、4在硬膜外麻醉下行右侧人工股骨头置换术;编号5在硬膜外麻醉下行左侧股骨大转子骨肿瘤刮除术;编号6在硬膜外麻醉下行左小腿中上1/3肌层下方内实性结节切除术;编号7在硬膜外麻醉下行右外踝病灶刮除植骨内固定术;编号8在硬膜外麻醉下行左股骨大粗隆肿瘤刮除活检术。
2 结 果
8例患者均符合低磷骨软化的临床诊断。均成年起病;低血磷,尿磷水平高,血钙正常偏低水平,碱性磷酸酶升高,甲状旁腺激素基本正常。奥曲肽显像有1例阴性,7例提示生长抑素受体高表达,2例行CT,6例行MRI,2例行彩超检查,2例行全身骨扫描检查,4例行PET-CT检查,明确定位后行手术治疗,术后病理诊断:6例符合磷酸盐尿性间叶性肿瘤,其中1例局部生长活跃,提示低度恶性;1例骨髓腔内增生;1例骨髓腔内被脂肪组织取代。
编号6患者术后第1天出现左足背伸、踇指背伸肌力减弱(2级),左足针刺觉无变化,1周后给予针灸及高压氧、营养神经等治疗,于术后3个月肌力恢复至4级; 8例患者肿瘤切除术后当天血磷变化不明显;术后第3天开始有上升趋势,但期间有波动,术后7~10 d血磷趋于稳定。ALP均恢复至正常;全身骨痛明显缓解。编号8患者因左侧大粗隆占位区域大,考虑切除范围广泛,严重影响臀中肌、梨状肌等外旋肌群的止点,术中在间室内操作,未根治,手术区域大,告知患者术后继续行微创电灼灭活肿瘤细胞治疗。目前随访1~4年所有患者暂无复发,有2例患者血磷监测期间有降低,通过口服中性磷后恢复至正常范围。
典型病例为一48岁女性患者,以“进行性骨痛18年,身高变矮15 cm,牙齿脱落6颗”入院,术前影像学资料示左股骨头负重区有高密度影,左股骨近端有成角畸形,行THA及近端成角畸形矫形锁定钢板钢丝捆绑术,手术前后影像学资料见图1~3。
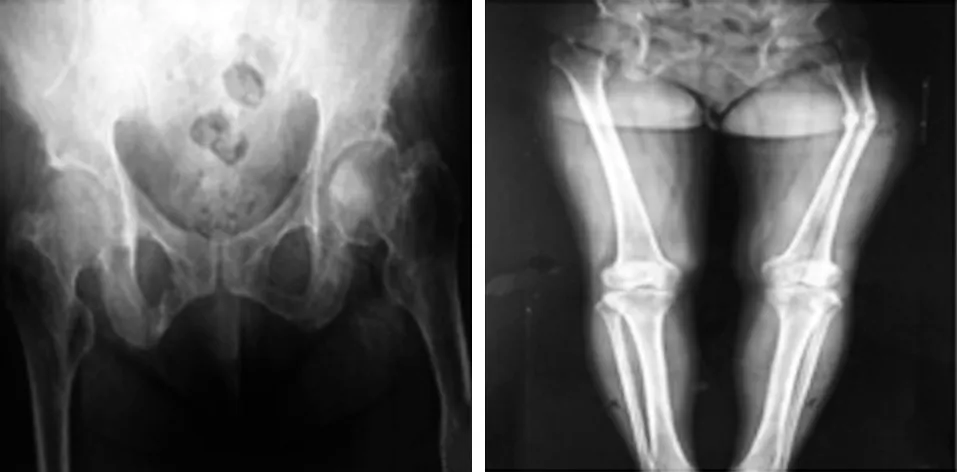
图1 术前X 线片提示左股骨头负重区有高密度影,左股骨近端有成角畸形

图2 术前MRI示左侧股骨头负重区T2像有高低不均匀混合信号影,T1像左股骨头负重区低信号影

图3 THA及近端成角畸形矫形锁定钢板钢丝捆绑术后X线片
3 讨 论
3.1 发病机制 TIO致病机制现在仍然停留在假说,大多数学者认为是一种由于肿瘤分泌调磷因子(phosphatonin)引起肾脏磷丢失增加造成的获得性代谢性骨病。其中研究最为广泛的纤维细胞生长因子23(fibroblast growth factor-23,FGF-23),被认为具有降磷素特性,在TIO肿瘤上过度表达,其主要通过调节近端肾小管钠-磷共转运蛋白Ⅱa(NaPi Ⅱa)及影响1-α羟化酶功能而影响磷的重吸收和维生素D治疗抵抗。FGF-23为TIO患者术前肿瘤的定位提供可靠的依据,并尽量减少多发肿瘤遗漏。其他研究集中在人细胞外基质磷酸糖蛋白(matrix extracellular phosphoglycoprotein,MEPE)和弯曲相关蛋白4(frizzledrelated protein-4,FRP-4),这两种蛋白通道也具有降低血磷或致佝偻病作用[2]。因此,FGF-23、MEPE、FRP-4可能就是调磷因子[3-4]。
3.2 临床特点 临床表现为骨质疏松、乏力、骨痛、身高变矮、病理性骨折(往往未骨折前就来就诊)、骨骼畸形,生化特点为低血磷、尿磷排泄增加、低1,25-(OH)2D3水平或正常。Mc Cance等[5]报道TIO肿瘤切除术后,血磷逐渐增高或维持一水平一段时间后增高至正常,症状明显改善。本组病例经过手术切除后症状减轻,同时血磷恢复正常,与MaCance报道相符合。
3.3 病理类型 TIO的肿瘤大部分来自间叶组织[6-7],以血管瘤或血管内皮瘤多见,达50%以上。其次是纤维瘤或纤维肉瘤。肿瘤多为良性,体积小,生长隐蔽而缓慢,只有1%为恶性,以前列腺癌多见。本组病例的病理类型均为间叶组织来源,未发现其他病理类型。
3.4 定位诊断 对于TIO,术前应常规行奥曲肽显像检查,但并不是所有TIO患者该检查为阳性,据文献报道阳性率在80%左右,本报道病例也证实了这一点。Reubi等[8]1996年报道多种间叶组织来源的肿瘤可有生长抑素受体存在,因此可以使用生长抑素受体显像来寻找骨软化的肿瘤。奥曲肽是生长抑素类似物,可与生长抑素受体结合,用于生长抑素受体显像。此种方法为本病的肿瘤寻找提供了很大帮助,显著提高了疾患的定位诊断率,其有效性已被证实[9]。奥曲肽显像是一种敏感性好,特异性稍差的方法。本研究显示,对于肌肉等软组织层中的肿瘤,超声无疑是一种非侵入性筛查理想的检查方法,也同样可以为我们手术定位提供指导,特别在手术操作过程中无法明确肿瘤时,可以进行超声探查。CT及三维重建对致病肿瘤的发现和定位具有一定价值,尤其是TIO(位于骨)肿瘤三维重建,对术前明确肿瘤范围与周围组织关系有很好的指导意义。有文献报道,68Ga-DOTA PET检查诊断TIO阳性率更高,表明68Ga-DOTA PET对于TIO肿瘤的敏感性更高,是一种更有效的方式。因本研究中患者的经济条件有限,并未全部行PET-CT检查。
3.5 治疗和预后 无论肿物性质,本病均以手术切除为主。从本研究中我们发现大部分患者病灶位于负重区域,我们未发现原因,这是我们今后积累病例研究的重点。编号8患者未给予一期手术根治治疗,但术后辅助局部微创电灼治疗,随访未见复发,为我们临床治疗TIO肿瘤提供了一种新的治疗方法。
本组研究对象在肿瘤切除后血磷迅速纠正[10],随访至今血磷未出现明显降低,且临床症状得到了有效缓解,低磷血症可不治而愈。临床中往往存在因无法定位找到引起骨软化的肿瘤,无法行手术治疗,只能以药物治疗终生补充中性磷(每次20 mL,1次/4 h)和1,25-(OH)2D3,维持血钙磷在一定水平[11]。
[1]White KE,Larsson TM,Econs MJ.The roles of specific genes in plicated as circulating factors involved in normal and disordered phosphate homeostasis FRP-4,MEPE,FGF23[J].Endocri Rev,2006,27(3):221-241.
[2]De Beur SM,Finnegan RB,Vasailiadis J,et al.Tumors associated with oncogenic osteomalacia express genes important in bone and mineral metabolism[J].J Bone Miner Res,2002,17(6):1102-1110.
[3]Berndt TJ,Schiavi S,Kunnar R.Phosphatonins and the regulation of phosphorus homeostasis[J].Am J Physiol Renal Physio,2005,289(6):1170-1182.
[4]姜艳,夏维波,孟迅吾,等.FGF23、MEPE和sFRP4在肿瘤性骨软化症发病机制中的作用[J].基础医学与研究,2009,29(5):504-509.
[5]McCance RA.Osteomalacia with Looser’s nodes(Milkman syndrome)due to a raised resistance to vitamin D acquired about the age of 15 years[J].OJ Med,1947,16:332-347.
[6]Drezner MK.Tumor-induced osteomalacia[J].Rev Endocr Metab Disord,2001,13(5):175-186.
[7]Folpe Al,Fanburg Smith JC,Billings SD,et al.Most osteomalacia associated mesenchymal tumors are a single histopathologic entity:analysis of 32 cases and a comprehensive review of the literature[J].Am J Surg Pathol,2004,28(21):1-30.
[8]Reubi JC,Waser B,Laissue JA,et al.Somatostatin and vasoactive intesinal peptide receptors;in human mesenchymal tumors in vitro identicationl[J].Cancer Res,1996,56(8):1922-1931.
[9]Jan de Beur SM,Stretten EA,Civelek AC,et al.Localisation of mesenchymal tumours by somatostatin receptor imaging[J].Lancet,2002,59(9308):761-763.
[10]Fureo A,Roger M,Mouchet B,et al.Osteomalacia cured by surgery [J].Eur J Intern Med,2002,13(1):67-69.
[11]Mitchell S,Parker MD,Irwin Klein MD,et al.Tumor-induce dosteomalacia:evidence of a surgical correlatable alternation in vitamin D metabolism[J].JAMA,1981,245(5):492-493.
Diagnosis and Threapy of Tumor Induced Osteomalacia (TIO)
Duan Liang,Gong Liqun,Liu Jun,et al
(1st Surgery Department,People's Hopsital of Shanxi Province,Xi’an 710068,China)
Objective To analyzethe clinical characteristics of tumor induced osteomalacia (TIO).Methods To analyze the clinical data of 8 patients with TIO in laboratory and imaging examination.Results 8 cases of patients were in line with the clinical diagnosis of low phosphorusosteomalacia.All patients were adults adults.They had low blood phosphorus,highurinary phosphorus level,the normal low blood calcium level,elevated alkaline phosphatase,basic normal parathyroid hormone.Octreotide imaging revealed 1 negative case,7 cases with prompt high expression of somatostatin receptor.2 routine CT,6 MRI,2 regular color Doppler ultrasound,2 whole body bone scan,4 PET-CT examinationwere performed.After a clear positioning,surgical treatment were adopted.Postoperative pathological diagnosis were confirmed.Conclusion TIO shows typical clinical characteristics.Clear TIO tumor site is the premise and key of surgical resection,osteomalacia imaging,ultrasound,CT and MRI are valuable for the discovery of the disease and positioning.
tumor induced osteomalacia with low phosphorus;surgical diagnosis;operation treatment
1008-5572(2017)04-0312-04
陕西省自然科学基础研究计划(2016JQ 8052)
R591.44
B
2016-08-04
段亮(1982-),男,主治医师,陕西省人民医院骨外一科 ,710068。
段亮,弓立群,刘军,等.肿瘤相关性低磷骨软化病的诊断和治疗[J].实用骨科杂志,2017,23(4):312-314;332.
