佐米曲普坦-双氯芬酸微乳的制备及体外透皮研究
2017-05-16杨晓艳武汉科技大学附属天佑医院药剂科武汉430064
杨晓艳,易 蕾(武汉科技大学附属天佑医院药剂科,武汉 430064)
佐米曲普坦-双氯芬酸微乳的制备及体外透皮研究
杨晓艳*,易 蕾#(武汉科技大学附属天佑医院药剂科,武汉 430064)
目的:制备佐米曲普坦-双氯芬酸微乳,并进行质量评价和体外透皮研究。方法:以溶解度和伪三元相图中的微乳面积为指标,筛选佐米曲普坦-双氯芬酸微乳的油相种类和混合乳化剂比例;以粒径、Zeta电位、外观形态和稳定性考察微乳的质量,采用高效液相色谱法测定微乳中佐米曲普坦和双氯芬酸的含量,使用透皮扩散试验仪,将2 g微乳涂抹于离体鼠皮角质层,检测24 h内的累积透皮率。结果:微乳处方为油相(辛酸/癸酸甘油三酯)10%、混合乳化剂[聚山梨酯80-苄泽97(1∶1)]25%、1,2-丙二醇8.3%,佐米曲普坦25mg、双氯芬酸1.25 g,水加至100m L。所制微乳的平均粒径为(28.2±2.5)nm,Zeta电位为(-3.25±0.33)mV,外观圆整,室温下放置1个月未见分层或絮凝;佐米曲普坦和双氯芬酸的含量分别为0.248、12.46mg/m L(n=3);24 h累积透皮率分别为80%、75%。结论:制得佐米曲普坦-双氯芬酸微乳,其体外透皮性较好。
佐米曲普坦;双氯芬酸;微乳;伪三元相图;制备;透皮吸收
#通信作者:副主任药师。研究方向:药物制剂与合理用药。E-mail:547576126@qq.com
ABSTRACTOBJECTIVE:To prepare zolmitriptan-diclofenac microemulsion,and conduct quality evaluation and in vitro transdermal study.METHODS:Using solubility and m icroemulsion area in pseudo-ternary phase diagram as indexes,the types of oil phase and mixed emulsifier ratio of zolmitriptan-diclofenac microemulsion were screened;them icroemulsion quality was inspected using particle size,Zeta potential,appearance and stability.HPLC was used to measure the contents of zolm itriptan and diclofenac. Transdermal diffusion test instrumentwas used,2 gm icroemulsion was smeared in cuticle of extracouporeal rats’skin,and cumulative transdermal rate in 24 h was determ ined.RESULTS:Themicroemulsion formulation was as follow as 10%oil phase(octanoic acid triglyceride),25%m ixture emulgator[polysorbate 80-brij 97(1∶1)],8.3%propylene glycol and 25 mg zolm itriptan,1.25 mg diclofenac,and water adding to 100m L.The average particle size of prepared microemulsion was(28.2±2.5)nm,Zeta potential was(-3.25±0.33)mV,the appearance was rounding;them icroemulsion showed no stratification or flocculation at room temperature after placed for 1month.Contents of zolmitriptan and diclofenac were 0.248mg/m L,12.46mg/m L(n=3);24 h cumulative transdermal rateswere 80%,75%.CONCLUSIONS:Zolm itriptan-diclofenac m icroemulsion is prepared,and its in vitro transdermal ability is good.
偏头痛是常见的临床问题,全球患病率达14.7%,目前多给予曲坦类、非甾体抗炎药(NSAID)等进行对症治疗。曲坦类药物是选择性5-羟色胺(5-HT)受体激动药,常以口服及注射剂型用于临床,起效迅速,但是维持时间较短、患者复发率高。佐米曲普坦是目前治疗偏头痛最有效的曲坦类药物之一,在偏头痛治疗过程中,其药效学和安全性方面都表现出令人满意的效果;双氯芬酸为常用的消炎镇痛药,是NSAID类代表药物,其起效慢,但维持时间长。如果将两者组成复方制剂(如Treximet片)则可以取长补短,避免曲坦类的不良反应[1]。但口服剂型存在吸收慢且不规则、维持时间短、会引起恶心症状等使患者难以坚持服用的缺点;而鼻喷剂对鼻腔有刺激作用,并有口苦感,使用不当时药物吸收效果也不理想。微乳作为药物载体,具有低黏度、吸收迅速、靶向释药的特点,并可提高药物的生物利用度,降低毒副作用[2]。为此,笔者研制了佐米曲普坦-双氯芬酸微乳,并对微乳进行大鼠离体皮肤的透皮试验,以促进曲坦类与NSAID的新型经皮给药制剂的开发。
1 材料
1.1 仪器
LC-10Atvp型高效液相色谱仪,包括SPD-10Avp紫外检测器、Class-vp色谱工作站(日本岛津公司);透皮扩散试验仪及扩散池(上海锴凯科技贸易有限公司);3000HS型激光粒度分析仪(英国马尔文仪器有限公限);H2765型透射电子显微镜(日本日立公司);TDL80型高速离心机(上海市离心机厂研究所,离心半径:15 cm);TG-328光学读数分析天平(湘仪天平仪器厂,感量:0.1mg)。
1.2 药品与试剂
佐米曲普坦原料药(成都天台制药厂,批号:20120527,纯度:99.3%);双氯芬酸原料药(湖北兴银河化工有限公司,批号:20140411,纯度:99.1%);佐米曲普坦对照品(上海华拓医药科技有限公司,批号:20100530,纯度:>99.5%);双氯芬酸对照品(中国食品药品检定研究院,批号:100334-200507,纯度:99.3%);佐米曲普坦鼻喷剂(商品名:司兰平,山东京卫制药有限公司,批号:20141010,规格:2.5mg/喷);1%双氯芬酸乳胶剂(商品名:扶他林,北京诺华制药有限公司,批号:20131105,规格:0.2 g/20 g);丙二醇单辛酸酯(Capryol90)、辛酸/癸酸甘油三酯(Labrafac)(法国Gattefosse公司,批号:58748-27、58653-35);苄泽97(南京威尔化工有限公司,批号:20130604,药用级);聚山梨酯80(天津基准化学试剂有限公司,批号:20120510,注射级);大豆油(宜兴市化学试剂厂,批号:20111211,药用级);1,2-丙二醇、正丁醇、95%乙醇、油酸均为药用级;甲醇为色谱纯,水为蒸馏水。
1.3 动物
SD大鼠,♂,体质量(210±5)g,均由湖北省实验动物研究中心提供,动物使用合格证号为SCXK(鄂)2010-0007。
2 方法与结果
2.1 溶解度的测定
取佐米曲普坦、双氯芬酸原料药分别置于具塞离心管中,分别加入8种介质,即水相(蒸馏水)、油相(Capryol90、Labrafac、大豆油)、表面活性剂(聚山梨酯80和苄泽97)、助表面活性剂(1,2-丙二醇和乙醇)2m L,涡旋混合30m in,在50℃水浴中平衡1 h,室温下放置72 h,3 000 r/m in(离心半径:15 cm)离心10m in。取上清液经0.45μm微孔滤膜过滤,用甲醇稀释适宜倍数后,采用高效液相色谱法分别于225 nm和276 nm波长处测定佐米曲普坦、双氯芬酸的含量,计算溶解度,结果见表1。
由表1可知,佐米曲普坦和双氯芬酸在水中溶解度均很小;油相中以在Labrafac中溶解度最大;在2种表面活性剂中溶解度相近;在助表面活性剂中以在1,2-丙二醇中溶解度较大。因此,选择Labrafac为油相、聚山梨酯80-苄泽97(1∶1)为混合乳化剂、1,2-丙二醇为助表面活性剂。
2.2 处方的筛选
精密称取不同处方量(0、25%、50%、75%、100%)的油相(Labrafac),与不同处方量(0、25%、50%、75%、100%)的混合乳化剂[聚山梨酯80-苄泽97(1∶1)]和助表面活性剂(1,2-丙二醇)[混合乳化剂-助表面活性剂比例(Km)分别为1∶1、2∶1、3∶1]混合制备成混合溶液,在搅拌状态下逐渐滴加水。以外观“澄清透明”为指标,记录临界加入量,绘制伪三元相图,以微乳区(阴影区)面积最大为指标筛选处方,结果见图1。
表1 佐米曲普坦和双氯芬酸在不同介质中的溶解度(±s,n=3,μg/m L)Tab 1 Solubility of zolm itriptan and diclofenac in differentmedia(±s,n=3,μg/m L)
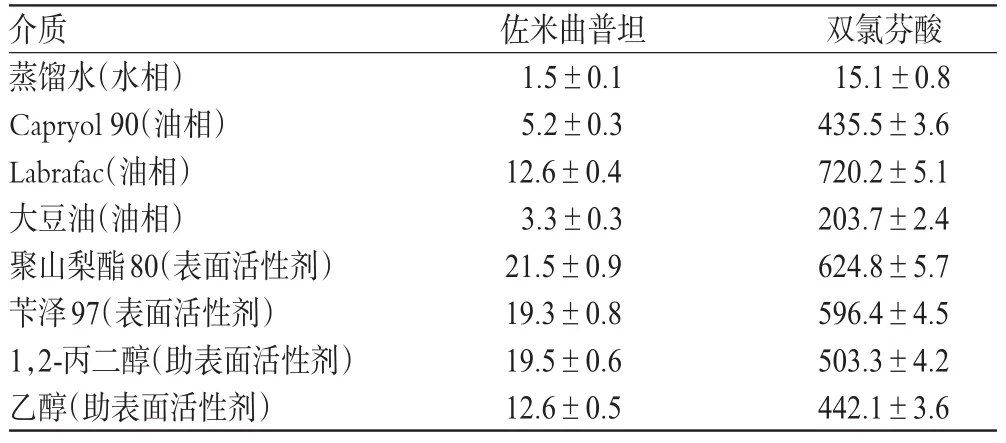
表1 佐米曲普坦和双氯芬酸在不同介质中的溶解度(±s,n=3,μg/m L)Tab 1 Solubility of zolm itriptan and diclofenac in differentmedia(±s,n=3,μg/m L)
介质蒸馏水(水相)Capryol90(油相)Labrafac(油相)大豆油(油相)聚山梨酯80(表面活性剂)苄泽97(表面活性剂)1,2-丙二醇(助表面活性剂)乙醇(助表面活性剂)佐米曲普坦1.5±0.1 5.2±0.3 12.6±0.4 3.3±0.3 21.5±0.9 19.3±0.8 19.5±0.6 12.6±0.5双氯芬酸15.1±0.8 435.5±3.6 720.2±5.1 203.7±2.4 624.8±5.7 596.4±4.5 503.3±4.2 442.1±3.6
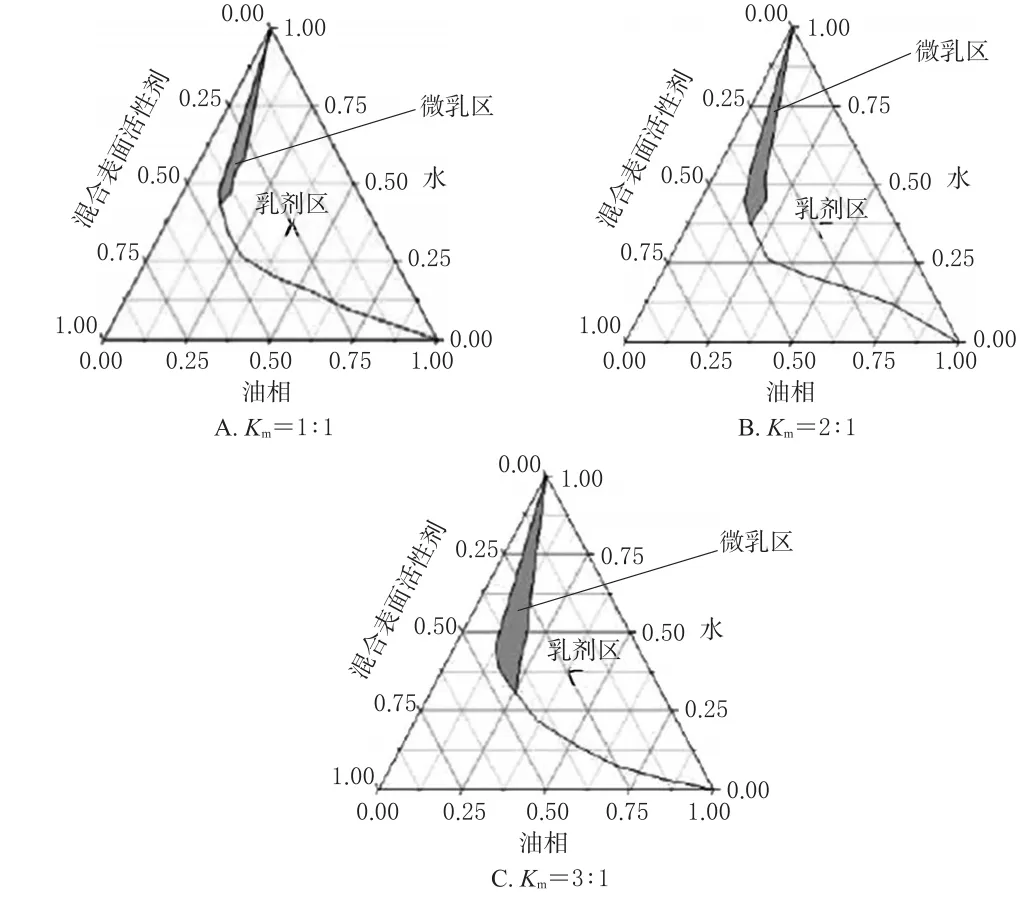
图1 不同配比微乳的伪三元相图Fig 1 Pseudo-ternary phase diagram of m icroemu lsion w ith different ratios
由图1可知,当Km为3∶1,即油相(Labrafac)为10%、混合乳化剂为25%、助表面活性剂为8.3%、水为56.7%时所形成的微乳面积最大,以此确定佐米曲普坦-双氯芬酸微乳的处方组成。
2.3 佐米曲普坦-双氯芬酸微乳的制备
根据“2.2”项下结果确定佐米曲普坦-双氯芬酸微乳的处方为油相(Labrafac)10%、混合乳化剂[聚山梨酯80-苄泽97(1∶1)]25%、助表面活性剂(1,2-丙二醇)8.3%、佐米曲普坦25mg、双氯芬酸1.25 g,水加至100 m L。在室温下按微乳处方(除水外)将各组分充分混合均匀,加入佐米曲普坦和双氯芬酸原料药,100W超声5~10m in溶解,在不断搅拌下缓慢加入适量水至形成透明的微乳液。
2.4 微乳的表征
[3-4]对微乳进行表征。
2.4.1 粒径及Zeta电位测定 取佐米曲普坦-双氯芬酸微乳适量,用激光粒度分析仪测定微乳粒径及Zeta电位。结果显示,佐米曲普坦-双氯芬酸微乳的平均粒径为(28.2±2.5)nm、Zeta电位为(-3.25±0.33)mV,表明该微乳粒径较小、分布均匀,且微乳带负电荷利于微乳的稳定和保存。
2.4.2 外观形态观察 将载有支持膜的铜网置于蜡板上,在膜上分别滴加佐米曲普坦-双氯芬酸微乳和不含佐米曲普坦和双氯芬酸的空白微乳,各1滴,自然晾干30m in,再滴加2%磷钨酸1滴,自然晾干10min,用滤纸吸去多余液体,置于透射电子显微镜下观察。结果显示,该微乳外观圆整,粒径分布均匀。透射电镜图见图2。

图2 透射电镜图Fig 2 Transm ission electronm icrograph
2.4.3 稳定性考察 取佐米曲普坦-双氯芬酸微乳1.0 m L,置于1.5m L离心管中,12 000 r/min(离心半径:15 cm)离心20min,结果该微乳离心后澄清透明、未见分层;将佐米曲普坦-双氯芬酸微乳室温下放置1个月,结果该微乳未见分层或絮凝等现象,表明该微乳稳定性良好(n=6)。
2.5 微乳的含量测定
采用高效液相色谱法测定佐米曲普坦-双氯芬酸微乳中佐米曲普坦和双氯芬酸的含量[5-6]。
2.5.1 混合对照品溶液的制备 精密称取佐米曲普坦对照品10.0mg和双氯芬酸对照品25.0mg,用甲醇溶解后稀释至100m L,制成佐米曲普坦0.1mg/m L、双氯芬酸0.5mg/m L的混合对照品溶液。
2.5.2 色谱条件 色谱柱:C18(250mm×4.6mm,5µm);流动相:0.05%三乙胺水溶液(磷酸调pH 2.7)-乙腈(90∶10,V/V);流速:1.0 m L/m in;检测波长:276 nm;柱温:40℃;进样量:20µL。混合对照品和供试品溶液的色谱图见图3。

图3 高效液相色谱图Fig 3 HPLC chromatogram
2.5.3 方法学考察 按方法学要求进行考察。以质量浓度(c)对峰面积(A)进行回归,得佐米曲普坦和双氯芬酸的回归方程分别为:A=268.35c-44.31(r=0.999 5)、A=121.42c+13.57(r=0.999 1),二者线性范围分别为1.0~100.0、1.0~50.0μg/m L;回收率分别为99.53%、98.46%,RSD分别为1.98%、2.05%(n=3);精密度试验的RSD分别为1.26%、1.52%(n=6);24 h内稳定性试验的RSD分别为1.75%、2.13%(n=3)。
2.5.4 样品的含量测定 取佐米曲普坦-双氯芬酸微乳3份,每份1.0m L,置于10m L量瓶中,加甲醇5.0m L破乳,甲醇定容至刻度,超声5m in,过0.45μm微孔滤膜后,按“2.5.2”项下色谱条件进样测定佐米曲普坦和双氯芬酸的含量。结果显示,3份微乳中佐米曲普坦的质量浓度分别为0.244、0.255、0.246 mg/m L,均值为0.248 mg/m L(RSD=4.91%,n=3),标示百分含量为99.2%;双氯芬酸的质量浓度分别为12.25、12.75、12.38mg/m L,均值为12.46mg/m L(RSD=2.37%,n=3),标示百分含量为99.68%。
2.6 微乳的体外透皮性能考察
采用透皮扩散试验仪法[7],将离体鼠皮固定,角质层面向供给池,真皮层面向接收池,透过面积为2.5 cm2。分别将佐米曲普坦-双氯芬酸微乳2 g、1%双氯芬酸乳胶剂2 g和佐米曲普坦鼻喷剂2m L涂抹于鼠皮角质,在供给池和接收池中加入含10%乙醇的生理盐水18m L,水浴恒温(35±0.5)℃,转速为300 r/min。分别于0.5、1、2、3、4、6、8、10、12、24 h时取接收液0.5m L,同时补加等量等温介质。接收液于10 000 r/m in(离心半径:15 cm)离心10min,测定其中佐米曲普坦和/或双氯芬酸的含量,计算累积透皮率,绘制体外透皮曲线。3种样品中2种成分的体外透皮曲线见图4。

图4 3种样品中2种成分的体外透皮曲线Fig 4 Transdermal curve in vitro of two components in three samp les
由图4可看出,佐米曲普坦-双氯芬酸微乳中佐米曲普坦、双氯芬酸的24 h累积透皮率分别为80%、75%。佐米曲普坦从微乳中释药较快,与佐米曲普坦鼻喷剂类似;而微乳中双氯芬酸释药慢且平缓,与1%双氯芬酸乳胶剂类似。
3 讨论
佐米曲普坦-双氯芬酸微乳中聚山梨酯80和苄泽97属于非离子型表面活性剂,可以促进大多数药物的透皮吸收,且用于皮肤给药被认为是比较安全的,其刺激性小于离子型表面活性剂;1,2-丙二醇也是常用的助表面活性剂[8]。
制备微乳的第一步是确定处方,微乳体系各成分确定后,可通过伪三元相图找出微乳相形成区域,确定微乳成分的用量,然后将各成分按比例混合即可制得微乳。此过程中,各成分的加入顺序不会影响微乳的形成[9]。本试验通过水滴定法绘制微乳伪三元相图,改变微乳中各成分的比例,观察Km值的变化对微乳区域大小的影响,选择形成微乳区域比较大的点设计处方。
佐米曲普坦鼻喷剂(司兰平)在临床应用中是通过鼻黏膜渗透吸收,1%双氯芬酸乳胶剂(扶他林)是通过皮肤表面渗透吸收,与本试验微乳吸收途径相类似[10],所以在透皮试验中笔者选用二者作为对照进行了比较。结果显示,自制佐米曲普坦-双氯芬酸微乳中2种成分的累积透皮率与市售产品均无明显差异。
参考文献
[1] 张莉,栾勇,孙成春.曲坦类药物治疗偏头痛的临床应用进展[J].解放军药学学报,2012,28(6):551-557.
[2] 蔡霞,吕竹芬,陈燕忠.盐酸氟西汀微乳的制备及其离体大鼠透皮作用研究[J].中国药房,2010,21(33):3121-3123.
[3] 张爱武,张友智.卡维地洛鼻用微乳凝胶的制备及性质考察[J].中国药房,2016,27(28):3992-3995.
[4] 范永春,戴薇,李步阳.蟾蜍毒素微乳的制备及体外透皮吸收考察[J].中国实验方剂学杂志,2013,19(21):49-53.
[5] 胡荣,黄华,杜洋,等.佐米曲普坦在不同pH条件下的平衡溶解度和表观油水分配系数[J].重庆医科大学学报,2010,35(8):1235-1237.
[6] Chao L,Liang F.Drug in adhesive patch of zolm itriptan:formulation and in vitro/in vivo correlation[J].Pharm Sci Tech,2015,16(6):1245-1253.
[7] 易蕾,赵瑛.碘化钾微乳的制备及其体外透皮吸收作用考察[J].中国药房,2015,26(13):1830-1833.
[8] 康荣荣,杨苏芳,韩萌,等.微乳在经皮给药系统中的应用[J].中南药学,2014,12(3):253-258.
[9] 徐小燕,邱碧菡,潘林梅.微乳透皮给药载体的制备及透皮影响因素研究进展[J].中国药房,2011,22(37):3528-3530.
[10] 王勤,李华文,彭新生.蛇床子素微乳的制备及其透皮能力的研究[J].中国药房,2010,21(27):2529-2531.
(编辑:邹丽娟)
Preparation and in vitro Transdermal Study of Zolm itriptan-Diclofenac M icroemulsion
YANG Xiaoyan,YI Lei(Dept.of Pharmacy,A ffiliated Tianyou Hospital of Wuhan University of Science and Technology,Wuhan 430064,China)
Zolm itriptan;Diclofenac;M icroemulsion;Pseudo-ternary phase diagram;Preparation;Transdermal absorption
R943;R965
A
1001-0408(2017)13-1841-04
2016-08-16
2016-12-15)
DOI10.6039/j.issn.1001-0408.2017.13.32
*主管药师。研究方向:临床药学与药物制剂。E-mail:321973499@qq.com
