基于肿瘤微环境的纳米靶向载体研究进展
2017-05-16祝星宇马博乐陈雨晴阎雪莹黑龙江中医药大学药学院哈尔滨150000
陈 曦,祝星宇,马博乐,陈雨晴,阎雪莹(黑龙江中医药大学药学院,哈尔滨 150000)
基于肿瘤微环境的纳米靶向载体研究进展
陈 曦*,祝星宇,马博乐,陈雨晴,阎雪莹#(黑龙江中医药大学药学院,哈尔滨 150000)
目的:为纳米靶向载体研制提供参考。方法:以“肿瘤微环境”“纳米靶向载体”“靶向治疗”“pH sensitive”“Enzyme responsive””Redox responsive”等为关键词,组合查询2005-2016年在PubMed、Elsevier、SpringerLink、中国知网、万方、维普等数据库中的相关文献,对肿瘤组织微环境的特点和肿瘤微环境响应性纳米载药系统研究进行综述。结果与结论:共检索到相关文献235篇,其中有效文献39篇。肿瘤组织微环境主要特点包括微酸性、酶代谢异常、细胞内外存在还原性差异、存在影响肿瘤血管生成的因子和信号通路等。基于上述特点,分别研究出基于肿瘤滞留效应设计的纳米载体、pH响应型纳米载体、还原响应型纳米载体、酶响应型纳米载体、温度响应型纳米载体。与这些单响应载体比较,肿瘤微环境多重刺激响应型纳米载体更能充分发挥不同肿瘤微环境响应性物质之间的特点,对实现药物的特异性递送更有意义,这也将是今后的主要研究热点。
肿瘤微环境;纳米载药系统;靶向治疗;环境响应性
近年来,随着对肿瘤微环境的深入研究,人们发现肿瘤微环境是一个低pH值、缺氧并有多种免疫细胞组成的复杂结构[1],对肿瘤的生成、增殖及转移具有重要的调控作用。据此,针对不同的细胞和靶点来设计新型药物载体来对抗肿瘤已经是一种新的策略。常用的肿瘤微环境刺激因子有pH、还原性物质、酶浓度、三磷酸腺苷(ATP)。利用肿瘤微环境的靶向治疗,可以达到广谱、低毒、耐药性小的目的,并且能有效地切断肿瘤细胞与其微环境的相互作用,更高效地抑制肿瘤细胞增殖。笔者以“肿瘤微环境”“纳米靶向载体”“靶向治疗”“pH sensitive”“Enzyme responsive””Redox responsive”等为关键词,组合查询2005-2016年在PubMed、Elsevier、SpringerLink、中国知网、万方、维普等数据库中的相关文献。结果,共检索到相关文献235篇,其中有效文献39篇。现对肿瘤组织微环境的特点和肿瘤微环境响应性纳米载药系统研究进行综述,以期为纳米靶向载体研制提供参考。
1 肿瘤组织微环境的特点
1.1 肿瘤组织微酸环境
正常组织细胞通过线粒体的氧化分解提供细胞所需要的能量,而肿瘤细胞则通过糖酵解途径供能,这个过程称之为“Warburg效应”[2]。肿瘤细胞糖酵解途径产生大量的乳酸,为了维持pH稳定,细胞将乳酸外排,从而产生微酸环境[3-4]。相对于正常组织和细胞外的pH值(7.4),肿瘤组织细胞外环境pH值(6.5~6.8)要低一些,而肿瘤细胞内pH值更低。这种微酸环境为纳米载体研制提供了新的策略[5]。
1.2 肿瘤组织中的酶
肿瘤微环境中包含参与肿瘤发生和发展的酶,根据酶的特点为肿瘤微环境酶响应型药物载体设计提供了新的方法。例如,基质金属蛋白酶(MMP)在肿瘤组织中特异性表达,与肿瘤的侵润和转移有着密切联系。Zhu L等[6]用MMP-2可剪切的短肽(序列为Gly-Pro-Leu-Gly-Ile-Ala-Gly-Gln)与聚乙二醇(PEG)连接,使靶向基团避免网状内皮系统的吞噬,到达肿瘤组织,极大地提高了药物在肿瘤细胞内的积累量。肿瘤药物载体中另一个常用的连接键是可以被溶酶体中组织蛋白酶B(Cat-B)剪切的四肽(Gly-Phe-Leu-Gly)。正常组织中Cat-B在溶酶体中被6-磷酸甘露糖受体识别并活化,而肿瘤组织中Cat-B由于无法进入溶酶体,以酶原形式存在于细胞质或外排至细胞外。处在微酸环境中的Cat-B被激活,从而参与胞外基质的降解和肿瘤细胞的转移。在多种肿瘤模型中均发现,Cat-B的表达量和活性是正常组织中的3~9倍[7]。
1.3 还原环境
由于肿瘤细胞内、外环境具有电位差异,导致肿瘤组织存在一定的还原性,这也为纳米靶向药物载体响应释放提供了另一种方式。细胞内外还原环境的差异主要是因为细胞内某些巯基物质的存在,例如NADPH/ NADP+、硫蛋白和谷胱甘肽等。细胞内多种细胞器,例如胞质溶胶、线粒体和细胞核等,均含浓度非常高的谷胱甘肽(GSH,2~10mmol/L),是细胞外液体和血液中(约2~20 nmol/L)的100~1 000倍[8]。因此,GSH已经被确认为是一种理想的引发药物载体解离和药物快速释放的细胞内刺激元素。在药物载体的中引入“二硫键”是建立GSH响应型药物载体的一种最为常用的方法。将基于双硒键的氧化还原敏感的高分子材料作为载体,该载体在细胞外保持相对稳定,然而在肿瘤细胞内的还原环境的存在下,双硒键发生断裂,导致高分子材料的快速降解和负荷物质的快速释放[9]。
1.4 肿瘤血管生成
肿瘤组织中有许多因子和信号通路,其对血管生成有重要的影响[10]。肿瘤细胞通过在细胞质中生成肿瘤微血管,通过这些微血管,肿瘤细胞与肿瘤微环境之间进行信号传递[11]。殷香保等[12]以PEG-聚乳酸(PLA)为载体包载三氧化二砷(As2O3),并偶联肿瘤血管抑制因子血管内皮生长因子受体2(VEGFR-2),研究荷瘤裸鼠不同组织中药物浓度及肿瘤抑制率。结果发现,药物在不同组织中的分布具有明显差异,肿瘤组织中药物浓度明显高于其他组织;VEGFR-2/As2O3-PEG-PLA组的肿瘤抑制率分别为对照组的2.7倍及As2O3组的2倍。可以看出肿瘤血管的生成是肿瘤微环境的重要特征,探究肿瘤微血管生成诱导和抑制因子,能够为新型纳米靶向载体研究提供新的策略。
2 肿瘤微环境响应性纳米载药系统
2.1 基于肿瘤EPR效应设计的纳米载体
由于正常组织与肿瘤组织血管内皮细胞排列致密程度不同,肿瘤组织的血管内皮细胞间隙大于正常组织,结构完整性差并且淋巴回流缺失,会造成大分子物质在肿瘤组织具有选择性的高通透性和滞留性,这种现象称为EPR效应。EPR效应,即实体瘤的高通透性和滞留效应,指的是相对于正常组织,某些尺寸的分子或颗粒更趋向于聚集在肿瘤组织的性质。肿瘤组织存在EPR效应见图1。
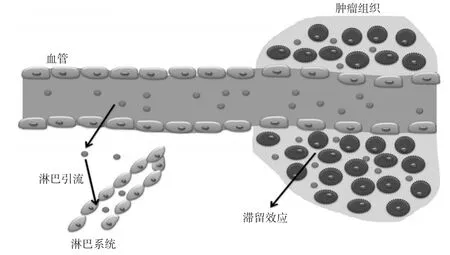
图1 肿瘤组织的EPR效应
大多数人类肿瘤组织环境均存在EPR效应。需要指出的是,基于EPR效应设计的药物载体在肿瘤组织中的被动靶向性依赖于肿瘤血管的孔径。因此,设计的药物载体的尺寸通常应该小于400 nm,大于此尺寸的颗粒不易穿透肿瘤血管,达不到在肿瘤部位富集的目的[13-14];而小于10 nm的粒子在体内循环中容易被肾捕获而清除,同样也不利于药物载体在肿瘤部位的富集。这是基于EPR效应设计药物载体时必须注意的。
目前上市的脂质体药物Doxil®和Myocet®即是采用实体瘤的EPR效应设计的药物载体。Myocet®是非PEG脂质体,平均尺寸在180 nm,临床上主要联合其他化疗试剂使用治疗乳腺癌[15];Doxil®是PEG化脂质体,较普通脂质体在体内有更长的滞留时间,其平均粒径在100 nm左右,临床上主要用于治疗转移性乳腺癌、晚期卵巢癌、卡波西氏肉瘤等[16]。Abraxane®-白蛋白结合型紫杉醇类药物,借助EPR效应治疗联合化疗失败后的转移性乳腺癌或辅助化疗6个月内复发的乳腺癌、转移性非小细胞肺癌和胰腺癌等[17]。以上这些基于EPR效应设计的药物载体,既可以使药物更多地集中在肿瘤组织,也可以改善患者生活质量。
2.2 pH响应型纳米载药系统
利用肿瘤组织相对于正常组织具有较低pH值的这个特点,可将药物运送到目标位置,使在血液中处于“沉默”状态的药物在肿瘤部位蓄积,受到肿瘤微酸环境的影响,使pH响应性化学键断裂或使电荷解离等,暴露出“激活”状态的药物载体或者药物分子,可增强肿瘤细胞对抗癌药物的摄取,从而提高抗肿瘤效果和降低毒性。目前设计响应型载体一般有2种方法:一种方法是利用一些不稳定化学键的特点制备载体,其在生理条件下稳定,然而在肿瘤微酸环境下,化学键可发生断裂,使药物得到释放或促进载体与肿瘤细胞的相互作用,提高药物摄取率[18-19]。另一种方法是借助含有质子的基团来合成载体,在不同pH环境下载体带电的情况不同,使药物可在微酸环境下释放。
Zhu Q等[20]为了降低阿霉素(DOX)的心脏毒性,研究出DOX自组装的肿瘤pH响应型载体。研究者将DOX插入DNA双链中,再将其进一步与阳离子明胶(C-gel)进行偶联,形成复杂的载体结构(GDD)。带正电的载体进入血液后与带负电的人血清蛋白(HSA)之间发生静电相互作用,载体表面吸附的血清蛋白可以使载体避开吞噬,被动积累到肿瘤部位。到达肿瘤组织后,表面的白蛋白在环境pH小于7时被迅速分解,载体与肿瘤特异性MMP相互作用,释放出内部的DOX/ DNA,组织中的DNA酶可以消化DNA分子释放DOX进入微环境。结果表明,这种新合成的载体有更好的肿瘤靶向能力以及比游离DOX更低的心脏毒性。
Zuo TT等[21]成功制备精氨酸-甘氨酸-天冬氨酸三肽(RGD)介导的载多烯紫杉醇(DTX)pH敏感脂质体(RGD/DTX-PSL),可以有选择地在低pH水平环境释放药物,并通过表面的RGD定位到肿瘤组织。研究者通过薄膜水化法,以磷脂酰乙醇胺、胆固醇、亚油酸(LA)及精氨酸、甘氨酸、天冬氨酸-PEG2000-LA为材料制备敏感载体,药物平均装载率为81.9%,平均粒径为146.4 nm。亚油酸在弱酸性环境中,其结构中羧基发生质子化,亲水的头部缩小,使整体结构由圆锥形变为圆柱形,最终载体破裂并释放其中的药物。体外药物释放结果显示,DTX在pH值为5.0的条件下,较pH值为7.0条件下释放更快,表明了其pH敏感特性。
2.3 还原响应型纳米载药系统
肿瘤细胞内除了有GSH,还存在硫蛋白、Fe2+、半胱氨酸等还原性物质。利用肿瘤细胞内外存在的GSH浓度差异(100~1 000倍),以及肿瘤细胞与正常细胞之间的浓度差[8],可有针对性地设计肿瘤细胞内外还原响应型药物载体。
ShiCL等[22]用PEG和聚己内酯,由二硫键连接,以季戊四醇为核,形成星形的两亲嵌段共聚物胶束。通过体外模拟人体内生理环境,在pH值为7.4且未加入GSH的条件下,72 h时只有大约10%的DOX释放;在pH值为5.0且未加入GSH条件下,DOX的累积释放量有显著增加,表明DOX在偏酸环境更容易释放;当pH值为5.0同时含有10mmol/LGSH条件下,因模拟肿瘤细胞内部的弱酸性和还原性,DOX的累积释放量急剧增加,24 h可达到85.9%,说明了该胶束载体在酸性和高GSH环境下可快速释放药物。Yu SJ等[23]设计并制备了酸响应和还原双敏感的聚氨酯交联的胶束载体,以PEG链为亲水壳,链中插入的哌啶和二硫键分别具有酸响应和还原性响应。通过动态光散射试验发现,在较高浓度还原剂的条件下,胶束会发生解离。将DOX作为模型药物,通过体外细胞试验表明载药交联胶束能够在酸性和还原环境下实现药物的释放;交联后的载药胶束较游离DOX和未交联的聚氨酯载药胶束具有更低的细胞毒性,这说明交联胶束具有更高的载药稳定性。串星星等[24]在普朗尼克F127疏水段引入甲基丙烯酸叔丁酯和半胱胺,合成强疏水性的巯基化衍生物F127-SH,利用F127-SH制备了载紫杉醇(PTX)还原响应型聚合物胶束(F127-SS/PTX)。结果显示,在无二硫苏糖醇(DTT)条件下,F127-SS/PTX胶束在前6 h释药较快,之后缓慢释药,24 h时释放量为50.15%;而在有DTT条件下,释药速率则大大加快,24 h时释放量达到74.21%,明显高于无DTT作用下药物的释放。这说明载体在二硫键交联作用下能够保持稳定,而在还原剂存在时二硫键断裂,药物可快速释放。
2.4 酶响应型纳米载药系统
肿瘤组织酶浓度和活性都显著高于正常组织,其对肿瘤的生长、增殖及转移都有重要影响。由于酶具有高度选择性,用特异性酶作为靶向肿瘤的底物,是纳米载体研究的一个新的方向。蛋白酶和一些脂肪酶已被证实在肿瘤组织过度表达[24]。MMP是一类基质中分解细胞组分的蛋白酶,其在肿瘤微环境过度表达,对癌细胞的转移有重要影响[25]。特别是MMP-2和MMP-9,在胃癌、结肠癌、直肠癌、前列腺癌、肺癌、乳腺癌和卵巢癌等肿瘤组织中都过度表达[26-27]。除此之外,糖苷酶、组织蛋白酶、酯酶等也被设计应用于酶敏感的纳米靶向载体。
Liu J等[28]构建了酶响应的多级释放纳米粒子载体(ESMSV),将MMP-2与聚乳酸-羟基乙酸共聚物(PLGA)-PEG交联成纳米粒子,模型药物香豆素6被封装在聚合物纳米粒子内,之后将纳米粒子缀合到介孔二氧化硅表面。在MMP-2的存在下,聚合物纳米颗粒被释放到肿瘤细胞间质,实现了药物释放,同时促进了药物的细胞内化。此外,黑色素瘤肺转移的小鼠模型实验结果显示,相比于非刺激响应纳米粒子,ESMSV的全身递送在癌细胞中药物聚集的量显著增加。
因为癌细胞通常过度表达Cat-B[29],Lee SJ等[30]将Gly-Phe-Leu-Gly通过羧基基团共轭缔和为树枝状大分子,然后甲氧基聚乙二醇(MPEG)与DOX通过二亚胺反应相连接,合成结构为MPEG-DOX的大分子,随后分子表面经Cat-B的修饰,利用酶特异性将抗癌药物靶向肿瘤组织。通过对荷瘤小鼠的体内实验,结果显示所合成的树枝状大分子组小鼠肿瘤体积明显减小。
2.5 温度响应型纳米载药系统
机体正常组织在体温升高时(40~43℃),通过增大血流量、加快流速以提高散热,减少对机体的损伤。然而,由于肿瘤组织内细胞快速增殖,密度过高,新生血管畸形,导致散热困难,从而比正常组织温度要高4~8℃[31]。根据这一特点,可以对肿瘤局部进行加热来诱导温敏载体向肿瘤靶向。目前,常用的温敏材料是聚(N-异丙基丙烯酰胺)(PNIPAM)。因为PNIPAM的低临界溶解温度(LSCT)更接近于人体生理温度[32],通过引入亲水单体,会提高聚合物的LCST,可使聚合物有更好的温度敏感性。聚甲基丙烯酸N,N-二甲基氨基乙酯(PDMAEMA)是另一种重要的温敏材料,可同时对酸和温度产生响应。其结构含烷基、羰基和叔氨基团,温度或pH值变化时,其中的氢键形成或破坏,从而产生了高分子相态的变化。Ta T等[33]制备了表面经PNIPAM-丙基丙烯酸修饰的温敏脂质体,通过局部加热使温度高于LCST,这时脂质体膜的完整性被破坏,药物进而释放。
2.6 能量响应型纳米载药系统
肿瘤细胞内的ATP浓度(1~10mmol/L)远高于细胞外的浓度(<5mmol/L),此现象在代谢旺盛的肿瘤细胞中尤为明显[34]。ATP作为一个新的响应触发器,其优点是:(1)细胞内外存在的ATP浓度差异,可以使提前释放的药物不过早被细胞摄取,从而提高药物在细胞内的积累量;(2)ATP参与体内很多生化反应,使得基于ATP响应策略的载体,不需要任何特殊的设备(如超声或光),就能触发药物释放;(3)ATP的水平可以通过其他代谢元素(如葡萄糖)来调节响应的宽度范围。药物与ATP响应纳米载体之间相互作用的范围不同,可用于不同药物的负载,所以基于ATP响应设计的纳米载体具有更大的研究价值。到目前为止,生物大分子特异性识别ATP有2种类型:(1)单链DNA(ssDNA)核酸配体能够特异性与ATP位点结合[34];(2)通过代谢ATP提供能量[35]。
Qian CG等[36]合成了5′-ATP响应型-近红外光控制释放抗癌药的纳米聚合物载体,并可以实时成像。研究者将甲酰基苯硼酸与PEG结合成共聚物(PFFP),将DOX封装于内,以疏水内核噻吩吡啶部分作为成像剂。纳米载体表面上接枝3-氟-4-羧基苯基硼酸,被设计成ATP特异结合位点。由于癌细胞内高浓度的ATP,使载体表面水解进而释放药物。静脉注射结果显示,DOX/ PFFP在肿瘤细胞有更好的渗透性和滞留性,同时硼酸部分的水解能使药物更好运送到肿瘤细胞。
Mo R等[37]研究发现,在纳米聚合物载体内,用ssDNA与互补核苷酸形成DNA双分子链,其中一个“GC”对中装载了DOX。在没有ATP存在的环境下,DNA双链能够稳定地保持DOX的装载;而在高浓度ATP的条件下,ATP将与互补DNA竞争ATP受体,结果使双分子链解离,药物也会随之释放。
2.7 复合型多重响应型纳米载药系统
Loh XJ等[38]制备了双亲水性嵌段共聚物,其能在体内自组装为胶束,PNIPAM为温敏材料,PDMAEMA为pH响应材料。结果显示,装载DOX的共聚物胶束具有pH/温度双响应性释放的特点,可显著杀伤HeLa细胞。Yang P等[39]合成了超声/pH/还原三重响应的纳米载体,用全氟己烷作为载体内壳,使其具有超声敏感性。以超声诱发液滴气化,进而提高超声的成像性,同时可以增加血管的渗透性,可使纳米载体更多地蓄积在肿瘤部位。聚甲基丙烯酸与二硫键缔和成为载体外壳,载体包封DOX,可同时具有温敏和还原敏感的双重特点,具有诊断和治疗意义。
3 结语
近年来,通过研究肿瘤微环境,利用其独特的响应因素有效地解决了载体转运稳定性、靶向性、药物定位释放等难题,有效地增加了抗肿瘤药的作用效果,并减轻了药物的毒副作用。目前,肿瘤微环境多重响应型纳米载体正受到越来越多学者的关注,如pH/温度、pH/还原、还原/酶、温度/酶、温度/磁场、pH/温度/磁场等将成为主要研究热点。多重刺激响应体系能充分发挥不同环境响应性物质之间的特点,对实现药物的特异性递送具有重要意义。多重刺激响应型药物载体较单响应载体存在载体结构修饰、合成更加复杂,质量控制更难等问题,但随着高分子材料学、肿瘤分子学等学科的不断发展和相互渗透,此类问题将会得到有效解决,未来微环境响应型纳米载药系统将会为抗肿瘤研究提供新的策略。
[1] Gentles AJ,Gallahan D.Systems biology:confronting the complexity of cancer[J].Cancer Res,2011,71(18):5961-5964.
[2]Heiden MGV,Cantley LC,Thompson CB.Understanding thewarburg effect:themetabolic requirementsof cell proliferation[J].Science,2009,doi:10.1126/science.1160809.
[3] De IRR,AiliD,Stevens MM.Enzyme-responsive nanoparticles for drug release and diagnostics[J].Adv Drug Deliv Rev,2012,64(11):967-978.
[4] Feron O.Pyruvate into lactate and back:from thewarburg effect to symbiotic energy fuel exchange in cancer cells [J].Radiother Oncol,2009,doi:10.1016/j.radonc.2009. 06.025.
[5]Vander Heiden MG,Cantley LC,Thompson CB.Understanding thewarburg effect:themetabolic requirements of cell proliferation[J].Science,2009,doi:10.1126/science. 1160809.
[6] Zhu L,Kate P,Torchilin VP.Matrixmetalloprotease 2-responsive multifunctional liposomal nanocarrier for enhanced tumor targeting[J].ACSNano,2012,doi:10.1021/ nn300524f.
[7] Zhong YJ,Shao LH,LiY.Cathepsin B-cleavable doxorubicin prodrugs for targeted cancer therapy:review[J].Int J Oncol,2013,doi:10.3892/ijo.2012.1754.
[8] Zhu CL,Wang XW,Lin ZZ,etal.Cellm icroenvironment stimuli-responsive controlled-release delivery systems based onmesoporous silica nanoparticles[J].JFood Drug Anal,2014,22(1):18-28.
[9] Tang LY,Wang YC,LiY,etal.Shell-detachablemicelles based on disulfide-linked block copolymer as potential carrier for intracellular drug delivery[J].Bioconjug Chem,2009,20(6):1095-1099.
[10] Weis SM,Cheresh DA.Tumor angiogenesis:molecular pathways and therapeutic targets[J].Nat Med,2011,17(11):1359-1370.
[11] Camussi G,Deregibus MC,Tetta C.Tumor-derived m icrovesicles and the cancer m icroenvironment[J].Curr MolMed,2013,13(1):58-67.
[12] 殷香保,邬林泉,黄跃英,等.三氧化二砷聚乙二醇-聚乳酸偶联人源抗血管内皮细胞生长因子受体2隐形纳米粒的抗肝癌机制探讨[J].中国全科医学,2015,18(23):2805-2809.
[13]Maeda H,Nakamura H,Fang J.The EPR effect formacromolecular drug delivery to solid tumors:improvement of tumor uptake,lowering of system ic toxicity,and distinct tumor imaging in vivo[J].Adv Drug Deliv Rev,2013,doi:10.1016/j.addr.2012.10.002.
[14] Fang J,Nakamura H,Maeda H.The EPR effect:unique features of tumor blood vessels for drug delivery,factors involved,and lim itations and augmentation of the effect [J].Adv Drug Deliv Rev,2011,doi:10.1016/j.addr.2010. 04.009.
[15] Rabanel JM,Hildgen P,Banquy X.Assessment of PEG on polymeric particles surface,a key step in drug carrier translation[J].JControlRelease,2014,185(1):71-87.
[16] M iele E,SpinelliGP,M iele E,et al.Albumin-bound formulation of paclitaxel(Abraxane®ABI-007)in the treatmentof breastcancer[J].Int JNanomedicine,2009,4(1):99-105.
[17] Lee JL,Ahn JH,Park SH,et al.PhaseⅡstudy of a cremophor-free,polymeric m icelle formulation of paclitaxel for patients w ith advanced urothelial cancer previously treated w ith gemcitabine and platinum[J].Invest New Drugs,2012,doi:10.1007/s10637-011-9757-7.
[18]Wu Y,ChenW,Meng F,etal.Core-crosslinked pH-sensitive degradablem icelles:a promising approach to resolve the extracellular stability versus intracellular drug release dilemma[J].JControlRelease,2012,164(3):338-345.
[19] Gao GH,LiY,Lee DS.Environmental pH-sensitive polymeric micelles for cancer diagnosis and targeted therapy [J].JControlRelease,2013,169(3):180-184.
[20] Zhu Q,Jia L,Gao Z,et al.A tumor environment responsive doxorubicin-loaded nanoparticle for targeted cancer therapy[J].Mol Pharmaceutics,2014,11(10):3269-3278.
[21]Zuo TT,Guan YY,Chang ML,etal.RGD(Arg-Gly-Asp)internalized docetaxel-loaded pH sensitive liposomes:preparation,characterization and antitumor efficacy in vivo and in vitro[J].Colloids and Surfaces B:Biointerfaces,2016,doi:10.1016/j.colsurfb.2016.07.056.
[22] Shi CL,Guo X,Qu QQ,et al.Actively targeted delivery of anticancer drug to tumor cells by redox-responsive star-shaped micelles[J].Biomaterials,2014,35(30):8711-8722.
[23] Yu SJ,He CL,Lv Q,et al.pH and reduction-sensitive disulfide cross-linked polyurethane m icelles for bio-triggered anti-tumor drug delivery[J].J Control Release,2015,doi:10.1016/j.jconrel.2015.05.166.
[24] 串星星,印亚双,王学清.还原响应型高载药量普朗尼克F127聚合物胶束的制备[J].中国药房,2016,27(19):2693-2696.
[25] Kessenbrock K,Plaks V,Werb Z.Matrixmetalloproteinases:regulators of the tumorm icroenvironment[J].Cell,2010,doi:10.1016/j.cell.2010.03.015.
[26] Jezierska A,Motyl T.Matrixmetalloproteinase-2 involvement in breast cancer progression:am ini-review[J].Med SciMonit,2009,15(2):32-40.
[27] Chen WH,Luo GF,LeiQ,etal.MMP-2 responsive polymericm icelles for cancer-targeted intracellular drug delivery[J].Chem Comm,2014,51(3):465-468.
[28] Liu J,Zhang B,Luo Z,etal.Enzyme responsivemesoporous silica nanoparticles for targeted tumor therapy in vitro and in vivo[J].Nanoscale,2015,7(8):3614-3626.
[29]M iY,Wolfram J,Mu CF,etal.Enzyme-responsivemultistage vector for drug delivery to tumor tissue[J].PharmacolRes,2016,113(PtA):92-99.
[30] Lee SJ,Jeong YI,Park HK,et al.Enzyme-responsive doxorubicin release from dendrimer nanoparticles for anticancer drug delivery[J].Int J Nanomed,2015,10(14):5489-5503.
[31] Kumar CS,Mohammad F.Magnetic nanomaterials for hypertherm ia-based therapy and controlled drug delivery[J]. Adv Drug Deliv Rev,2011,63(9):789-808.
[32] StuartMAC,Huck WTS,Genzer J,etal.Emerging applications of stimuli-responsive polymer materials[J].Nat Mater,2010,9(2):101-113.
[33] Ta T,Convertine AJ,Reyes CR,etal.Thermosensitive liposomes modified w ith poly(N-isopropylacrylamide-copropylacrylic acid)copolymers for triggered release of doxorubicin[J].Biomacromolecules,2010,11(8):1915-1920.
[34] Mo R,Jiang T,DiSanto R,etal.ATP-triggered anticancer drug delivery[J].Nat Commun,2014,doi:10.1038/ncomms4364.
[35] Biswas S,Kinbara K,Niwa T,et al.Biomolecular robotics for chemomechanically driven guest delivery fuelled by intracellularATP[J].NatChem,2013,5(7):613-620.
[36] Qian CG,Chen YL,Zhu S,et al.ATP-responsive and near-infrared-em issive nanocarriers for anticancer drug delivery and real-time imaging[J].Theranostics,2016,6(7):1053-1064.
[37] Mo R,Jiang T,Gu Z.Enhanced anticancer efficacy by ATP-mediated liposomal drug delivery[J].Angew Chem IntEd,2014,doi:10.1002/anie.201400268.
[38] Loh XJ,Del BJ,Toh PP,etal.Triply triggered doxorubicin release from supramolecular nanocontainers[J].Biomacromolecules,2012,13(1):84-91.
[39] Yang P,LiD,Jin S,etal.Stimuli-responsive biodegradable poly(methacrylic acid)based nanocapsules for ultrasound traced and triggered drug delivery system[J].Biomaterials,2014,35(6):2079-2088.
(编辑:余庆华)
R944.9
A
1001-0408(2017)13-1864-06
2016-10-17
2017-03-01)
*硕士研究生。研究方向:缓控释靶向制剂、中药新药研发。电话:0451-87266907。E-mail:qiaofu351@163.com
#通信作者:教授,博士。研究方向:缓控释靶向制剂、中药新药研发。电话:0451-87266988。E-mail:15159267@qq.com
DOI10.6039/j.issn.1001-0408.2017.13.38
