结直肠癌术前营养评估
2017-05-16卢召郑朝旭
卢召 郑朝旭
结直肠癌术前营养评估
卢召 郑朝旭
相比于非消化道肿瘤,结直肠癌术前营养不良的发生率更高,而围术期营养支持治疗能够明显改善结直肠癌术前的营养状态。但合理的围手术期营养干预应该建立在对病人术前营养评估的基础上,笔者就此对术前营养评估的方法进行了系统的阐述。
结直肠肿瘤; 评估; 营养不良
结直肠癌目前在全国的发病率和死亡率分别位于第三位和第五位,且呈不断上升的趋势[1]。由于肠梗阻、肠道吸收障碍等的直接影响,相比于非消化道肿瘤,结直肠癌病人术前营养不良的发生率更高。欧洲学者发现39.3%的结直肠癌病人术前存在营养不良[2];美国学者也发现在常见的肿瘤中,结直肠癌病人术前营养不良的现象更普遍[3]。而术前营养不良的病人,其术后并发症的发生率及死亡率更高,住院时间也更长[3-6]。同时术前针对营养不良的病人,给予营养支持治疗,能够明显降低病人术后并发症的发生率及死亡率,缩短住院时间,提高生活质量[7-9]。所以围手术期营养支持治疗,是结直肠癌病人综合治疗内容的一部分,但合理的围手术期营养干预应该建立在对病人术前营养评估的基础上。本文就此对结直肠癌术前营养评估的常见方法及最新进展进行综述,以期更好地指导临床实践。
一、结直肠癌与营养不良
结直肠癌是我国常见的恶性肿瘤,由于恶性肿瘤本身的进展、对机体全身或局部的影响及放化疗等治疗的不良反应;同时由于结直肠癌累及消化道,病人常存在恶心、呕吐、食欲不振等症状,影响食物的摄取和营养物质的消化吸收,所以结直肠癌的病人术前常出现不同程度的营养不良。目前我国结直肠癌主要的治疗方式为手术治疗,由于结直肠解剖的特点,手术过程中腹膜后及盆腔分离的范围较大,对病人的打击较大,加上围手术期禁食水的时间较长,使机体容易出现分解代谢、能量需求增加,呈明显的低蛋白血症、负氮平衡,从而加速机体肌肉和脂肪的分解以获得足够的能量,更加容易导致营养不良的发生。
二、结直肠癌术前营养评估的常见方法
营养评估是临床上用以评估病人营养状况,从而发现营养不良或营养风险的方法,进而给予相应的营养支持。目前,在临床工作中应用的术前营养评估方法有很多种,多为复合型营养评估方法。但仍没有一种专门针对结直肠癌特异性和敏感性都很好的营养评估方法。以下就此介绍几种结直肠癌术前营养评估的常见方法。
(一)营养风险评估2002
营养风险评估2002(nutritiona is creening2002,NRS 2002)[10]是由欧洲肠外肠内营养学会于2002年提出并推荐使用的一种营养状况评估方法,包括初筛表和终筛表,具体见表1和表2。初筛表包括4个问题,简单地反映住院患者的营养状况;终筛表比较详细地评估患者营养状况,根据饮食、体质量、疾病损伤状况的风险及年龄而定。其中,终筛表得分为NRS 2002评分的总得分,总得分≥3分者存在营养风险,<3分者暂无营养风险。

表1 NRS 2002初筛表
营养风险是指与营养有关的出现不利结局(并发症)的风险,而不是出现营养不良的风险[11]。目前,NRS 2002已广泛应用于结直肠癌术前营养风险评估,对营养支持方案的制定有良好的指导意义并可有效预测病人的临床结局[12]。但最近一项研究[13]发现,基于NRS 2002评分的术前营养支持可能导致营养过度治疗,从而出现不利的临床结局,故推荐对于NRS 2002≥3分的病人进行营养治疗之前,可先由专业的营养师对病人进行详细的营养评估。
采用NRS 2002对结直肠癌病人进行术前营养风险评估,具有无创、廉价、评价客观、使用简便、易于推广等特点。但应除外神志不清,无法站立,有明显腹水、胸水等不能获得体质指数的病人。
(二)微型营养评估
微型营养评价(min utritiona ssessment,MNA)是Guigoz[14]等提出的一种简单、快捷的人体营养状况评估方法。MNA量表由4个部分共18个问题组成。A:人体测量指标(BMI、中臂围、腓肠肌围、近3个月体重丢失情况等4项条目);B:整体评估(包括生活方式、医疗用药情况、活动能力及神经心理等相关的6项条目);C:膳食评估(包括食欲、每日摄食情况、摄食行为模式等6项条目);D:主观评定(对自身健康及营养状况的评价)。MNA结果的判断:总分为30分;MNA≥24,表示营养情况良好;17≤MNA≤23.5,表示有营养不良危险;MNA<17表示营养不良。
MNA评分[14]主要适合用于≥65岁的老年人营养风险筛查和营养状况评估。随着人口老龄化,目前50%以上的结直肠癌病人都≥70岁[15];同时由于老年人各系统功能处于衰退状态,生理储备功能不足、消化吸收功能减退、应激能力下降,更容易发生营养不良。故MNA应用于老年结直肠癌病人的术前营养评估具有很好的推广性。
MNA具有评分标准可靠、操作简单、易于掌握等优点,可于床旁在短时间内完成营养状况评估。但MNA评分并非完全适合于亚洲人,故我国学者将MNA进行了本土化修订,如BMI正常值为18.5~24[16]、临界值由17分改为19分[17]等。未来也需要更多的研究来验证修订版MNA评分的准确性。
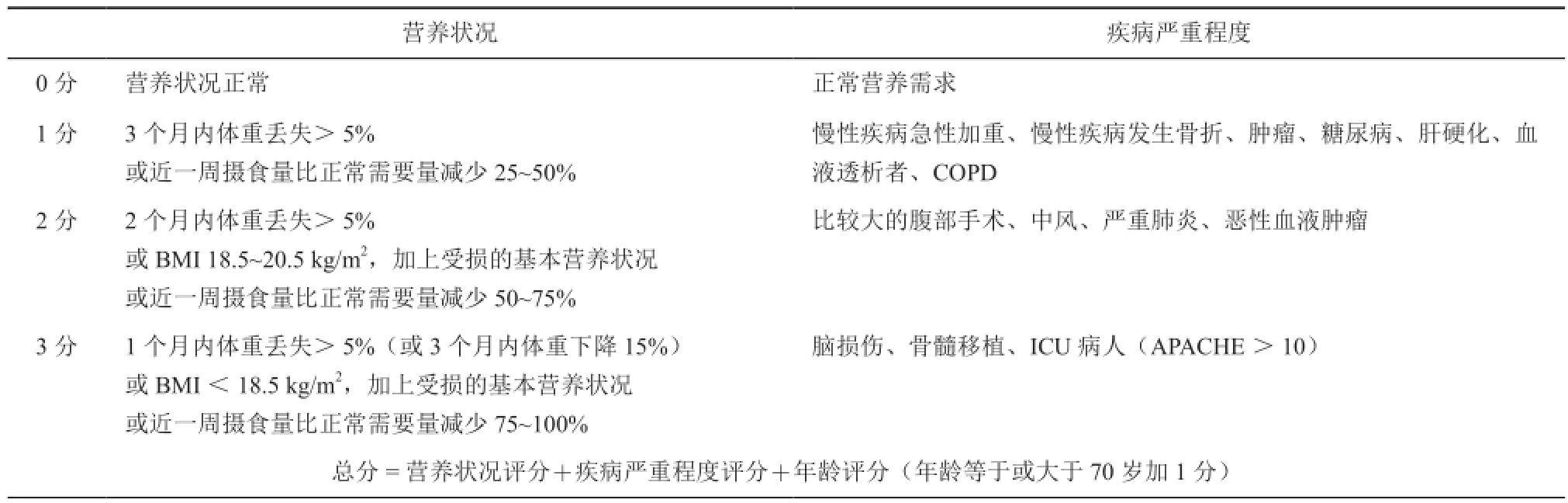
表2 NRS 2002终筛表
(三)主观全面评估(subjectiv lobal assessment,SGA)
SGA[18]为美国肠外肠内营养学会(ASPEN)推荐临床使用的营养状况评估方法,具体内容见表3。各项指标均分为A、B、C共3个等级,以上8项中至少5项是B级或C级就可分别评为中度或重度营养不良。

表3 SGA评估表
SGA的特点是以详细的病史与临床检查为基础,省略人体测量和生化检查,可评估营养状况及预测并发症发生率、死亡率及住院时间等。但SGA主要依赖于医务人员对相关指标的主观判断,缺乏客观指标和标准,因此容易影响营养状况评估的准确性。同时SGA无法区分正常营养与轻度营养不良,更多反映的是疾病状况,而非营养状况,这也是其局限性之一。
(四)营养不良通用筛查工具
营养不良通用筛查工具(malnutritio niversal screenin ool,MUST)[19]主要用于蛋白质热量营养不良及其发生风险的筛查,包括3方面评估内容:(1)BMI;(2)体重减轻;(3)疾病所致进食量减少。考虑到东西方人种差异,BMI评定标准采用国内标准。BMI 评定标准:BMI <18.5 kg/m2为营养不良,18.5 kg/m2≤BMI <24 .0 kg/m2为正常,24 .0 kg/m2≤BMI <28 .0 kg/m2为超重,如为营养不良计1 分。最近3~6个月内体质量下降<5%计0分,5~10%计1分,>10%计2分。因急性疾病影响导致禁食或摄食≤5 d,计2分。通过3部分评分得出总得分,0分为低营养风险状态,需定期进行重复筛查,1分为中等营养风险状态,≥2分为高营养风险状态。
MUST是方便使用的快速营养评估方法,可在数分钟内完成;同时由于操作简单,可适合不同专业人员使用。MUST有较好的表面效度和内容效度,其预测效度也在结直肠癌病人中得到证实。Vugt[20]发现MUST可有效筛查出术前结直肠癌营养不良的风险,同时也是预测术后并发症发生的有效工具。然而结直肠癌病人中有部分存在以急性起病并影响饮食的情况,这就造成了中等风险的病人在MUST中被评为高风险,从而高估了营养风险。
三、结直肠癌术前营养评估的最新进展
除了上述介绍的几种常见的营养评估方法,目前全世界范围内亦出现了许多其他的营养评估方法,而且在临床中具有一定的适用性及实用性,以下就此介绍两种常见的术前营养评估方法。
(一)预后营养指数(prognosti utrition index,PNI)
1.PNI的计算方式
由于血清白蛋白的半衰期约为3周[21],外周血淋巴细胞的半衰期大于2周[22-24],故于术前2周内抽血查血常规和生化检查,根据结果计算PNI值完全可靠,其计算公式[25]为PNI=血清白蛋白值(g/L)+5×外周血淋巴细胞总数(×109/L)。参照Onodera等[25]制定的标准,根据PNI值,病人可分为营养较差组(PNI值小于45)和营养较好组(PNI值大于或等于45)。
2.PNI的临床应用及评价
预后营养指数是Onodera等建立的营养评估和手术风险预测指标,目前已广泛胃肠外科[25-27]。近年来研究证实,预后营养指数是评估结直肠癌病人预后的独立因素,PNI低于分界值的病人其术后严重并发症的发生率、肿瘤复发率都显著升高,而五年癌症相关生存率、总生存率都较营养良好组低[25,28]。故预后营养指数是一个有价值的结直肠癌术前营养评估和预后分析指标。同时PNI计算简单、可重复性强、临床花费低,能够很快被医护人员掌握,故有很好的临床实用性。然而术前病人合并感染、出血、水肿等情况时,可影响血清白蛋白和淋巴细胞总数,所以用PNI进行评估时,应除外这类情况的影响。另外上述研究都是单中心、小样本、回顾性的研究结果,仍需多中心、大规模、前瞻性研究来证实上述的研究结果。
(二)CT体质成分分析(computerize omographybase od omposition:CTBC analysis)
1.CTBC相关指标
一般以CT的第三腰椎横截面水平来计算相关体质成分指标,主要指标有内脏脂肪面积(visceral adipos rea,VFA)和骨骼肌指数(skeleta uscle index,SMI)[29]。VFA为第三腰椎横截面所有内脏脂肪面积的总和(cm2),不包括皮下脂肪面积;基于以前的研究[30],VFA≥130 cm2定义为内脏型肥胖,而日本肥胖协会[31]将VFA≥100 cm2定义为内脏型肥胖。SMI(cm2/m2)为第三腰椎横截面所有骨骼肌面积(cm2)除以身高的平方(m2);一项以前的研究[32]将SMI≤52.4 cm2/m2(男性)或≤38.5 cm2/m2(女性)定义为肌肉减少症。
2.CTBC的临床应用及评价
据统计[29],内脏型肥胖和肌肉减少症在结直肠癌病人中的发病率分别为17.5~61.4%和15.9~71%。目前一些研究[33-35]已证实,CT分析的内脏型肥胖的结直肠癌病人手术时间、术后住院时间及术后恢复口服进食的时间更长,同时伤口感染、术后并发症及吻合口瘘的发生率更高。肌肉减少症的病人术后30天的死亡率和术后并发症的发生率更高,同时术后住院时间及术后恢复的时间
更长[36-38]。
CT是诊断结直肠癌的重要辅助手段,也是术后定期复查的一个重要检查,所以可普遍应用CT进行结直肠癌病人体质成分分析及术前营养评估。另外Mourtzakis等[39]发现腰椎水平的脂肪、肌肉含量在估测全身体质成分具有很好的代表性。故应用第三腰椎横截面水平的VFA和SMI进行人体成分分析及术前营养评估具有很好的可行性。然而CT进行人体成分分析存在电离辐射暴露的危险,故其可重复性受到限制。另外上述研究都是单中心、小样本、回顾性的研究结果,这也是其局限性之一。
结直肠癌是世界范围内常见的恶性肿瘤之一,在男性和女性的发病率分别高居第三位和第二位,在西方死于结直肠癌的人数占癌症相关死亡人数的10%左右[40];而且我国结直肠癌的发病率和死亡率都高居第五位,且呈不断上升的趋势。临床医师一直在研究结直肠癌预后的影响因素,目前已发现多种因素与其预后相关,如TNM分期、组织学类型、根治性手术类型、切缘情况、淋巴结清扫数目、是否应用化疗等辅助治疗手段等[41]。
除上述影响因素外,结直肠癌病人的营养状况也是影响预后的重要因素。结直肠癌病人营养不良的现象非常普遍,而其营养状况又与预后密切相关,故对结直肠癌病人进行术前营养评估并对营养不良的病人进行营养支持治疗极为重要。目前临床上有多种复合型营养评估方法,如营养风险评估2002(nutritiona is creening 2002,NRS 2002)、微型营养评估(min utritiona ssessment,MNA)、主观全面评估(subjectiv loba ssessment,SGA)、营养不良通用筛查工具(malnutritio niversal screenin ool,MUST)等,目前已在临床广泛使用,但上述方法包括较多指标或步骤,相对复杂,容易受到临床医师主观评估的影响,在临床应用中有诸多限制。本文最后介绍的两种最新的营养评估方法客观性强,数据易于获得,计算方式简单,便于临床使用。但上述两种最新的营养评估方法的实验结果多属于小样本、单中心、回顾性研究结果,目前仍需更多的临床研究进行进一步探讨。
[ 1 ] Chen W, Zheng R, Baade PD, e l. Cance tatistic n China, 2015 [J]. CA: A Cancer Journa or Clinicians, 2016, 66(2): 115-132.
[ 2 ] Hebuterne X, Lemarie E, Michallet M, e l. Prevalenc f Malnutritio nd Current Us f Nutrition Suppor n Patients With Cancer [J]. Journa f Parentera nd Enteral Nutrition, 2014, 38(2): 196-204.
[ 3 ] Hu WH, Cajas-Monson LC, Eisenstein S, e l. Preoperative malnutritio ssessment redictor ostoperativ ortalit nd morbidit olorecta ancer: a nalysi f ACS-NSQIP [J]. Nutr J, 2015, 14(1): 91.
[ 4 ] Huhmann MB, Cunningham RS. Importanc utritiona creening i reatmen ancer-relate eigh oss [J]. Lancet Oncol, 2005, 6(5): 334-343.
[ 5 ] Bozzetti F, Gianotti L, Braga M, e l. Postoperativ omplications i astrointestina ance atients: Th oin ol h utritional statu n h utritiona upport [J]. Clinical Nutrition, 2007, 26(6): 698-709.
[ 6 ] Smith RK, Broach RB, Hedrick TL, e l. Impac f BMI on Postoperative Outcome n Patients Undergoing Proctectom or Rectal Cancer [J]. Disease he Colon & Rectum, 2014, 57(6): 687-693.
[ 7 ] Gianotti L, Braga M, Nespoli L, e l. A randomize ontrolled tria reoperativ ra upplementatio it specialize ie n patient it astrointestina ancer [J]. Gastroenterology, 2002, 122(7): 1763-1770.
[ 8 ] Wu GH, Liu ZH, Wu ZH, e l. Perioperativ rtificia utrition i alnourishe astrointestina ance atients [J]. World J Gastroenterol, 2006, 12(15): 2441-2444.
[ 9 ] Chen Y. Nutritio uppor urgica atient it olorecta ancer [J]. World Journa f Gastroenterology, 2011, 17(13): 1779.
[ 10 ] Kondrup J. ESPEN Guideline or Nutrition Screening 2002 [J]. Clinical Nutrition, 2003, 22(4): 415-421.
[ 11 ] 梁晓坤, 揭彬, 蒋朱明. 营养风险理念解读 [J]. 中国临床营养杂志, 2007, 15(03): 167-170.
[ 12 ] Sun Z, Kong X, Jing X, e l. Nutritional Risk Screening 2002 as a Predicto f Postoperative Outcome n Patients Undergoing Abdominal Surgery: A Systematic Revie nd Meta-Analysi fProspective Cohort Studies [J]. PLOS ONE, 2015, 10(7): e132857.
[ 13 ] Grass F, Hubner M, Schafer M, e l. Preoperativ utritional screenin h pecialis nstea h utritiona is cor ight preven xces utrition: ultivariat nalysi utritiona isk factors [J]. Nutr J, 2015, 14(1): 37.
[ 14 ] Guigoz Y, Vellas B, Garry PJ. Assessin h utritiona tatu he elderly: The Mini Nutritional Assessmen ar h eriatric evaluation [J]. Nutr Rev, 1996, 54(1 Pt 2): S59-S65.
[ 15 ] Ugolini G. Personalize urgica anagemen olorecta ancer i lderl opulation [J]. World Journa f Gastroenterology, 2014, 20(14): 3762.
[ 16 ] 陈春明.国际生命科学学会中国办事处中国肥胖问题工作组联合数据汇总分析协作组. 中国成人体质指数分类的推荐意见简介 [J]. 中华预防医学杂志, 2001, 35(5): 349-350.
[ 17 ] Lei Z, Qingyi D, Feng G, e l. Clinica tud ini-nutritional assessmen o lder Chines npatients [J]. J Nutr Health Aging, 2009, 13(10): 871-875.
[ 18 ] Detsky AS, Mclaughlin JR, Baker JP, e l. Wha ubjectiv lobal assessmen utritiona tatus? [J]. JPEN J Parenter Enteral Nutr, 1987, 11(1): 8-13.
[ 19 ] Stratton RJ, Hackston A, Longmore D, e l. Malnutritio ospital outpatient n npatients: prevalence, concurren alidit n ase o s he ′malnutritio niversa creenin ool′ (′MUST′) for adults [J]. British Journa f Nutrition, 2004, 92(05): 799.
[ 20 ] Vugt J LV. Improvin h utcome ncologica olorecta urgery [J]. World Journa f Gastroenterology, 2014, 20(35): 12445.
[ 21 ] Liumbruno GM, Bennardello F, Lattanzio A, e l. Recommendations fo h s lbumi n mmunoglobulins [J]. Blood Transfus, 2009, 7(3): 216-234.
[ 22 ] Fulcher DA, Basten A. B cel if pan: eview [J]. Immunol Cell Biol, 1997, 75(5): 446-455.
[ 23 ] Jamieson AM, Isnard P, Dorfman JR, e l. Turnove nd Proliferatio f NK Cell n Steady Stat nd Lymphopenic Conditions [J]. The Journa f Immunology, 2004, 172(2): 864-870.
[ 24 ] Vrisekoop N, den Braber I, de Boer AB, e l. Spars roductio ut preferentia ncorporatio ecentl roduce aive T cell he huma eriphera ool [J]. Proc Natl Acad Sci USA, 2008, 105(16): 6115-6120.
[ 25 ] Tokunaga R, Sakamoto Y, Nakagawa S, e l. Prognostic Nutritional Index Predicts Severe Complications, Recurrence, and Poor Prognosi n Patients With Colorectal Cancer Undergoing Primary Tumor Resection [J]. Disease he Colon & Rectum, 2015, 58(11): 1048-1057.
[ 26 ] Jiang N. Prognosti utritiona nde redict ostoperative complication n ong-ter utcome astri ancer [J]. World Journa f Gastroenterology, 2014, 20(30): 10537.
[ 27 ] Feng JF, Chen QX. Signif i cance of the prognostic nutritional index i atient it sophagea quamou el arcinoma [J]. Ther Clin Risk Manag, 2014, 10: 1-7.
[ 28 ] Mohri Y, Inoue Y, Tanaka K, e l. Prognostic Nutritional Index Predicts Postoperative Outcom n Colorectal Cancer [J]. World Journa f Surgery, 2013, 37(11): 2688-2692.
[ 29 ] Malietzis G, Aziz O, Bagnall NM, e l. Th ol od omposition evaluatio omputerize omograph eterminin olorectal cance reatmen utcomes: A systemati eview [J]. European Journa f Surgical Oncology (EJSO), 2015, 41(2): 186-196.
[ 30 ] Hunter GR, Snyder SW, Kekes-Szabo T, e l. Intra-abdominal adipos issu alue ssociate it is ossessin levated bloo ipid n loo ressure [J]. Obes Res, 1994, 2(6):563-568.
[ 31 ] Oda E. Ne riteri or ′obesit isease′ in Japan [J]. Circ J, 2006, 70(1): 150.
[ 32 ] Prado CM, Lieffers JR, Mccargar LJ, e l. Prevalenc n linical implication arcopeni besit atient it oli umour f th espirator n astrointestina racts: opulation-base tudy [J]. Lancet Oncol, 2008, 9(7): 629-635.
[ 33 ] Tsujinaka S, Konishi F, Kawamura YJ, e l. Visceral Obesity Predicts Surgical Outcome fter Laparoscopic Colectom or Sigmoid Colon Cancer [J]. Disease he Colon & Rectum, 2008, 51(12): 1757-1767.
[ 34 ] Ballian N, Lubner MG, Munoz A, e l. Viscera besit ssociated wit utcome ota esorecta xcisio o ecta denocarcinoma [J]. Journa f Surgical Oncology, 2012, 105(4): 365-370.
[ 35 ] Watanabe J, Tatsumi K, Ota M, e l. Th mpac iscera besity o urgica utcome aparoscopi urger o olo ancer [J]. International Journa f Colorectal Disease, 2014, 29(3): 343-351.
[ 36 ] Peng PD, van Vledder MG, Tsai S, e l. Sarcopeni egatively impact hort-ter utcome atient ndergoin epati esection fo olorecta ive etastasis [J]. HPB, 2011, 13(7): 439-446.
[ 37 ] Lieffers JR, Bathe OF, Fassbender K, e l. Sarcopeni ssociated wit ostoperativ nfectio n elaye ecover ro olorectal cance esectio urgery [J]. Br J Cancer, 2012, 107(6): 931-936.
[ 38 ] Reisinger KW, van Vugt J LA, Tegels JJ W, e l. Functional Compromise Reflecte y Sarcopenia, Frailty, and Nutritional Depletion Predicts Adverse Postoperative Outcome After Colorectal Cancer Surgery [J]. Annal f Surgery, 2015, 261(2): 345-352.
[ 39 ] Mourtzakis M, Prado C MM, Lieffers JR, e l. A practica nd precis pproac uantificatio od ompositio ancer patient sin ompute omograph mage cquire urin outine care [J]. Applied Physiology, Nutrition, and Metabolism, 2008, 33(5): 997-1006.
[ 40 ] Kuipers EJ, Grady WM, Lieberman D, e l. Colorecta ancer [J]. Nature Reviews Disease Primers, 2015, 1: 15065.
[ 41 ] 顾晋, 杜长征. 结肠癌术后复发的研究进展 [J]. 中华消化外科杂志, 2008, 7(3): 167-169.
The preoperative nutrition assessment of colorectal cancer
Lu Zhao, Zheng Zhaoxu.
Department of Colorectal Surgery, National Cancer Center/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
Zheng Zhaoxu, Email: zzx-2003@126.com
Th at alnutritio olorecta ance ighe ha on-gastrointestina umor, an erioperativ utritio uppor a mprov reoperativ utritiona tatu atient ffectively. However, th reoperativ utritio ssessmen h oundatio easonabl erioperativ utrition intervention, th utho ystemicall eviewe h ethod utritio ssessment.
Colorecta eoplasms; Assessment; Malnutrition
2016-10-19)
(本文编辑:杨明)
10.3877/cma.j.issn.2095-3224.2017.02.012
国家癌症中心中国医学科学院肿瘤医院临床科研重点课题(No.LC2013A16)
100021 北京,国家癌症中心/中国医学科学院北京协和医学院肿瘤医院结直肠外科
郑朝旭,Email:zzx-2003@126.com
