自然杀伤性T淋巴细胞数量分布变化与肝癌转移的相关性研究
2017-05-15刘长芳吴翠娇李慧张静
刘长芳,吴翠娇,李慧,张静
(青岛大学基础医学院组织胚胎学教研室,*青岛大学附属医院,山东青岛266000)
自然杀伤性T淋巴细胞数量分布变化与肝癌转移的相关性研究
刘长芳,吴翠娇,李慧*,张静*
(青岛大学基础医学院组织胚胎学教研室,*青岛大学附属医院,山东青岛266000)
目的探讨自然杀伤性T细胞的数量分布变化与肝癌转移的相关性。方法采用鼠抗人CD3、CD56单克隆抗体双重免疫法,正常肝脏组织及不同分期肝癌组织中自然杀伤T淋巴细胞的数量及分布情况,运用统计学分析自然杀伤性T淋巴细胞的数量分布变化与肝癌细胞迁移的相关性。应用SPSS20.0软件,所获数据采用方差分析和t检验。结果各分期肝癌组织中自然杀伤性T淋巴细胞的数量与正常肝组织内自然杀伤性T细胞的数量比较,P<0.0005,肝癌Ⅰa期-Ⅱa期与Ⅱb期-Ⅲb期的自然杀伤性T细胞数量比较,P<0.005。结论肝癌组织中自然杀伤性T细胞的数量依赖于组织被癌细胞侵袭的程度不同而分布不同,肝脏的微环境影响自然杀伤性T细胞的分化,自然杀伤性T细胞数量与肝癌转移具有相关性。
肝癌;自然杀伤性T细胞;免疫组化
肝癌是世界上最常见的恶性肿瘤之一,据世界卫生组织统计2012年全球约有78.2万例肝癌新发病例,其中83%发生在发展中国家,中国占50%[1],发病率为28.17/105,占所有恶性肿瘤的第4位(10.04%),而死亡率为26.04/105,占所有癌症死亡的第2位[2]。肝癌起病隐匿,缺乏有效的早期诊断方法,确诊后缺乏有效的治疗方法,肝癌患者的高复发率和低生存率,仍是临床研究的重点内容。肝癌的转移和复发机制非常复杂,细胞免疫在抗肿瘤过程中具有特殊重要的地位,在细胞免疫中已知的效应细胞有T淋巴细胞、树突状细胞(DC)、自然杀伤细胞(NK)及巨噬细胞。自然杀伤性T淋巴细胞(NKT细胞)因同时具有NK细胞和T细胞部分表型及功能的细胞亚群,越来越受到重视。NKT细胞在先天性免疫和获得性免疫之间起到桥梁的作用[3],这些细胞可以同时识别主要组织相容性复合体CD1分子[4-6],活化后迅速分泌大量细胞因子,直接或间接参与机体的免疫应答[7],从而使机体处于某些疾病的康复或发展状态。另外,很多研究认为NKT细胞的数量和功能变化与动物和人类的疾病发生发展密切相关[5-7]。肝脏是含自然杀伤性T淋巴细胞最多的器官,约占肝脏T淋巴总数的20%~30%,并在肝脏疾病的发病机制中起着重要的作用,NKT细胞可以通过产生促炎性细胞因子和直接杀伤作用促进肝脏的损伤,另外NKT细胞可以通过抑制肝星状细胞的激活来抑制肝纤维化,还可以通过增强肝脏的炎症和损伤促进肝纤维化,通过激活NKT细胞可以抑制肝脏再生,在肝癌中NKT细胞在控制肿瘤的进展中既能发挥抗肿瘤作用也能产生促瘤效应[8]。NKT细胞的这种双向免疫调节作用越来越引起学术界的兴趣,为此、我们对不同分期的肝癌中NKT细胞数量及分布变化。现报道如下。
1 材料与方法
1.1 标本及来源收集我院肝胆外科、普外科正常肝组织15例,根据全国肝癌协会会议拟定的分期标准,Ⅰ期18例,其中Ⅰa期10例,Ⅰb期8例;Ⅱ期21例,其中Ⅱa期10例,Ⅱb期11例;Ⅲ期25例,其中Ⅲa 13例,Ⅲb期12例。
1.2 材料
1.2.1 试验材料小鼠抗人CD3单抗(即用型CST公司生产);小鼠抗人CD56单抗体(即用型CST公司生产);羊抗小鼠辣根过氧化物酶(HRP)标记二抗(即用型CST公司生产);3%过氧化氢溶液;pH7.2-7.4的PBS磷酸盐缓冲液;pH9.0的EDTA(乙二胺四乙酸钠)抗原修复液;AEC显色系统(solarbio公司),使用时按说明书配制;水溶性封片剂;免疫组织化学专用湿盒;免疫组织化学专用抗原修复架及修复盒。
1.2.2 方法所有标本经10%福尔马林固定石蜡包埋,连续4μm切片,脱蜡、水化,EDTA缓冲液抗原修复、PBS缓冲液漂洗,切片滴加辣根过氧化物酶(HRP)标记二抗,避光孵育10~15分钟,采用小鼠抗人CD3单克隆抗体、小鼠抗人CD56单克隆抗体联合双重免疫组织化学标记,以AEC显色系统显色,显色充分后入双蒸水阻断显色反应,用苏木精复染2~3分钟后封片。然后分别计数在正常肝脏组织、不同分期肝癌组织中NKT细胞的数量及分布情况,运用统计学方法分析各组数据。
1.3 统计学处理应用SPSS20.0软件所获数据采用方差分析和t检验。
2 结果
2.1 各组形态学结果实验中能同时表达CD3、CD56抗原分子的淋巴细胞为阳性NKT细胞,典型NKT细胞形态特征为棕褐色的细胞膜周围附着鲜红色的颗粒状沉积,正常组肝组织,Ⅰa-Ⅱa期、Ⅱb-Ⅲb期NKT细胞染色结果见图1、图2、图3。肝癌随病程进展肝脏内环境变化NKT细胞数量逐渐下降,箭头指示为NKT细胞。e、f晚期肝癌NKT细胞数量进一步下降,视野内NKT数量很少。
图1:正常组肝组织
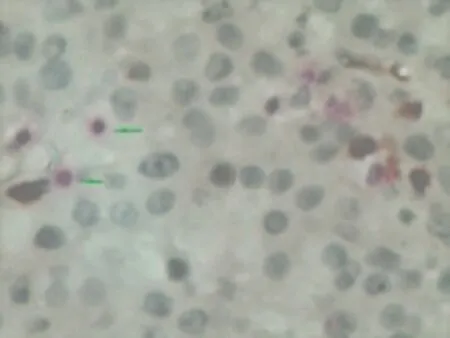
图1:箭头所指为NKT细胞(×200)

图3:不同期肝癌镜下表现
2.2 不同分期肝癌中NKT细胞数量之间的关系见表1。
表1 不同分期肝癌中NKT细胞数量之间的关系

表1 不同分期肝癌中NKT细胞数量之间的关系
正常肝组织组与肝癌Ⅰa-Ⅱa组NKT细胞比较,t= 6.2141,P<0.0005;正常肝组织组与肝癌Ⅱb-Ⅲb组NKT细胞比较,t=5.9873,P<0.0005;Ⅰa-Ⅱa组与Ⅱb-Ⅲb组NKT细胞比较,t=2.7733,P<0.0005。
?
3 讨论
肝脏是一个独特的免疫器官,肝脏的慢性炎症和相关的再生愈合反应与肝纤维化、肝硬化、肝癌息息相关[9],NKT细胞在肝脏的倾向性分布说明NKT细胞在肝脏免疫调节中具有极其重要的作用。自然杀伤性T淋巴细胞根据TCR表达的稳定性分为三型,Ⅰ型NKT细胞TCR Vα链高度稳定,其表型小鼠为Va14,人的为Vα24和Jα18,同时表达Vβ链。Ⅱ型和Ⅲ型缺乏恒定的TCR,具有多样性。Ⅰ型NKT细胞在肿瘤免疫过程中既发挥免疫保护的作用也具有免疫抑制的功能,Ⅰ型NKT细胞在肿瘤免疫过程中的双向调节作用,可能与Ⅰ型NKT细胞即表达Thl型细胞因子,如IFN-γ、IL-2,发挥免疫保护作用,也可以表达ThⅡ型细胞因子如IL-13、IL-14在肿瘤免疫中发挥抑制作用,因此,不同组织中的NKT细胞,由于所处的细胞微环境不同,导致占主导地位的细胞类型也不同,分泌的细胞因子也不同,从而表现出不同的免疫效应。研究发现Ⅰ型和Ⅱ型NKT细胞之间不仅具有相反的作用还能发挥相互调节的作用[10]。由自糖脂或溶血磷脂介导的II型NKT细胞的活化过程揭示了Ⅰ型与Ⅱ型NKT细胞交叉调节的主要机制。在硫苷脂的作用下,浆细胞样树突状细胞,而非传统的树突状细胞的CD1d表达明显上调,导致了硫酯反应II型NKT细胞的活化和IL-12及MIP-2的分泌,从而致使I型NKT细胞被招募到肝脏[11]。一般来说,NKT细胞在肿瘤免疫中扮演重要得双重角色,他们能够通过效应CD4/CD8+细胞激活来促进抗肿瘤反应,还可以通过招募促进肿瘤的生长抑制或调解T细胞耐受或产生Th2细胞因子,随后导致肿瘤抗原CD8+T细胞的扩张[12]。抑制细胞因子爆发和抑制中性粒细胞招募到肝脏的作用导致了硫脂介导的II型NKT细胞的活化。在此活化作用下,无反应性I型NKT细胞和IL-10分泌型浆细胞样树突状细胞能够抑制适应性免疫[13]。随着研究的深入NKT细胞选择分化和成熟过程及其调控研究有了很大的进展。肝脏微环境中Wnt信号通路激活可引起NKT细胞失能[14]。这些特点也说明NKT细胞以双刃剑的方式调节免疫系统。在肿瘤患者体内扩增NKT细胞研究表明患者体内应用α-Galcer后NKT数目明显增加,从而起到抗肿瘤的作用[15,16],但αGalcer短时间内可观察到大量Thl型(如IL-2、TNF-α和IFN-γ等)和Th2型(如IL-4、IL-5和IL-10等)细胞因子的释放,并且NKT细胞表面CD69等成熟分子标志物上调。但在细胞因子释放高峰之后,再次给予aGalCer的刺激,NKT细胞将毫无反应,不能再分泌细胞因子,处于失活状态,即“失能”。研究证实,β-ManCer能激活NKT细胞并且不会导致其失能,即使重复使用仍可刺激NKT细胞产生抗肿瘤免疫反应,不会引起NKT细胞内PD-1因子上调[17],这有别于aGalCer。因此,β-ManCer可以代替aGalCer成为NKT细胞更好的激动剂。这为过继细胞免疫治疗提供了新的思路。M singh[18]等研究认为NKT活化剂α-半乳糖苷神经酰胺可以增强Listeria乳腺癌疫苗的功效,且无毒副作用。发现刺激NKT细胞可以提高部分肝切除术后的肝再生[19]。在应用iKNT细胞治疗晚期黑色素瘤的I期临床试验中指出通过自体体外扩增iNKT细胞治疗晚期黑色素瘤是安全有效的[20]。随着研究的深入,NKT细胞的临床应用越来广泛。
因此,我们的试验主要探寻在不同分期肝癌中的NKT细胞数量分布变化,从间接阐明NKT细胞与肝癌转移的相关性。正常肝脏组织内淋巴细胞多集中在肝血窦内,早期肝癌大量淋巴细胞随癌细胞的扩散浸润至肝组织内,随病程进展肝脏内环境变化NKT细胞数量逐渐下降,晚期肝癌NKT细胞数量进一步下降,视野内NKT数量很少。正常肝组织与各分期肝癌NKT细胞数量有明显差异(P<0.05),各分期肝癌中Ⅰa期-Ⅱa期与Ⅱb期-Ⅲb期的NKT细胞数量有明显差异(P<0.05)。因此,我们认为肝癌组织中NKT细胞的数量依赖于组织被癌细胞侵袭的程度不同而分布不同,NKT淋巴细胞数量与肝癌转移具有相关性,肝脏的微环境直接影响NKT淋巴细胞的分化。
[1]International Agency for Research on Cancer.GLOBOCAN 2012:Estimated cancer incidence,mortality and prevalence worldwide in 2012,2014[EB/OL]. [2014-12-16].http://golbocan.iarc.fr/Defqult.aspx.
[2]Wanqing Chen PhD MD,Rongshou Zheng MPH,Peter D.Baade,PhD,et al. Cancer Statistics in China,2015[J].CA CANCER J CLIN 2016,66(2):115-132.
[3]Taniguchi M,Seino K,Nakayama T.The NKT cell system:bridging innate and acquired immunity[J].Nat Immunol,2003,4:1164-1165.
[4]Bendelac A,Savage PB,Teyton L.The biology of NKT cells[J].Annu Rev Immunol,2007,25:297-336.
[5]Godfrey DI,Stankovic S,Baxter AG.Raising the NKT cell family[J].Nat Immunol,2010,11:197-206.
[6]Brigl M,Brenner MB.CD1:antigen presentation and T cell function[J].Annu Rev Immunol,2004,22:817-890.
[7]Bendelac A,Savage P B,Teyton L.The biology of NKT cells[J].Annu Rev Immunol,2007,25:297-336.
[8]Hua wang Shi yin.Natural killer T cells in liver injury,inflammation and cancer [J].Expert Rev.Gastroenterol.Hepatol.2015,9(8):1-9.
[9]Luedde T,Schwabe RF.NF-kappa B in the liver-linking injury,fibrosis and hepatocellular carcinoma[J].Nat Rev Gastroenterol Hepatol,2011,8:108-118.
[10]Ambrosino E,Terabe M,Halder RC,et a1.Cross-regulation between type I and type II NKT cells in regulating tumor immunity:a new immunoregulatory axis[J].J Imunol,2007,179(8):5126-5136.
[11]Halder RC,Aguilera C,Maricic I,et al.Type II NKT cell-mediated anergy induction in type I NKT cells prevents inflammatory liver disease[J].J Clin Invest,2007,117:2302-2312.
[12]Bricard G,Cesson V,Devevre E,et al.Enrichment of human CD4+V(alpha)24/ Vbeta11 invariant NKT cells in intrahepatic malignant tumors[J].J Immunol, 2009,182:5140-5151.
[13]Maricic I,Sheng H,Marrero I,et al.Chaturvedi S et al.Inhibition of type I natural killer T cells by retinoids or following sulfatide-mediated activation of type II natural killer T cells attenuates alcoholic liver disease in mice[J].Hepatology,2015,61:1357-1369.
[14]Deng ZB,Zhuang X,Ju S,el a1.Intestinal mucus-derived nanop-article-mediated activation of Wnt/beta-catenin signaling plays arole in induction of liver natural killer T cell anergy in mice[J].Hepatology,2013,57(3):1250-1261
[15]Ishikawa A,Motohashi S,Ishikawa E,et a1.A phase I study ofal-pha-Galactosylceramide(KRN7000)-pulsed dendritic cells in patients with advanced and recurrent non-small cell lung cancer[J].Clin Cancer Res,2005,ll(5):1910-1917.
[16]Chang D,Osman K,Connolly J,et a1.Sustained expansion of NKTcells and antigen-specific T cells after injection of alpha-galactosyl-ceramide loaded mature dendritic cells in cancer patients[J].J ExpMed,2005,201(9):1503-1517.
[17]O’Konek Jj,Kato S,Takao S,et a1.Beta-mannosylceramide acti-vates type I natural killer l cells to induce tumor immunity without inducing long-term functional anergy[J].Clin CancerRes,2013,19(16):4404-4411.
[18]M Singh,W Quispe-Tintaya,D Chandra,et al.Direct incorporation of the NKT-cell activator α-galactosylceramide into a recombinant Listeria monocytogenes improves breast cancer vaccine efficacy[J].British Journal Of Cancer, 2014,111,194-194.
[19]Ann-Kathrin J rger,Lei Liu,Karin Fehlner,et al.Impact of NKT Cells and LFA-1 on Liver Regeneration under Subseptic Conditions[J].PLoS One.2016, 15;11(12)
[20]Exley MA,Friedlander,Alatrakchi N,et al.Adoptive Transfer of Invariant NKT Cells as Immunotherapy for Advanced Melanoma:a Phase 1 Clinical Trial[J]. Clin Cancer Res.2017 Feb 13.
Natural Killer T Cells Quantity Distribution Change and the Correlation of Liver Cancer Metastasis
Liu Changfang,Wu Cuijiao,Li Hui⋆,Zhang Jing⋆
(Qingdao University,Qingdao 266000,Shandong;*The Affiliated Hospital to Qingdao University, Qingdao 266000,Shandong)
ObjectiveTo study the number of natural killer T cells distribution change and the correlation of liver cancer metastasis.MethodsRat anti CD3,CD56 double monoclonal antibody immune method,normal liver tissue and natural killer T cells in different stages of liver cancer tissue and the number of distribution,using the statistical analysis of the number of natural killer T cells distribution change and the correlation of liver cancer cell migration.SPSS20.0 application software,the data obtained using analysis of variance and t test.ResultsEach stage the number of natural killer T cells in the liver cancer tissue and normal liver tissue,that the number of natural killer T cells in comparison,P<0.0005. LiverⅠa period-Ⅱa period withⅡb period-Ⅲb compared the number of natural killer T cells,P<0.005.ConclusionThe number of natural killer T cells in the liver tissue depends on the different degree of organization from the cancer cells and the distribution is different,the liver microenvironment influence natural killer T cell differentiation,number of natural killer T cells associated with liver metastasis.
Liver cancer;Natural killer T cells;Immunohistochemistry
R735.7;R392.33
:A
:1008-4118(2017)01-0004-04
10.3969/j.issn.1008-4118.2017.01.002
2016-12-03
刘长芳(1979-)女,汉,现在青岛大学附属医院东院肿瘤化疗科工作。研究方向:分子生物学。
吴翠娇。wucjzr@163.com。
