镇江地区汉族人群的微量元素与前列腺癌关系
2017-05-15胡潇陆洪兵崔飞伦
胡潇+陆洪兵+崔飞伦
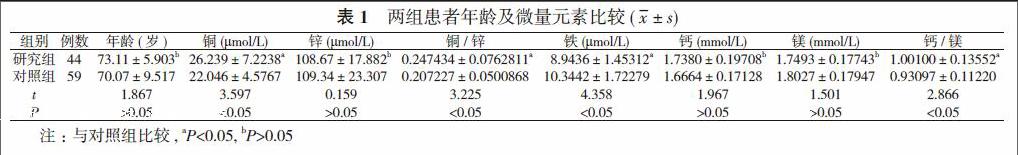
【摘要】目的探讨镇江地区汉族人群血清中微量元素浓度与前列腺癌发病的关系。方法 103例行前列腺手术治疗及穿刺活检的汉族男性患者为研究对象, 记录患者病历资料并采集血清, 检测微量元素铜、锌、铁、钙和镁含量。结果 103例患者中, 前列腺癌44例(研究组), 非前列腺癌59例(对照组)。血前列腺特异性抗原(PSA)>100 ng/ml的前列腺癌患者有16例, Gleason评分>8分的有29例。患者年龄为60~89 岁, 两组患者的年龄比较, 差异无统计学意义(t=1.867, P>0.05)。研究组血铜含量高于对照组, 血铁含量低于对照组, 差异均具有统计学意义 (t=3.597、4.358, P<0.05);两组患者的血锌、钙、镁含量比较, 差异均无统计学意义(t=0.159、1.967、1.501, P>0.05);但血铜/锌比值和钙/镁比值比较, 差异均具有统计学意义 (t=3.225、2.866, P<0.05)。结论 镇江地区汉族人群血清微量元素铜、锌、铁、钙和镁的浓度与前列腺癌的发生可能存在相关性。
【关键词】 微量元素;前列腺癌;关系
DOI:10.14163/j.cnki.11-5547/r.2017.10.041
前列腺癌(prostate cancer , PCa)是一种较常见的恶性肿瘤, 目前在美国其发病率已经超过肺癌, 居第一位。2012年我国肿瘤登记地区前列腺癌发病率為9.92/10万, 列男性恶性肿瘤发病率的第六位。虽然我国前列腺癌的发病率低于西方国家, 但呈显著增长趋势。针对前列腺癌病因及致病机制学术领域提出多种假说, 对其确切机制尚无定论。相关研究提出, 作为人体内的酶协同因子的微量元素缺乏时, 人体对癌的抵抗能力会大大削弱。但各种微量元素与前列腺癌发病之间的关系, 尚无明确临床数据分析, 本研究旨在探讨镇江地区汉族人群血清中各种微量元素浓度与前列腺癌发病的关系。
1 资料与方法
1. 1 一般资料 收集2013年1月~2015年12月本院泌尿外科行前列腺手术治疗及穿刺活检的汉族男性患者103例。纳入标准:①年龄在60岁以上因排尿困难至本院行经尿道前列腺电切术的患者;②因血PSA浓度异常(PSA>4 ng/ml)或者直肠指检前列腺有异常而行前列腺手术或穿刺活检者。排除标准:无明确病理诊断的患者以及不能接受血清微量元素检测者。
1. 2 方法 记录患者姓名、年龄、病史、病理结果等。采集血清, 使用原子发射光电直流光谱法检测微量元素铜、锌、铁、钙和镁含量。
1. 3 统计学方法 采用SPSS18.0统计学软件进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验。P<0.05表示差异具有统计学意义。
2 结果
103例患者中, 前列腺癌44例(研究组), 非前列腺癌59例(对照组)。血PSA>100 ng/ml的前列腺癌患者有16例, Gleason评分>8分的有29例。患者年龄为60~89 岁, 两组患者的年龄比较, 差异无统计学意义(t=1.867, P>0.05)。研究组血铜含量高于对照组, 血铁含量低于对照组, 差异均具有统计学意义 (t=3.597、4.358, P<0.05);两组患者的血锌、钙、镁含量比较, 差异均无统计学意义(t=0.159、1.967、1.501, P>0.05);但血铜/锌比值和钙/镁比值比较, 差异均具有统计学意义 (t=3.225、2.866, P<0.05)。见表1。
3 讨论
人体必需的微量元素有四大功能:①维持细胞膜稳定;②细胞结构的基本组成部分;③激素作用的基本要素;④人体内酶的协同因子。因此, 当这些微量元素缺乏时, 细胞膜的稳定性破坏、膜两侧的电位差改变以及使细胞膜的结构发生变化, 最终使细胞膜的功能丧失。微量元素在人体中的平衡被打破, 潜在毒性的元素和非必需的元素在人体内过度堆积, 将导致疾病发生。
铜是人体和动物都必需的微量元素, 但是高浓度的铜(高于正常值)可能会使毒性自由基增多, 引起DNA损伤, 导致细胞增生甚至癌变。
锌, 超氧化物歧化酶是机体细胞抵御氧化和损伤最重要的酶类之一, 在构成该酶的诸多金属组分中锌占首位。此外, 锌还参与构成了300多种蛋白和100多种DNA结合蛋白。因此, 锌在维持机体的结构和功能方面发挥了广泛的作用。目前研究发现前列腺腺体中锌的含量远远高于人体其他组织。据Costello 等[1]的长期研究报道, 前列腺癌细胞的锌水平与正常前列腺或良性增生的组织相比, 显著下降。提示丧失积聚锌的能力是前列腺细胞癌变的重要因素。到目前为止, 没有任何病例显示恶性前列腺癌组织仍能保持高锌或高柠檬酸盐水平, 这显示:无论患者的一般情况、肿瘤分期、取样部位、检测方法或者其他可变因素如何, 在恶变的早期必然会出现低锌和低柠檬酸盐改变。Costello等[2]已经通过对前列腺原位癌的恶变区进行磁共振光谱分析证实这一结论。而且这种改变要早于很多组织病理学证据的出现, 因此在癌变前期, 就可以通过锌含量的降低来进行预测。但 Banas等[3]却认为这个观点未必完全正确, 他们发现锌的浓度在前列腺癌中反而出现了升高。
本次研究发现, 103例患者中, 前列腺癌44例(研究组), 非前列腺癌59例(对照组)。血PSA>100 ng/ml的前列腺癌患者有16例, Gleason评分>8分的有29例。患者年龄为60~89 岁, 两组患者的年龄比较, 差异无统计学意义(t=1.867, P>0.05)。研究组血铜含量高于对照组, 血铁含量低于对照组, 差异均具有统计学意义(t=3.597、4.358, P<0.05);两组患者的血锌、钙、镁含量比较, 差异均无统计学意义(t=0.159、1.967、1.501, P>0.05);但血铜/锌比值和钙/镁比值比较, 差异均具有统计学意义 (t=3.225、2.866, P<0.05)。
前列腺癌的患者血清铜水平显著高于对照组, 而两者的血清锌含量并没有显著差异, Parr-Sturgess等[4]研究发现, 铜离子浓度可刺激锌蛋白酶介导的蛋白脱落, 并增强了前列腺癌细胞的侵袭性, 是促进前列腺癌细胞侵袭的一个重要因素, 铜/锌比率要比单一评价血清铜或血清锌更有意义。研究显示前列腺癌病例、正常对照在铜/锌水平上差异有显著性, 提示铜/锌水平升高与前列腺癌的发病危险存在相关性。
铁作为还原金属, 在生物学系统中促使了活性氧产物的增加。虽然铁是所有生命体都必需的基本元素, 但是无论是铁过量还是铁缺乏, 都会导致DNA氧化损伤[5]。Gaur等[6]流行病学调查显示铁代谢和癌症风险之间呈负相关关系。本研究结论显示前列腺癌的患者血清铁明显降低。
钙是一个具有广泛生理调节功能的细胞内信使, 其重要功能之一是诱导细胞在完成使命后的凋亡。如果这种功能发生障碍, 那么便有可能形成肿瘤[7-9]。Prevarskaya等[7]发现前列腺癌的发生, 可能是因为细胞内质网内Ca2+储存完全被消耗, 导致凋亡被抑制而引起的。本次研究发现前列腺癌患者的血清钙含量和对照组无明显差异。
镁在DNA的修补、细胞的分化、生殖、凋亡以及再生中发挥着重要作用, 镁的缺乏与炎症反应和氧化应激有关[10-12]。研究中两组的血清镁含量并没有显著差异。
作者发现研究组的血清钙/镁要显著高于对照组(P<0.05), 这意味着高钙/镁比对于前列腺癌的发生有着重要的影响, 其机制还有待进一步研究。
本次研究显示, 研究组较对照组血清铜、血清铁、血清铜/锌及血清钙/镁有显著差异。Kaba 等[8]亦曾对亚太人种进行过一次小样本的研究, 研究显示:相对于健康对照组, 前列腺癌人群的血清钴、铜、镁和铅明显增高, 而铁、锰和 锌水平显著降低, 和本次研究的结论基本一致, 并且本次研究亦补充发现血清钙/镁、铜/锌相对于单个元素更有意义。这些差异很可能对前列腺癌的发病起着重要的影响。
综上所述, 镇江地区汉族人群血清微量元素铜、锌、铁、钙和镁的浓度与前列腺癌的发生可能存在相关性。然而, 鉴于本次研究样本量较小, 且所涉及的微量元素种类有限, 如要更进一步明确我国汉族人群的各种微量元素与前列腺癌发生以及Gleason评分和肿瘤分期的相关性, 研究组将继续完善相关研究数据。
参考文献
[1] Costello LC, Franklin RB. A comprehensive review of the role of zinc in normal prostate function and metabolism; and its implications in prostate cancer. Arch Biochem Biophys, 2016(611):100-112.
[2] Costello LC, Franklin RB, Kurhanewicz J. Metabolic Diagnosis of Prostate Cancer by Magnetic Resonance Spectroscopy. Encyclopedia of Cancer, 2002:167-177.
[3] Banas A, Kwiatek WM, Banas K, et al. Correlation of concentrations of selected trace elements with Gleason grade of prostate tissues. JBIC Journal of Biological Inorganic Chemistry, 2010, 15(7):1147.
[4] Parr-Sturgess CA, Tinker CL, Hart CA, et al. Copper modulates zinc metalloproteinase-dependent ectodomain shedding of key signaling and adhesion proteins and promotes the invasion of prostate cancer epithelial cells. Molecular Cancer Research Mcr, 2012, 10(10):1282-1293.
[5] Ames BN. DNA damage from micronutrient deficiencies is likely to be a major cause of cancer. Mutation Research/fundamental & Molecular Mechanisms of Mutagenesis, 2001, 475(1-2):7-20.
[6] Gaur A, Collins H, Wulaningsih W, et al. Iron metabolism and risk of cancer in the Swedish AMORIS study. Cancer Causes & Control, 2013, 24(7):1393-1402.
[7] Prevarskaya N, Skryma R, Shuba Y. Ca2+, homeostasis in apoptotic resistance of prostate cancer cells. Biochemical & Biophysical Research Communications, 2004, 322(4):1326.
[8] Kaba M, Pirincci N, Yuksel MB, et al. Serum levels of trace elements in patients with prostate cancer. Asian Pacific Journal of Cancer Prevention Apjcp, 2014, 15(6):2625-2629.
[9] 徐志兵. 微量元素與前列腺癌的关系的实验研究. 复旦大学, 2001.
[10] 安宁, 何维敬. 微量元素与前列腺癌发病危险的病例——对照研究. 微量元素与健康研究, 2000(4):17-19.
[11] 胡潇, 崔飞伦, 钱立新. 微量元素与前列腺癌. 国际泌尿系统杂志, 2007, 27(3):329-332.
[12] 安宁, 陈晗, 李文. 微量元素与前列腺癌发病危险的相关因素研究. 中国辐射卫生, 2007, 26(1):115-116.
[收稿日期:2017-02-13]
作者单位:212002 镇江市第一人民医院泌尿外科
通讯作者:崔飞伦
