S组山羊草属 Psy1基因片段的克隆与序列分析
2017-05-15王建武何心尧夏先春何中虎
王建武,何心尧,王 辉,夏先春,何中虎,5
(1.长江大学农学院,湖北荆州 434025; 2.中国农业科学院作物科学研究所/国家小麦改良中心,北京 100081; 3.西北农林科技大学农学院,陕西杨凌 712100; 4.国际玉米小麦改良中心,墨西哥特斯科科 56237; 5.CIMMYT中国办事处,北京 100081)
S组山羊草属 Psy1基因片段的克隆与序列分析
王建武1,3,何心尧2,4,王 辉3,夏先春2,何中虎2,5
(1.长江大学农学院,湖北荆州 434025; 2.中国农业科学院作物科学研究所/国家小麦改良中心,北京 100081; 3.西北农林科技大学农学院,陕西杨凌 712100; 4.国际玉米小麦改良中心,墨西哥特斯科科 56237; 5.CIMMYT中国办事处,北京 100081)
类胡萝卜素含量是影响小麦面制品色泽的主要因素,而 Psy1基因则是类胡萝卜素生物合成中的关键基因。为了了解小麦近缘种S组山羊草的 Psy1基因多样性分布规律,以高大山羊草、双角山羊草及西尔斯山羊草为材料,应用同源基因克隆技术对其进行 Psy1基因克隆。结果表明,利用分子标记YP7B-5检测获得的8个新 Psy1-S1等位变异的部分序列覆盖了 Psy1基因的第二外显子和第二内含子的全部以及第三外显子93.1%的区域。在与包括来自普通小麦的 Psy1-B1d、栽培二粒小麦的 Psy1-B1k以及拟斯卑尔脱山羊草的 Psy1-S1a、 Psy1-S1b、 Psy1-S1c对应部分的序列综合分析发现一致性高达93.4%~98.5%,而且编码区序列差异均为同义突变,没有造成编码氨基酸的变化。而第二内含子序列则存在数个SNP及InDel,尤其是 Psy1-S1h的161 bp大片段插入和 Psy1-S1i的177 bp大片段缺失,导致与其他 Psy1-B1/ Psy1-S1等位变异产生较大的长度差异。分析表明,内含子的差异是造成 Psy1基因多样性的主要原因。
小麦籽粒黄色素;山羊草;八氢番茄红素合成酶基因 Psy1;基因片段克隆
面粉及面制品的色泽是衡量小麦品质的一项重要指标,而黄色素含量是影响面制品颜色的主要因素[1-3]。位于小麦第七部分同源群的 Psy1基因则是类胡萝卜素生物合成中的关键基因[4-6],决定面粉黄色素含量。大量研究鉴定了普通小麦及其近缘种 Psy1等位变异共计57个[5-14]。针对 Psy1-A1位点,Zhang和Dubcovsky[5]在硬粒小麦中克隆了 Psy1-A1l;Ravel等[6]在普通小麦中克隆了 Psy1-A1ca、 Psy1-A1cb、 Psy1-A1ka、 Psy1-A1kb 、 Psy1-A1ra、 Psy1-A1rb 、 Psy1-A1x ;He等[7-9]在普通小麦中克隆了 Psy1-A1a、 Psy1-A1b 、 Psy1-A1c ,在硬粒小麦中克隆了 Psy1-A1d 、 Psy1-A1e ;Singh等[10]在硬粒小麦中克隆了 Psy-A1o;Howitt等[11]在普通小麦克隆了 Psy1-A1p 、Psy1-A1q、 Psy1-A1r、 Psy1-A1s ;Wang等[12]在乌拉尔图小麦中克隆了 Psy1-A1f、 Psy1-A1g,在野生一粒小麦和栽培一粒小麦中克隆了 Psy1-A1h、 Psy1-A1i 、 Psy1-A1j ,在野生二粒小麦、栽培二粒小麦和斯卑尔脱小麦中克隆了 Psy1-A1k 、 Psy1-A1m 、 Psy1-A1n;Crawford等[13]在普通小麦中克隆了 Psy1-A1t 。针对 Psy1-B1位点,Zhang和Dubcovsky[5]在硬粒小麦中克隆了 Psy1-B1n 、 Psy1-B1o ;Ravel等[6]在普通小麦中克隆了 Psy1-B1aa 、 Psy1-B1ca ;He等[8-9]在普通小麦中克隆了 Psy1-B1a 、 Psy1-B1b 、 Psy1-B1c、 Psy1-B1d、 Psy1-B1e ,在硬粒小麦中克隆了 Psy1-B1f、 Psy1-B1g ;Wang等[12]在野生二粒小麦、栽培二粒小麦和斯卑尔脱小麦中克隆了 Psy1-B1h 、 Psy1-B1i 、 Psy1-B1j 、 Psy1-B1k、 Psy1-B1l、 Psy1-B1m。针对 Psy1-D1位点,Wang等[12]在粗山羊草和斯卑尔脱小麦中克隆了 Psy1-D1b、 Psy1-D1c、 Psy1-D1d、 Psy1-D1e、 Psy1-D1f、 Psy1-D1h、 Psy1-D1i、 Psy1-D1j;Wang等[12]和Crawford等[13]在普通小麦中克隆了 Psy1-D1a、 Psy1-D1g、 Psy1-D1k、 Psy1-D1l、 Psy1-D1m。其中,来自近缘种的 Psy1等位变异30个[5,9-10,12],占52.6%,极大丰富了普通小麦 Psy1等位基因遗传多样性。此外,Wang等[12]获得了小麦B基因组可能的主要供体拟斯卑尔脱山羊草S基因组的3个 Psy1等位变异 Psy1-S1a、 Psy1-S1b、 Psy1-S1c。山羊草属是小麦改良的重要基因资源,但S组山羊草属的高大山羊草、双角山羊草、西尔斯山羊草的 Psy1基因还未被克隆。鉴于此,本研究以高大山羊草、双角山羊草、西尔斯山羊草为材料,采用同源克隆技术发掘新的 Psy1基因等位变异,旨在发现S组山羊草的 Psy1基因多样性分布规律,为小麦品质改良提供丰富的基因资源。
1 材料与方法
1.1 植物材料
3套S组山羊草属种,总计11份材料。其中,4份高大山羊草材料(Y152、Y153、Y154、Y155)由中国农业科学院国家作物种质资源中心提供; 2份高大山羊草(PI604107、PI604119)、2份双角山羊草(CIae47、CIae70)及1份西尔斯山羊草(PI599137)由首都师范大学生命科学学院提供;2份双角山羊草(CWI4250、CWI4266)由国际玉米小麦改良中心提供。
1.2 DNA的提取及PCR扩增
DNA提取参照Lagudah等[15]。 PCR反应在MJ Research PTC-200 PCR仪上进行。PCR反应体系为20 μL:模板DNA 50 ng,Taq酶1 U(北京天根生化科技公司)或LA-Taq酶1 U(大连宝生物工程有限公司),上、下游引物(5 μmol·L-1)各1.0 μL,dNTPs(25 μmol·L-1)0.2 μL,10×PCR缓冲液2 μL,用ddH2O补足至20 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,60~63 ℃退火30 s,72 ℃延伸1 min,40个循环;72 ℃延伸5 min,4 ℃保温。
1.3 目的基因片段的克隆及测序
根据已克隆的 Psy1-A1、 Psy1-B1/ Psy1-S1和 Psy1-D1等位变异的保守序列开发了一个针对S组山羊草属的分子标记YP7B-5(上游引物:5′-GGACCTTGCTGATGACGGAG-3′,下游引物:5′-GGGGAACTTGGTGATGGTGTC-3′),以检测11份S组山羊草材料的 Psy1等位变异。PCR扩增目标片段约为800 bp。经1.5%琼脂糖凝胶电泳分离,将目标条带连接至pMD18-T载体上进行克隆测序。测序由北京奥科生物技术有限责任公司(http://www.augct.com)和上海生工生物工程技术服务有限公司(http://www.sangon.com)完成。
1.4 序列分析
应用DNAMAN软件(http://www.lynnon.com)将得到的扩增片段序列与来自普通小麦及其近缘种对应的 (Psy1-B1/ Psy1-S1)等位基因进行序列比对,在确定外显子和内含子位置的同时进一步检测可能存在的SNP和InDel。
2 结果与分析
2.1 Psy1-S1等位变异鉴定结果
利用标记YP7B-5检测11份S组山羊草(4个双角山羊草、1个西尔斯山羊草、6个高大山羊草),发现其存在丰富的多态性(图1)。随后对它们的PCR扩增产物进行序列分析,4份双角山羊草YP7B-5扩增片段序列完全一致,经鉴定为新的等位变异,命名为 Psy1-S1d ;1份西尔斯山羊草YP7B-5扩增片段的序列经鉴定为新的等位变异,命名为 Psy1-S1e ;6份高大山羊草YP7B-5扩增片段的序列经鉴定均为新的等位变异,即 Psy1-S1f 、 Psy1-S1g 、 Psy1-S1h、 Psy1-S1i、 Psy1-S1j 和 Psy1-S1k(图2)。这8个 Psy1-S1新等位变异的YP7B-5扩增片段序列覆盖了 Psy1基因的第二外显子和第二内含子的全部区域以及第三外显子的绝大部分区域(93.1%)(表1)。
2.2 Psy1-B1/ Psy1-S1等位变异的长度分析
为了更好地解析 Psy1-B1/ Psy1-S1等位基因序列的特点,将Wang等[12]构建的普通小麦及其近缘种 Psy1等位变异系统发育树中共同拥有B组和S组的β4簇里5个 Psy1-B1/ Psy1-S1等位基因及本研究发现的8个 Psy1-S1等位基因综合在一起分析。其中,β4簇里5个 Psy1-B1/ Psy1-S1等位变异具有很高的序列一致性,包括来自普通小麦的 Psy1-B1d,来自栽培二粒小麦的 Psy1-B1k,以及来自拟斯卑尔脱山羊草的 Psy1-S1a、 Psy1-S1b和 Psy1-S1c。这13个 Psy1-B1/ Psy1-S1等位变异对应的YP7B-5扩增序列在长度上表现出了一定的变异,最短为615 bp( Psy1-S1i),最长为927 bp( Psy1-S1h),都是由内含子长度差异造成的,而外显子均无差异,第二外显子为51 bp,包含的第三外显子部分为161 bp(表1)。
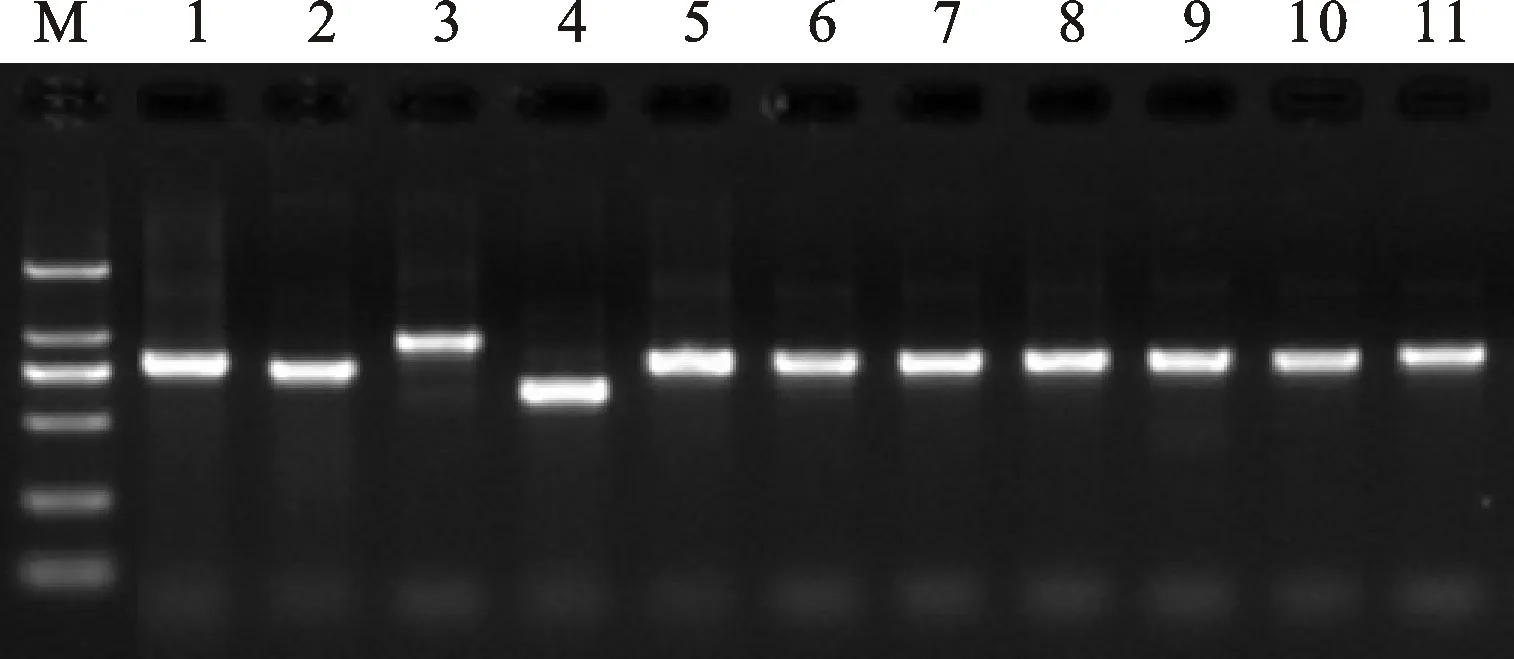
M:核酸分子量标准DL2000;1:Y152(高大山羊草, Psy1-S1f,779 bp);2:Y153(高大山羊草, Psy1-S1g,739 bp);3:Y154(高大山羊草, Psy1-S1h,927 bp);4:Y155(高大山羊草, Psy1-S1i,615 bp);5:PI604107(高大山羊草, Psy1-S1f,778 bp);6:PI604119(高大山羊草, Psy1-S1k,776 bp);7:CIae47(双角山羊草, Psy1-S1d,779 bp);8:CWI4250(双角山羊草, Psy1-S1d,779 bp);9:CWI4266(双角山羊草, Psy1-S1d,779 bp);10:CIae70(双角山羊草, Psy1-S1d,779 bp);11:PI599137(西尔斯山羊草, Psy1-S1e,801 bp)。
M:DNA Ladder DL2000; 1:Y152(Aegilopslongissima, Psy1-S1f,779 bp); 2:Y153(Ae.longissima, Psy1-S1g,739 bp); 3:Y154(Ae.longissima, Psy1-S1h,927 bp); 4:Y155(Ae.longissima, Psy1-S1i,615 bp); 5:PI604107(Ae.longissima, Psy1-S1j,778 bp); 6:PI604119(Ae.longissima, Psy1-S1k,776 bp); 7:CIae47(Ae.bicornis, Psy1-S1d,779 bp); 8:CWI4250(Ae.bicornis, Psy1-S1d,779 bp); 9:CWI4266(Ae.bicornis, Psy1-S1d,779 bp); 10:CIae70(Ae.bicornis, Psy1-S1d,779 bp); 11:PI599137(Ae.searsii, Psy1-S1e,801 bp)
图1 分子标记YP7B-5检测11份S组山羊草的电泳图
Fig.1 PCR amplification with molecular marker YP7B-5 in eleven lines ofAegilopsspecies comprising S genome
2.3 Psy1-B1/ Psy1-S1等位变异的序列分析
这13个 Psy1-B1/ Psy1-S1等位变异对应的YP7B-5扩增序列一致性为93.4%~98.5%,其编码区序列差异较小,仅存在15个SNP,包括第2外显子2个SNP以及第3外显子的13个SNP,均为同义突变,没有造成编码氨基酸的变化(表2、表3、图2)。在第2外显子中, Psy1-B1k 、 Psy1-S1a、 Psy1-S1b、 Psy1-S1d、 Psy1-S1e、 Psy1-S1f、 Psy1-S1h、 Psy1-S1i、 Psy1-S1j、 Psy1-S1k完全相同。 Psy1-B1d、 Psy1-S1c完全相同,并与 Psy1-S1a仅有1个SNP。 Psy1-S1g与 Psy1-S1a仅有1个SNP。在第3外显子中, Psy1-B1d、 Psy1-S1a完全相同。 Psy1-B1k与 Psy1-S1a共有3个SNP。 Psy1-S1b与 Psy1-S1a仅有1个SNP。 Psy1-S1c与 Psy1-S1a仅有1个SNP。 Psy1-S1d与 Psy1-S1a共有3个SNP。 Psy1-S1e与 Psy1-S1a共有6个SNP。 Psy1-S1f与 Psy1-S1a仅有1个SNP。 Psy1-S1g与 Psy1-S1a仅有1个SNP。 Psy1-S1h与 Psy1-S1a共有3个SNP。 Psy1-S1i与 Psy1-S1a仅有1个SNP。 Psy1-S1j与 Psy1-S1a共有8个SNP。 Psy1-S1k与 Psy1-S1a共有3个SNP。

表1 13个 Psy1-B1/ Psy1-S1等位变异YP7B-5扩增区域的长度多态性
Psy1-A1、 Psy1-B1/ Psy1-S1和 Psy1-D1等位变异第二外显子和第三外显子的全长分别为51和173 bp。
The sizes of the 2ndexon and the 3rdexon at the Psy1-A1, Psy1-B1/Psy1-S1 and Psy1-D1 loci are 51 and 173 bp,respectively.

表2 13个 Psy1-B1/Psy1-S1等位变异YP7B-5扩增区域序列(下三角部分)及其编码蛋白序列(上三角部分)的一致性比较

表3 13个 Psy1-B1/ Psy1-S1等位变异外显子序列的单核苷酸多态性
Psy1-B1/Psy1-S1等位变异外显子序列多态性均是与 Psy1-S1a比较的结果;突变碱基后括号中的序数词为其所在位置。
The SNPs were exhibited between Psy1-S1a and other Psy1-B1/ Psy1-S1 alleles;The location of SNP of each exon at the Psy1-B1/ Psy1-S1 loci was indicated in the parentheses.
相对编码区而言,非编码区序列表现出较大差异,存在数个SNP及InDel(表4、图2)。在第2内含子中,这13个 Psy1-B1/ Psy1-S1等位变异存在很多SNP,变异范围从14( Psy1-S1g)到29( Psy1-S1i)。与 Psy1-S1a相比,在第2内含子中 Psy1-S1d、 Psy1-S1f、 Psy1-S1h、 Psy1-S1i、 Psy1-S1j存在1个2 bp插入(5′-AA-3′); Psy1-S1c存在1个5 bp插入(5′-GTTTT-3′); Psy1-S1b、 Psy1-S1e、 Psy1-S1h、 Psy1-S1i存在1个10 bp插入(5′-CACAGTGTCA-3′); Psy1-S1e存在1个16 bp插入(5′-GCCCACATTTTGCATT-3′); Psy1-B1d存在1个18 bp插入(5′-CACAGTGTGTC AGTGTCA-3′);值得注意的是, Psy1-S1h相比其他 Psy1-B1/ Psy1-S1等位变异在第2内含子多了1个161 bp大片段插入,这是造成其与其他 Psy1-B1/ Psy1-S1等位变异产生长度差异的主要原因(表1、图2)。同 Psy1-S1a相比,在第2内含子 Psy1-S1g、 Psy1-S1i存在1个1 bp缺失(5′-T-3′), Psy1-B1d、 Psy1-S1j、 Psy1-S1k存在1个1 bp缺失(5′-C-3′), Psy1-B1k、 Psy1-S1e、 Psy1-S1i存在1个1 bp缺失(5′-G-3′), Psy1-S1e、 Psy1-S1g存在1个1 bp缺失(5′-T-3′); (Psy1-B1d、) Psy1-S1b、 Psy1-S1c存在1个4 bp缺失(5′-AATC-3′), Psy1-S1c还存在1个4 bp缺失(5′-TTTT-3′); Psy1-B1d、 Psy1-S1b、 Psy1-S1d、 Psy1-S1e、 Psy1-S1f、 Psy1-S1g、 Psy1-S1h、 Psy1-S1j、 Psy1-S1k存在1个5 bp缺失(5′-CTGTA-3′); Psy1-S1h存在1个11 bp缺失(5′-TCCCCT GTTGC-3′); Psy1-S1c、 Psy1-S1h存在1个12 bp缺失(5′-AATTGAACTAGT-3′); Psy1-S1g存在1个36 bp缺失(5′-CATTTCAGATCCTCA GAAAGGGCATGCCCACATTTT-3′);值得注意的是, Psy1-S1i还存在1个177 bp缺失,导致与其他 Psy1-B1/Psy1-S1等位变异产生较大的长度差异(表1、图2)。
3 讨 论
黄色素是小麦籽粒中最主要的天然色素,影响面粉颜色和营养品质。在相当长的历史时期,降低籽粒黄色素含量是我国小麦品质育种的重要目标,这与人们青睐和推崇色泽亮白的面粉和面制品的传统观念有关。随着人们健康意识的增强,逐渐重视黄色素的营养价值,其中含有的类胡萝卜素是合成维生素A的前体物质,进而育种目标又转为提高籽粒黄色素含量。 Psy1基因是黄色素生物合成中的关键基因,He等[7]在217份中国冬麦品种中发现了2个等位变异 Psy1-A1a和 Psy1-A1b,前者占62.2%,与高黄色素含量相关,后者占37.8%,与低黄色素含量相关。Wang等[12]研究发现,来自普通小麦的等位变异 Psy1-A1a与来自野生二粒小麦、栽培二粒小麦和斯卑尔脱小麦的 Psy1-A1k表现出紧密的联系,二者仅在第四内含子有1个SNP,显示出 Psy1-A1a很可能是由 Psy1-A1k进化而来。Howitt等[11]发现, Psy1-A1b之所以与低黄色素含量相关是由于其第二内含子5′端的37 bp插入片段参与转录,发生错误剪切的3个转录本都不具有蛋白活性,只有原始类型的转录本产生有活性的蛋白。He等[9]在硬粒小麦中鉴定的 Psy1-A1e也发现了同样的37 bp插入片段,这说明此插入序列在四倍体小麦中就已经出现,但在普通小麦二倍体祖先乌拉尔图小麦中目前并未发现。He等[8]在217份中国冬麦品种发现了 Psy1-B1a、 Psy1-B1b、 Psy1-B1c和 Psy1-B1d共4个等位变异,其比例分别为39.6%、43.8%、15.7%和0.9%。其中, Psy1-B1a和 Psy1-B1c与高黄色素含量相关,而 Psy1-B1b与低黄色素含量相关。Wang等[12]研究发现,来自普通小麦的等位变异 Psy1-B1a也在野生二粒小麦和斯卑尔脱小麦中被发现。在普通小麦发现的等位变异 Psy1-B1c与在栽培二粒小麦鉴定的等位变异 Psy1-B1m表现出密切的关系,两者仅存在少数几个SNP,显示出 Psy1-B1c很可能是由 Psy1-B1m进化而来。Wang等[12]在193份中国冬麦品种发现了2个等位变异 Psy1-D1a和 Psy1-D1g,前者占99.0%,后者占1.0%。并发现来自斯卑尔脱小麦的 Psy1-D1e和 Psy1-D1f以及来自粗山羊草的 Psy1-D1i与 Psy1-D1a表现出了极高的相似性,仅有少数几个SNP,显示出它们起源上的密切关系。值得注意的是, Psy1-D1g的上游序列与来自粗山羊草的 Psy1-D1b、 Psy1-D1c和 Psy1-D1d相似性非常高,尤其是在第二内含子都含有一个172 bp片段的缺失;其下游序列则与 Psy1-D1a一致性非常高,特别是第三内含子的一个约1.2 kb大片段的插入,这些序列上的特征进一步的说明 Psy1-D1g很有可能是由于基因交换产生的新的基因类型。Ravel等[6]对372份小麦品种的研究显示, Psy1-D1g与高黄色素含量相关。
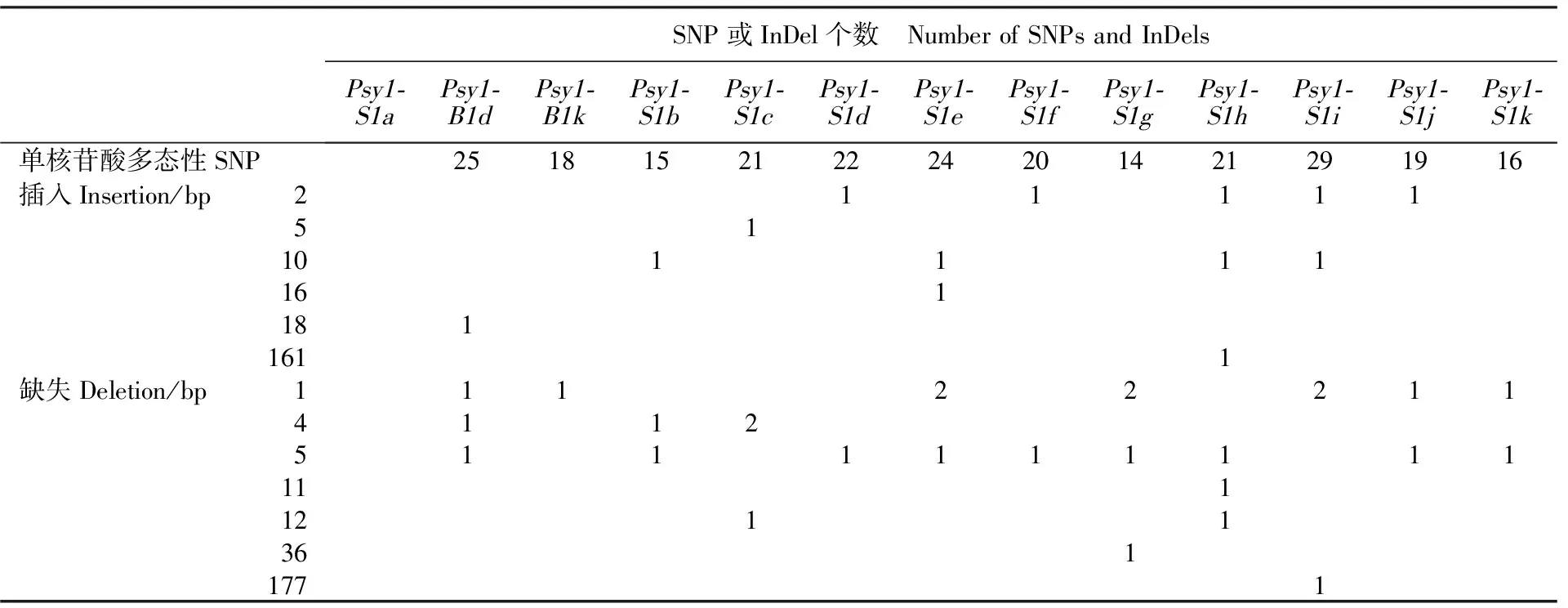
表4 13个 Psy1-B1/ Psy1-S1等位变异第二内含子的序列差异
Psy1-B1/ Psy1-S1等位变异内含子序列差异均是与 Psy1-S1a比较的结果。
SNPs and InDels in introns were exhibited between Psy1-S1a and other Psy1-B1/Psy1-S1 alleles.
(图续转下页 Be continued in next page)

缺位以短横线表示;SNP以阴影标示;内含子加下划线;同义突变的密码子及其氨基酸以黑体表示;标记YP7B-5的上下游引物以方框标出。
Gaps are indicated with dashes; SNPs are shadowed; Introns are underlined; Synonymous codons and amino acids are in bold type; The forward and reverse primers of the marker YP7B-5 are boxed.
图2 13个 Psy1-B1/Psy1-S1等位变异YP7B-5扩增区域序列的比对
Fig.2 Sequence alignment of PCR region at Psy1-B1/Psy1-S1 loci amplified with YP7B-5
对于普通小麦的A基因组和D基因组的供体来源已经明确[16-19],分别是乌拉尔图小麦和粗山羊草,而且这两个基因组测序已经完成[20-21]。对于普通小麦B基因组的起源问题,目前存在分歧的主要是具有S基因组山羊草属的拟斯卑尔脱山羊草、高大山羊草、双角山羊草和西尔斯山羊草。大多数研究[22-24]支持拟斯卑尔脱山羊草是B基因组的供体或者至少是最主要的供体。Wang等[12]利用普通小麦 Psy1基因的同源引物获得了3个拟斯卑尔脱山羊草基因全序列( Psy1-S1a、 Psy1-S1b、 Psy1-S1c),并与来自普通小麦的 Psy1-B1d和栽培二粒小麦的 Psy1-B1k聚合在系统发育树的同一簇,具有很高的序列一致性,达90.1%~96.6%,而且从拟斯卑尔脱山羊草中发现的3个等位变异 Psy1-S1a、 Psy1-S1b和 Psy1-S1c与在普通小麦的 Psy1-B1c以及栽培二粒小麦的 Psy1-B1k、 Psy1-B1m在第三内含子有着共同的转座子,支持拟斯卑尔脱山羊草是B基因组的供体的结论。而本研究对高大山羊草、双角山羊草和西尔斯山羊草的获得的8个 Psy1-S1等位变异的YP7B-5扩增序列与Wang等[12]构建的 Psy1等位变异系统发育树中拥有B组和S组的5个 Psy1-B1/Psy1-S1等位基因对应部分的序列综合分析发现一致性高达93.4%~98.5%,而且编码区序列差异均为同义突变,没有造成编码氨基酸的变化,支持了高大山羊草、双角山羊草和西尔斯山羊草也有可能参与B基因组演化的结论[25]。然而, Psy1基因共有6个外显子和5个内含子,本研究只获得第二外显子和第二内含子的全部区域以及第三外显子的绝大部分区域(93.1%),这对研究 Psy1-S1等位基因的遗传多样性具有局限性。本研究应用Wang等[12]克隆 Psy1-B1/ Psy1-S1等位变异的6对引物(P7B1、P7B3、P7B8、P7B9、P7B10和P7B11)来扩增3套S组山羊草属材料的 Psy1基因序列,结果都没有得到扩增产物,随后根据已知的 Psy1等位变异的保守区域重新设计特异引物,只有在极为保守的第二外显子和第三外显子设计的特异引物YP7B-5获得了PCR扩增产物。由此说明高大山羊草、双角山羊草和西尔斯山羊草的 Psy1基因序列与已知的 Psy1等位基因序列存在较大的差异,加大了利用同源基因克隆技术获得其 Psy1基因全序列的难度。经笔者查阅文献发现,一种用来分离与已知DNA序列邻近的未知序列的热不对称交错PCR技术为挖掘高大山羊草、双角山羊草和西尔斯山羊草的 Psy1基因全序列提供了可行的途径[26],这将对深入研究 Psy1-B1/Psy1-S1等位基因的遗传多样性以及解析普通小麦B基因组起源都具有重要意义。
[1]SYMONS S J.Computer analysis of fluorescence for the measurement of flour refinement as determined by flour ash content,flour grade colour,and tristimulus colour measurements [J].CerealChemistry,1991,68:454.
[2]LIN Z J,MISKELLY D M,MOSS H J.Suitability of various Australian wheat for Chinese-style steamed bread [J].JournaloftheScienceofFoodandAgriculture,1990,53:203.
[3]HE Z H,YANG J,ZHANG Y,etal.Pan bread and dry white Chinese noodle quality in Chinese winter wheats [J].Euphytica,2004,139:257.
[4]POZNIAK C J,KNOX R E,CLARKE F R,etal.Identification of QTL and association of a phytoene synthase gene with endosperm colour in durum wheat [J].TheoreticalandAppliedGenetics,2007,114:525.
[5]ZHANG W,DUBCOVSKY J.Association between allelic variation at the phytoene synthase 1 gene and yellow pigment content in the wheat grain [J].TheoreticalandAppliedGenetics,2008,116:635.
[6]RAVEL C,DARDEVET M,LEENHARDT F,etal.Improving the yellow pigment content of bread wheat flour by selecting the three homoeologous copies of Psy1 [J].MolecularBreeding,2013,31:87.
[7]HE X Y,ZHANG Y L,HE Z H,etal.Characterization of phytoene synthase 1 gene( Psy1) located on common wheat chromosome 7A and development of a functional marker [J].TheoreticalandAppliedGenetics,2008,116:213.
[8]HE X Y,HE Z H,MA W,etal.Allelic variants of phytoene synthase 1( Psy1) genes in Chinese and CIMMYT wheat cultivars and development of functional markers for flour color [J].MolecularBreeding,2009,23:553.
[9]HE X Y,WANG J W,AMMAR K,etal.Allelic variants at the Psy-A1 and Psy-B1 loci in durum wheat and their associations with grain yellowness [J].CropScience,2009,49:2058.
[10]SINGH A,REIMER S,POZNIAK C J,etal.Allelic variation at Psy-A1 and association with yellow pigment in durum wheat grain [J].TheoreticalandAppliedGenetics,2009,118:1539.
[11]HOWITT C A,CAVANAGH C R,BOWERMAN A F,etal.Alternative splicing,activation of cryptic exons and amino acid substitutions in carotenoid biosynthetic genes are associated with lutein accumulation in wheat endosperm [J].Functional&IntegrativeGenomics,2009,9:363.
[12]WANG J W,HE X Y,HE Z H,etal.Cloning and phylogenetic analysis of phytoene synthase( Psy1) genes in common wheat and related species [J].Hereditas,2009,146:208.
[13]CRAWFORD A C,STEFANOVA K,LAMBE W,etal.Functional relationships ofphytoenesynthase1 alleles on chromosome 7A controlling flour colour variation in selected Australian wheat genotypes [J].TheoreticalandAppliedGenetics,2011,123:95.
[14]MCINTOSH R A,DUBCOVSKY J,ROGERS W J,etal.Catalogue of gene symbols for wheat:2009 supplement [DB/OL].2009,http//shigen.nig.ac.jp/wheat/komugi/genes/macgene/supplement2009.pdf.
[15]LAGUDAH E S,APPELS R,MCNEIL D.The Nor-D3 locus ofTriticumtauschii:natural variation and genetic linkage to markers in chromosome 5 [J].Genome,1991,34:387.
[16]DVORAK J,DI TERLIZZI P,ZHANG H B,etal.The evolution of polyploid wheats:identification of the A genome donor species [J].Genome,1993,36:21.
[17]LELLEY T,STACHEL M,GRAUSGRUBER H,etal.Analysis of relationships betweenAe.tauschiiand the D genome of wheat utilizing microsatellites [J].Genome,2000,43:661.
[18]HUANG S,SIRIKHACHORNKIT A,SU X,etal.Genes encoding plastid acetyl-CoA carboxylase and 3-phosphoglycerate kinase of theTriticum/Aegilopscomplex and the evolutionary history of polyploid wheat [J].ProceedingsofNationalAcademyofSciences,2002,99:8133.
[19]PETERSEN G,SEBERG O,YDE M,etal.Phylogenetic relationships ofTriticumandAegilopsand evidence for the origin of the A,B,and D genomes of common wheat(Triticumaestivum) [J].MolecularPhylogeneticsandEvolution,2006,39:70.
[20]LING H Q,ZHAO S C,LIU D C,etal.Draft genome of the wheat A-genome progenitorTriticumurartu[J].Nature,2013,496:87.
[21]JIA J Z,ZHAO S C,KONG X Y,etal.Aegilopstauschiidraft genome sequence reveals a gene repertoire for wheat adaptation [J].Nature,2013,496:91.
[22]SARKAR P,STEBBINS G L.Morphological evidence concerning the origin of the B genome in wheat [J].AmericanJournalofBotany,1956,43:297.
[23]RILEY R,UNRAU J,CHAPMAN V.Evidence on the origin of the B genome of wheat [J].JournalofHeredity,1958,49:91.
[24]DAUD H M,GUSTAFSON J P.Molecular evidence forTriticumspeltoidesas a B-genome progenitor of wheat(Triticumaestivum) [J].Genome,1996,39:543.
[25]KERBY K,KUSPIRA J.The phylogeny of polyploid wheatsTriticumaestivum(bread wheat) andTriticumturgidum(macaroni wheat) [J].Genome,1987,29:722.
[26]LIU Y G,ROBERT F W.Thermal asymmetric interlaced PCR:automatable amplification and sequencing of insert end fragment from P1 and YAC clones for chromosome walking [J].Genomics,1995,25:674.
Cloning and Sequence Analysis of Phytoene Synthase 1 ( Psy1) Gene Fragment inAegilopsSpecies of S Genome
WANG Jianwu1,3,HE Xinyao2,4,WANG Hui3,XIA Xianchun2,HE Zhonghu2,5
(1.College of Agronomy,Yangtze University,Jingzhou,Hubei 434025,China; 2.Institute of Crop Science/National Wheat Improvement Center,Chinese Academy of Agricultural Sciences,Beijing 100081,China; 3.College of Agronomy, Northwest A&F University,Yangling,Shaanxi 712100,China; 4.International Maize and Wheat Improvement Center, Texcoco CP 56237,Mexico; 5.CIMMYT-China Office,Beijing 100081,China)
Carotenoids content(YPC) is the main factor influencing wheat flour color. The phytoene synthase 1( Psy1) gene encodes a key enzyme to determine the carotenoids content of endosperm in wheat.Aegilopsspecies are important resources for wheat genetic improvement. In the present study,threeAegilopsspecies includingAe.longissima(SS),Ae.bicornis(SS) andAe.searsii(SS) were used to clone Psy1 genes in order to disclose their genetic diversity. Using homologous gene cloning approach,the partial Psy1 gene sequences of eight novel allelic variants at Psy1-S1 locus were obtained by the marker YP7B-5,covering the whole region of the second exon and the second intron and the 93.1% region of the third exon. High sequence similarity of 93.4% to 98.5% was shown between these eight Psy1-S1 alleles and other five Psy1-B1/ Psy1-S1 alleles,including Psy1-B1d from common wheat, Psy1-B1k fromT.dicoccumand Psy1-S1a, Psy1-S1b, Psy1-S1c fromAe.speltoides. Moreover,they showed higher similarity in the coding sequences with only a few synonymous SNPs. There were several SNPs and InDels in the second intron,which make a valuable contribution to the genetic diversity of the Psy1 gene,particularly a 163 bp insertion from Psy1-S1h and a 177 bp deletion from Psy1-S1i,which were mainly attributed to the length difference,compared with other Psy1-B1/ Psy1-S1 alleles.
Yellow pigment of wheat grain;Aegilops; Phytoene synthase 1 gene( Psy1); Cloning of gene fragment
时间:2017-04-07
2016-12-12
2017-03-15 基金项目:长江大学博士科研启动基金项目(118/801180010115) 第一作者E-mail:wjw19802013@163.com 通讯作者:何中虎(E-mail:zhhecaas@163.com);夏先春(E-mail:xiaxianchun@caas.cn)
S512.9;S336
A
1009-1041(2017)04-0429-09
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170407.1020.002.html
