西农538 LMW-GS基因的克隆、原核表达及功能鉴定
2017-05-15杨明明赵万春
李 万,杨明明,2,高 翔,2,董 剑,2,赵万春,2
(1.西北农林科技大学农学院,陕西杨凌 712100;2.陕西省小麦工程技术研究中心/陕西省小麦新品种培育工程研究中心,陕西杨凌 712100)
西农538 LMW-GS基因的克隆、原核表达及功能鉴定
李 万1,杨明明1,2,高 翔1,2,董 剑1,2,赵万春1,2
(1.西北农林科技大学农学院,陕西杨凌 712100;2.陕西省小麦工程技术研究中心/陕西省小麦新品种培育工程研究中心,陕西杨凌 712100)
为了探索普通小麦品种西农538的LMW-GS对面粉加工品质的影响,根据NCBI中已公布的LMW-GS基因序列,设计了一对特异性引物,从西农538基因组DNA中克隆出LMW-GS基因后,对其进行原核表达及掺粉试验。序列分析表明,克隆得到的LMW-GS基因序列 (GenBank登录号为KX452081)有单一完整的开放阅读框,编码区长915 bp,无内含子。同源性比对及进化树分析发现,该基因属于 Glu-D3、Type V (Group 10)、m型、C组LMW-GS基因。SDS-PAGE和Western blot分析表明,该基因原核表达成功。微量掺粉试验表明,诱导表达的蛋白对小麦面粉加工品质有负效应。
小麦;LMW-GS基因;原核表达;微量掺粉试验
低分子量谷蛋白是庞大的基因家族,其大多数基因被定位在第一同源组群1A、1B和1D染色体的短臂末端,编码位点分别命名为 Glu-A3、 Glu-B3和 Glu-D3[1-2]。此外,在 Glu-D4和 Glu-D5位点也有报道[3]。
研究表明,低分子量谷蛋白亚基(low molecular weight glutenin,LMW-GS)基因家族成员在编码区结构上非常相似,由信号肽、保守N-端区、含有多个重复短肽的重复区以及保守C-端区构成[4],不具有内含子,其氨基酸序列中通常含有8个半胱氨酸残基,但某些LMW-GS含有9个半胱氨酸[5],这些半胱氨酸位置保守,对面粉加工品质具有重要贡献[6]。由于LMW-GS与醇溶蛋白在基因编码位点上紧密连锁,分离较为困难,直到20世纪80年代末期人们才逐渐认识到LMW-GS的重要性。研究表明,有些LMW-GS对面粉品质的影响远大于HMW-GS,或与HMW-GS对品质的贡献极为相似[7-8]。为了验证这种说法,Wieser等[9]通过微量流变学和烘烤测试发现,两倍LMW-GS含量可以获得和HMW-GS同样的面粉延展性。Benedettelli等[10]还研究了低分子量谷蛋白的无效等位基因,发现其对某些品质参数有决定性作用。
小麦品种西农538具有耐旱性好、分蘖力强、成穗率高、抗干热风、成熟黄亮等特点,是西北农林科技大学小麦品质育种课题组选育的新品种。邱玉亮等[11]发现其HMW-GS组成为1、14+15和2+12。王玉杰等[12]对其LMW-GS进行SDS-PAGE及分子标记检测发现,其具有 Glu-A3a、 Glu-B3d和 Glu-D3c。另外,张龙龙等[13]研究表明,西农538属于强抗旱型品种。陈冬阳等[14]从中克隆了几丁质酶基因,并利用实时荧光定量法研究其在小麦根、茎、叶等不同部位的表达差异,以及受条锈菌诱导后的表达量变化,认为其对真菌性病害具有抗性。本研究根据前人研究成果设计特异性引物,从西农538基因组DNA中克隆出LMW-GS基因后,对其进行体外表达及掺粉试验,以期拓宽小麦优质基因资源,为小麦品质改良提供参考。
1 材料与方法
1.1 材料和试剂
普通小麦品种西农538由国家小麦改良中心杨凌分中心品质实验室保存并提供。DNA凝胶回收纯化试剂盒、增强型HRP-DAB底物显色试剂盒、质粒提取试剂盒和 DNA分子量标准DL2000购于天根生化科技(北京)有限公司;EsTaqMasterMix购于北京康为世纪生物科技有限公司;克隆载体pEASY-T1、原核表达载体pEASY-Blunt E1、克隆菌株EscherichiacoliTrans1-T1、原核表达菌株EscherichiacoliTrans B(DE3)、ProteinIso Ni-NTA Resin、蛋白质分子量标准Blue Plus II、抗His标签鼠单克隆抗体和HRP标记的羊抗鼠IgG购于北京全式金生物技术有限公司;PCR扩增引物由上海生工生物工程股份有限公司合成。
1.2 方 法
1.2.1 基因组DNA的提取
以室内培养1周左右的西农538幼嫩叶片为材料,采用微量CTAB法[15]提取基因组DNA。
1.2.2 目的基因的克隆及其序列分析
根据NCBI中已公布的LMW-GS基因序列(EU189094)设计特异性引物lmwF/lmwR (lmwF:5′-GCCTTTCTTGTTTACGGCTG-3′; lmwR:5′-TCAGATTGACATCCACACAAT-3′)。以西农538的基因组DNA为模板进行扩增反应。PCR扩增反应体系为50 μL,包括25 μL EsTaqMasterMix、lmwF和lmwR各2 μL、DNA模板3 μL、灭菌ddH2O 18 μL。PCR扩增程序:95 ℃预变性4 min;95 ℃变性45 s,60 ℃退火45 s,72 ℃延伸2 min,35个循环;72 ℃延伸10 min,4 ℃保存。
PCR产物用2%的琼脂糖凝胶电泳进行检测,使用DNA凝胶回收纯化试剂盒回收目的片段。将胶回收的目的片段连接入pEASY-T1克隆载体,转化Trans1-T1感受态,涂于含有适量氨苄青霉素、X-Gal和IPTG的LB平板,37 ℃过夜培养,第二天进行蓝白斑筛选。使用通用引物M13F/M13R对白色单克隆菌落进行PCR扩增,筛选阳性克隆,并送武汉昆泰锐生物技术有限责任公司进行测序。利用DNAMAN、Lasergene及 SignalP 4.1 Server 和NCBI网站上的在线工具对测序结果进行分析。
1.2.3 目的基因的诱导表达
根据测序得到的LMW-GS基因序列,设计一对不扩增信号肽序列的表达引物lmwexF/lmwexR(lmwexF:5′-CAGATGGAGACTAGATG CATCCC-3′;lmwexR:5′-TCAGTAGGCACCA ACTCCGG-3′)。以阳性克隆菌液为模板,用lmwexF/lmwexR进行PCR扩增并回收目的片段。扩增体系及扩增程序同基因克隆。将目的片段与pEASY-Blunt E1表达载体连接,转化于E.coliTrans1-T1感受态,37 ℃过夜培养。用引物T7T/lmwexF或lmwexR/T7P进行阳性单克隆筛选,并测序鉴定。将插入顺序正确的阳性克隆提取质粒,转化于Trans B(DE3)表达感受态,培养后挑选阳性单克隆菌落,接种于LB液体培养基(含100 mg·mL-1Amp),于37 ℃、200 r·min-1过夜培养。将培养物按1∶100的比例接种于5 mL含LB液体培养基(含100 mg·mL-1Amp)中震荡培养至菌液OD600=0.6左右,取1 mL菌液作为阴性对照,向剩下的菌液中加入终浓度为1 mmol·L-1IPTG,20 ℃诱导表达6 h。用12%的SDS-PAGE分析鉴定蛋白表达结果。
1.2.4 诱导表达产物的Western blot分析
诱导表达产物经SDS-PAGE电泳后进行转膜。在60 V电压下湿转75 min,然后取出NC膜于干净的玻璃容器中,TBS洗膜3次,每次15 min;用新配置的封闭液(含5%脱脂奶粉)室温摇床封闭2 h,弃封闭液,TBS和TBST洗膜各2次,每次15 min;以鼠抗His(1∶10 000封闭液稀释)抗体为一抗,室温摇床孵育1 h,弃一抗,TBS和TBST洗膜各2次,每次15 min;以HRP标记的羊抗鼠IgG(1∶5 000封闭液稀释)为二抗,室温摇床孵育1 h,弃二抗,TBS和TBST洗膜各2次,每次15 min;最后用增强型 HRP-DAB底物显色试剂盒避光进行显色反应。
1.2.5 目的蛋白的纯化和品质效应鉴定
目的蛋白的纯化参照杨 帆等[16]的方法。用4 g全自动微型粉质仪(Micro-dough LAB,Perten公司,瑞典)测定粉质参数。参照国家标准GB/T14614-93和HMW-GS功能的体外鉴定方法进行。向4 g基础面粉中加入10 mg纯化的目的蛋白,混匀后加入适量的H2O和250 μL 50 μg·mL-1的还原剂DTT溶液,4 min后再加入250 μL 200 μg·mL-1的KIO3氧化剂溶液,揉面20 min,记录粉质曲线。粉质参数分析方法参考Xu等[17]和Chen等[18]。
2 结果与分析
2.1 目的基因克隆结果
以西农538基因组DNA为模板,利用引物lmwF/lmwR进行PCR扩增。扩增产物经2%琼脂糖凝胶电泳检测后,得到约1 500 bp的单一条带(图1)。将目的条带回收、克隆和测序后,得到长度为1 508 bp的序列。使用ORF Finder在线工具对得到的序列进行分析,发现该序列有单一完整的开放阅读框,编码区内无内含子,长915 bp,可编码304个氨基酸。通过BLAST和DNAMAN比对分析发现,该序列和 Glu-D3编码的LMW-GS的氨基酸序列有极高的相似性,其中,与DQ357056的相似性达到99.02%,初步断定本研究得到的序列为 Glu-D3位点编码的LMW-GS基因。将序列提交至GenBank,得到登录号KX452081。

M:核酸分子量标准DL2000;1:PCR扩增产物。
M:Nucleotide marker DL2000;1:Amplified product.
图1 2%琼脂糖凝胶电泳检测PCR产物
Fig.1 Amplified product separated on 2% agarose gel
2.2 序列分析
分析KX452081推导的氨基酸序列可知(图2),其编码的成熟蛋白分子量约32.54 kDa,主要由6部分构成,即由20个氨基酸残基组成的信号肽(signal peptide)、由13个氨基酸残基组成的含有1个半胱氨酸残基的N-端保守区(N-terminus)、由99个氨基酸残基组成的富含谷氨酰胺(Q)和脯氨酸(P)的重复区(repeated domain)、含有5个半胱氨酸残基的C-端保守区Ⅰ(C-terminal region Ⅰ)、含有1个半胱氨酸残基的富含谷氨酰胺(Q)的C-端保守区Ⅱ(C-terminal region Ⅱ)、含有1个半胱氨酸残基的C-端保守区Ⅲ(C-terminal region Ⅲ)。结合N/C端氨基酸组成(METRCIPG ……VGTGVGAY)及系统进化树分析结果(图3),推测KX452081属于Type V (Group 10)、m型、C组LMW-GS。
2.3 目的基因表达产物的SDS-PAGE分析
将含有重组质粒的Trans B(DE3)表达感受态细胞在20 ℃经1 mmol·L-1IPTG诱导表达6 h后,用12%的SDS-PAGE检测诱导表达情况。结果(图4)发现,诱导表达蛋白与预期相符。进一步用Western blot分析表明,目的基因片段获得正确表达(图5)。
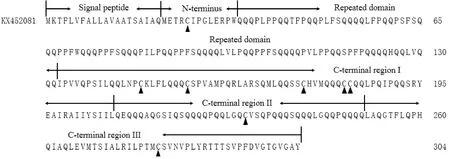
序列中半胱氨酸残基用黑色三角形表示。Black triangles indicated cysteine residues.
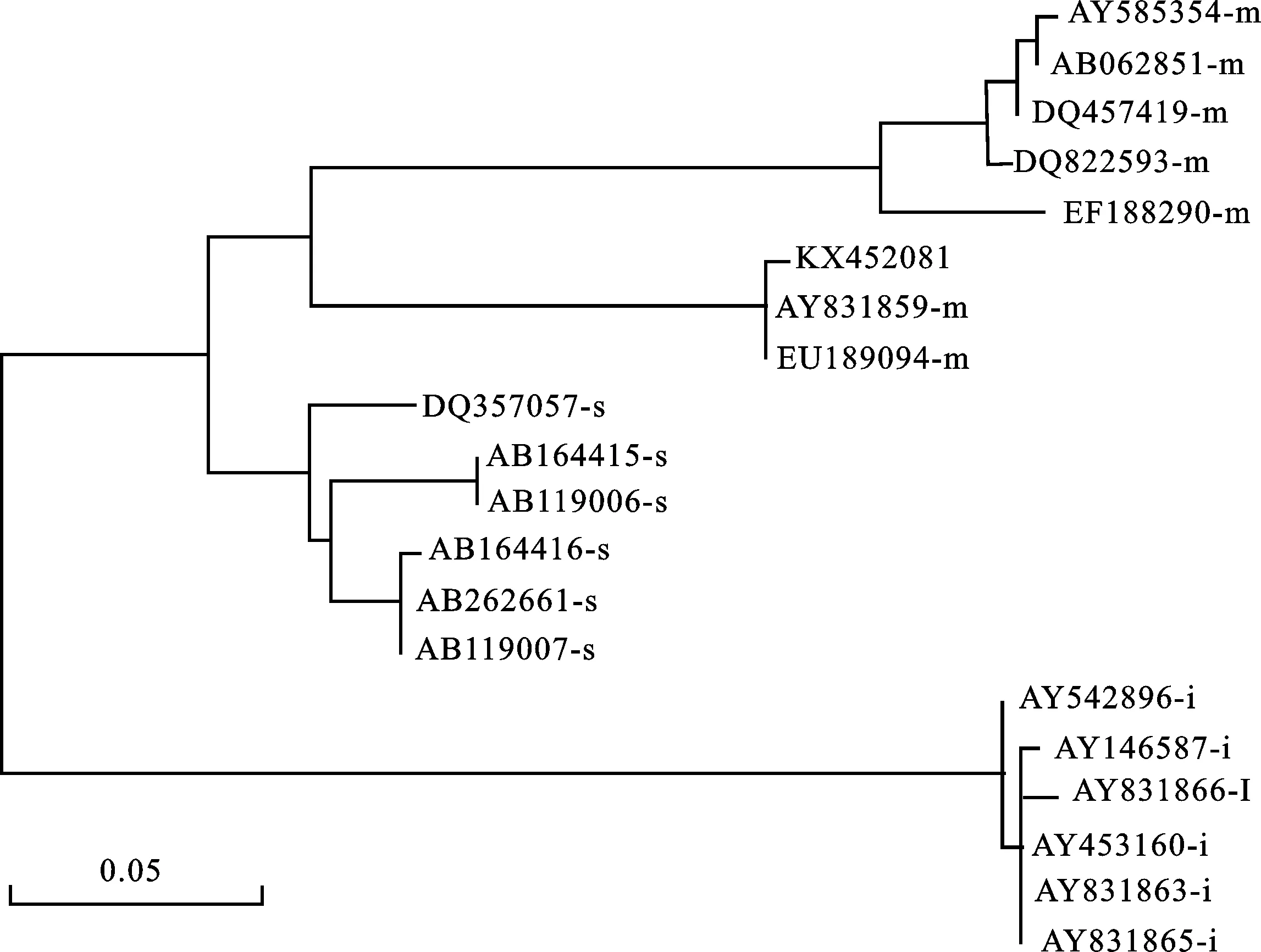
图3 KX452081推导的氨基酸序列的进化树分析
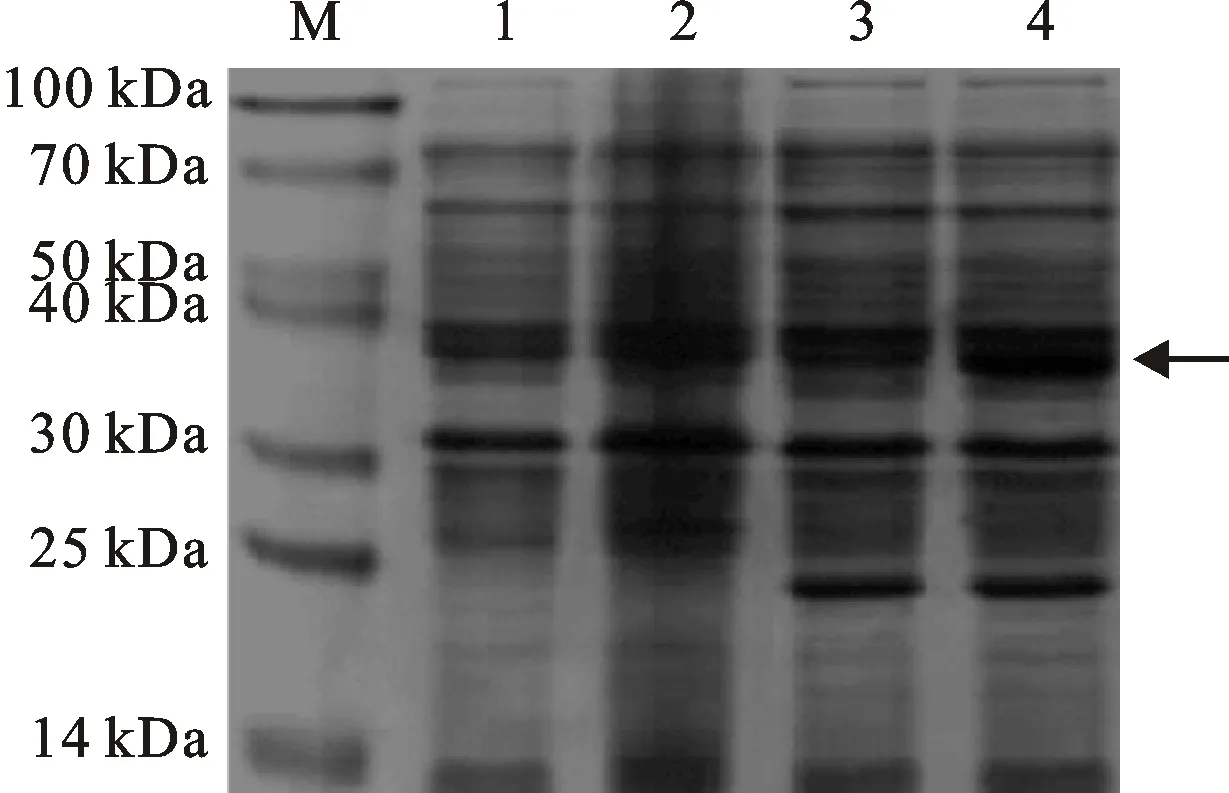
M:蛋白质分子量标准 Blue Plus II;1:未诱导的空载体;2:IPTG 诱导的空载体;3:未诱导的LMW-GS重组质粒;4:IPTG诱导的LMW-GS重组质粒;箭头指示目的蛋白。
M:Protein marker Blue Plus II; 1:Protein of non-recombinant plasmid without induction; 2:Protein of non-recombinant plasmid after adding IPTG; 3:Protein of recombinant plasmid of LMW-GS without induction; 4:Protein of recombinant plasmid of LMW-GS after adding IPTG; The arrow shows target protein.
图4 重组蛋白的SDS-PAGE分析
Fig.4 SDS-PAGE analysis of recombinant proteins
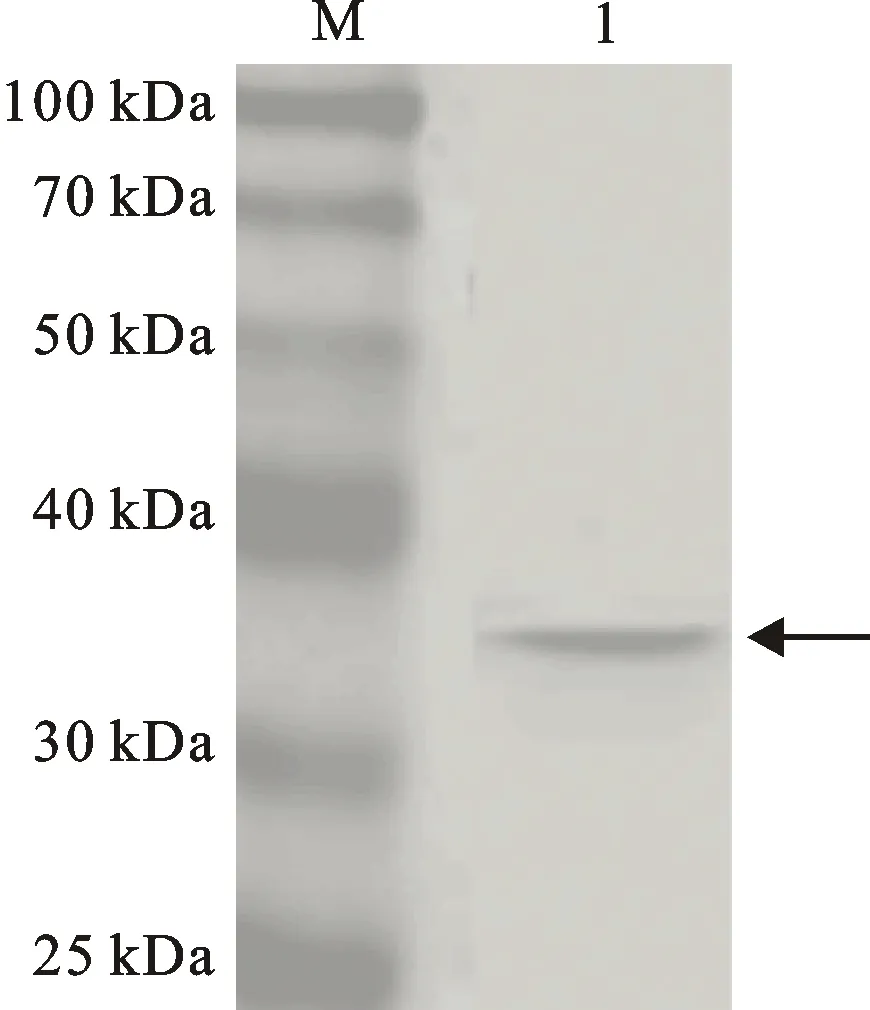
M:蛋白质分子量标准 Blue Plus II;1:重组蛋白。
M:Protein marker Blue Plus II; 1:Recombinant protein.
图5 重组蛋白的Western blot分析
Fig.5 Recombinant protein detected by Western blot
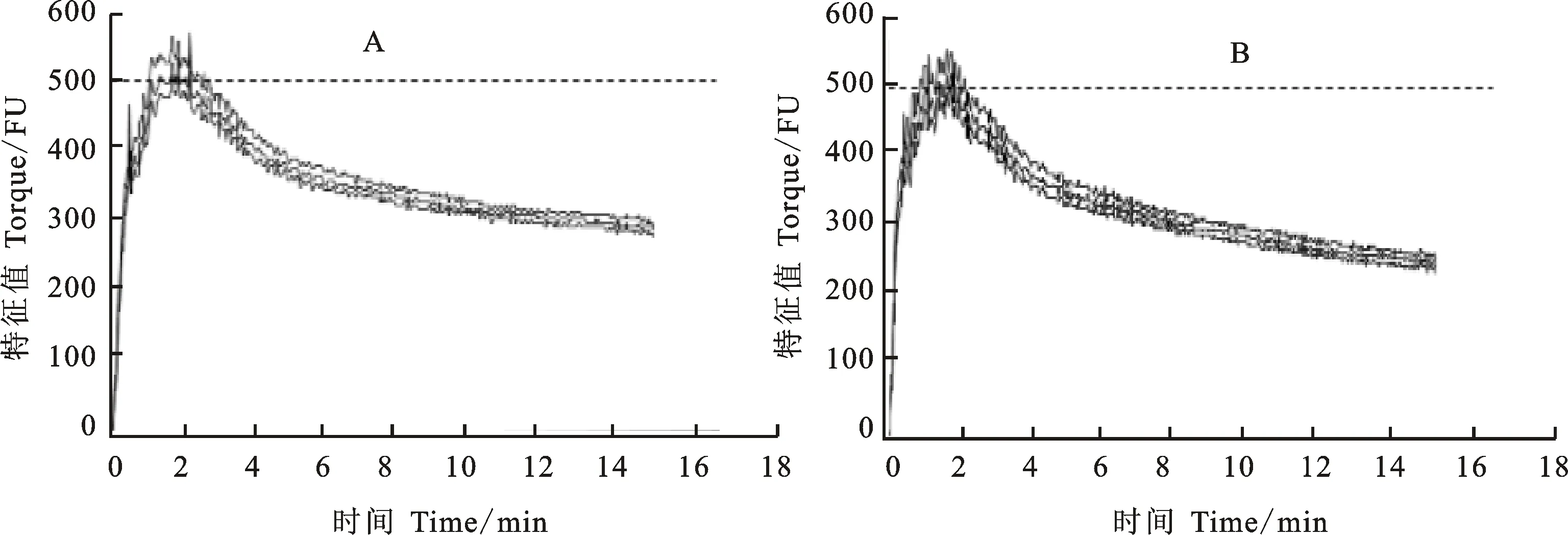
A:中国春面粉中添加DTT和KIO3;B:中国春面粉中添加DTT、KIO3和LMW-GS。
A:Basic flour added with DTT and KIO3; B:Basic flour added with DTT,KIO3and LMW-GS.
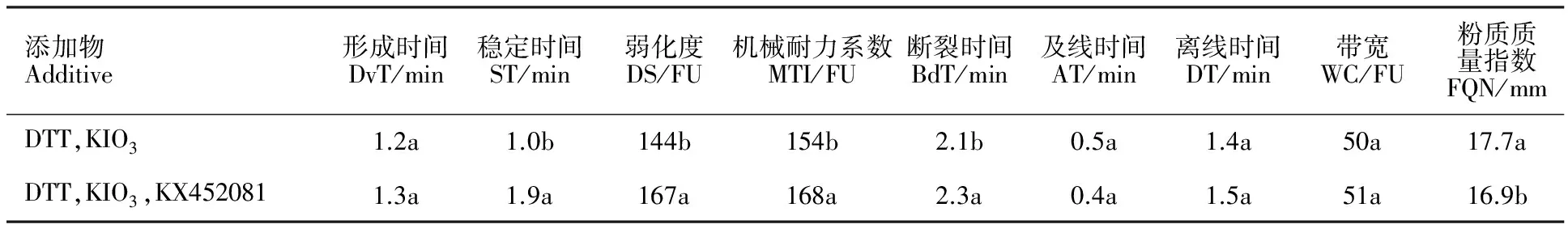
图6 纯化的LMW-GS(KX452081)对粉质曲线的影响
表中数据为3次重复的平均值;同列数据后不同字母表示差异在0.05水平上显著。
Values are averaged from three replicates; Values marked with different letters show significant difference at 5% probability level. DvT:Development time; DT:Departure time; WC:Width of curve; AT:Arrival time; DS:Degree of softening; MTI:Mixing tolerance index; BdT:Breakdown time; ST:Stability time; FQN:Farinograph quality number.
2.4 目的蛋白的品质效应
采用4 g微量粉质仪通过氧化还原反应将10 mg纯化后的表达产物添加到基础面粉中,得到如图6所示的粉质曲线及表2所列的粉质参数。分析表明,加入LMW-GS后,与对照相比,面团形成时间、离线时间、带宽、及线时间没有显著变化,而弱化度、机械耐力系数、断裂时间、稳定时间均显著上升,粉质质量参数显著下降。
3 讨 论
二硫键对蛋白质三维结构的稳定起着十分重要的作用,它是由两个半胱氨酸残基(Cys)的侧链巯基氧化形成的一种肽链内或肽链间的共价交联[19]。LMW-GS一般含有8个Cys,而赵惠贤等[20]在小偃6号中克隆的 Glu-D3位点LMW-GS基因 (登录号为AY263369) 有9个Cys残基。这些Cys在氨基酸序列中的位置一般都很保守,它可以形成二硫键,这是LMW-GS二级结构的一个重要特征,通过这些二硫键可以将LMW-GS和HMW-GS连接起来形成谷蛋白大聚合体,从而共同对小麦品质起作用。
LMW-GS主要有四种分类系统:a.根据其在SDS-PAGE和IEF/SDS-PAGE双向电泳中迁移率的不同分为B、C和D区,其中B区为分子量42~51 kDa的碱性蛋白;C区LMW-GS与部分醇溶蛋白重叠,分子量31.0~36.5 kDa;D区为与ω醇溶蛋白位置相近的酸性蛋白[8,21]。b.根据N-末端或起始氨基酸序列将LMW-GS分为 LMW-m(METSH(R/C)I-)、LMW-s(SHIPGL-) 和 LMW-i(ISQQQQ-)三种[22-24]。c.依据染色体定位将LMW-GS分为 Glu-A3 、 Glu-B3 、 Glu-D3[25]。d.根据Cys的分布、N/C端氨基酸序列将LMW-GS划分为Type (I~VI)六类,12组亚基[26-27]。本试验中得到的LMW-GS基因序列含有8个半胱氨酸残基,成熟蛋白分子量约32.54 kDa,序列比对及系统进化树分析可知,该序列位于 Glu-D3,具有Type V (Group 10)、m型、C组LMW-GS的结构特征。
从本研究结果可知,加入LMW-GS(KX452081)后,反映品质的指标变化并不完全一致。其中,面团稳定时间和断裂时间显著上升,面团形成时间、带宽和离线时间并没有显著变化,说明LMW-GS对面粉筋力有增强作用;而弱化度和机械耐力系数显著上升,及线时间没有显著变化,又说明LMW-GS对筋力有负效应。粉质质量指数则是用于快速方便的综合评价面粉筋度和耐揉性的一个重要指标。本试验结果得出,加入纯化的LMW-GS后,粉质质量指数显著下降。说明本研究纯化得到的LMW-GS对面粉加工品质有负效应,这与孙 辉等[28]的研究结果相一致,也与李艳亮[29]克隆得到的m型、C组、 Glu-D3位点的LMW-GS(GQ892589)的品质效应一致。但是,李艳亮[29]在同一个试验中,也克隆得到了m型、C组、 Glu-D3位点的LMW-GS基因序列GQ892582,其对面粉品质有正效应;而Sissons等[30]也认为m型LMW-GS对小麦面粉的总体特性有改善作用,上述两个研究成果均与本试验结果相反,分析引起结果不同的原因,首先Sissons等[30]在分离和纯化m型LMW-GS时,采用在一个窄pH范围内等电聚焦的方法(约90%纯化度),而本试验则是通过在大肠杆菌系统中体外表达,然后利用表达载体携带的His标签通过柱层析进行蛋白纯化;其次比较GQ892582和KX452081,二者氨基酸序列相似性仅有68.95%,同源性较差,另外使用的小麦品种和基础面粉也不同,综上,分离和纯化目的蛋白的方式以及氨基酸序列位点的变异、缺失等都可能是导致结果差异的原因,但具体原因仍需更为深入地研究来证实。
微量掺粉试验易受外界环境的影响,对试验所需的外源蛋白的纯度要求较高,同时LMW-GS基因家族复杂,不仅数量远多于HMW-GS,变异广,并且这些变异都可能会导致其面粉品质效应的改变,加之LMW-GS在SDS-PAGE中与醇溶蛋白重叠[31],给深入研究LMW-GS带来了难度,从而使得大多数低分子量谷蛋白亚基对小麦品质的作用并没有得到清楚认识,因此有必要对不同位点编码、不同组的LMW-GS以及它们的各种变异形式的品质效应做进一步的研究。本研究分离鉴定出了一种对面粉品质具有负向效应的LMW-GS,为利用基因工程对普通小麦加工品质改良提供了一定的理论依据。
[1]SINGH N K,SHEPHERD K W.Linkage mapping of genes controlling endosperm storage proteins in wheat:1.Genes on the short arms of group 1 chromosomes [J].TheoreticalandAppliedGenetics,1988,75:628.
[2]GUPTA R B,SHEPHERD K W.Two-step one-dimensional SDS-PAGE analysis of LMW subunits of glutenin:1.Variation and genetic control of the subunits in hexaploid wheats [J].TheoreticalandAppliedGenetics,1990,80:65.
[3]SREERAMULU G,SINGH N K.Genetic and biochemical characterization of novel low molecular weight glutenin subunits in wheat (TriticumaestivumL.) [J].Genome,1997,40:41.
[4]CASSIDY B G,DVORAK J,ANDERSON O D.The wheat low-molecular-weight glutenin genes:Characterization of six new gene and process in understanding gene family structure [J].TheoreticalandAppliedGenetics,1998,96:743.
[5] 魏燕燕,赵惠贤,李勇超,等.小麦 Glu-B3位点LMW-GS基因的克隆及序列分析[J].西北植物学报,2006,26(9):1864.
WEI Y Y,ZHAO H X,LI Y C,etal.Cloning and sequencing of LMW-GS gene at Glu-B3 in wheat [J].ActaBotanicaBoreali-OccidentaliaSinica,2006,26(9):1864.
[6]D′OVIDIO R.The low-molecular-weight glutenin subunits of wheat gluten [J].JournalofCerealScience,2004,39:321.
[7]GUPTA R B,SINGH N K,SHEPHERD K W.The cumulative effect of allelic variation in LMW and HMW glutenin subunits on dough properties in the progeny of two bread wheats [J].TheoreticalandAppliedGenetics,1989,77:57.
[8]GUPTA R B,PAUL J G,CORNISH G B,etal.Allelic variation at glutenin subunit and gliadin loci, Glu-1, Glu-3 and (Gli-1,)of common wheat:I.Its additive and interaction effects on dough properties [J].JournalofCerealScience,1994,19:9.[9]WIESER H,KIEFFER R.Correlation of the amount of gluten protein types to the technological properties of wheat flours determined on a micro-scale [J].JournalofCerealScience,2001,34:19.
[10]BENEDETTELLI S,MARGIOTTA B,PORCEDDU E,etal.Effects of the lack of proteins controlled by genes at the Gli-D1/ Glu-D3 loci on the breadmaking quality of wheat [J].JournalofCerealScience,1992,16:69.
[11] 邱玉亮,杨明明,董 剑,等.高效毛细管电泳(HPCE)对优质小麦HMW-GS的分离鉴定[J].麦类作物学报,2015,35(5):638.
QIU Y L,YANG M M,DONG J,etal.Separation and identification of HMW-GS in high quality wheat by HPCE [J].JournalofTriticeaeCrops,2015,35(5):638.
[12] 王玉杰,杨明明,董 剑,等.利用HPCE构建小麦LMW-GS标准图谱初探[J].麦类作物学报,2015,35(9):1229.
WANG Y J,YANG M M,DONG J,etal.Preliminary construction of standard LMW-GS profile in common wheat using HPCE [J].JournalofTriticeaeCrops,2015,35(9):1229.
[13] 张龙龙,杨明明,董 剑,等.三个小麦新品种不同生育阶段抗旱性的综合评价[J].麦类作物学报,2016,36(4):426.
ZHANG L L,YANG M M,DONG J,etal.Comprehensive analysis of drought resistance of three new wheat cultivars at different growth stages [J].JournalofTriticeaeCrops,2016,36(4):426.
[14] 陈冬阳,杨明明,高 翔,等.普通小麦几丁质酶基因的克隆与表达分析[J].麦类作物学报,2016,36(5):539.
CHEN D Y,YANG M M,GAO X,etal.Cloning and expression analysis of chitinase genes in common wheat (TriticumaestivumL.) [J].JournalofTriticeaeCrops,2016,36(5):539.
[15]MURRAY M G,THOMPSON W F.Rapid isolation of high molecular weight plant DNA [J].NucleicAcidsResearch,1980,8:4321.
[16] 杨 帆,陈其皎,高 翔,等.一年生簇毛麦α-醇溶蛋白基因的分离、原核表达与功能鉴定[J].作物学报,2014,40(8):1340.
YANG F,CHEN Q J,GAO X,etal.Cloning,prokaryotic expression andinvitrofunctional analysis of α-gliadin genes fromDasypyrumvillosum[J].JournalofAgronomicaSinica,2014,40(8):1340.
[17]XU H,WANG R J,SHEN X,etal.Functional properties of a new low-molecular-weight glutenin subunit gene from a bread wheat cultivar [J].TheoreticalandAppliedGenetics,2006,113:1295.
[18]CHEN F G,ZHAO F,LIU R K,etal.Functional properties of two low-molecular-weight glutenin subunits carrying additional cysteine residues from hybrid introgression line II-12 derived fromTriticumaestivumandAgropyronelongatum[J].FoodChemistry,2011,127:1773.
[19]HATAHET F,RUDDOCK L W.Protein disulfide isomerase:a critical evaluation of its function in disulfide bond formation [J].Antioxidants&RedoxSignaling,2009,11(11):2807.
[20] 赵惠贤,郭蔼光,胡胜武,等.小麦 Glu-D3和 Glu-B3位点LMW-GS基因特异引物设计与PCR扩增[J].作物学报,2004,30(2):126.
ZHAO H X,GUO A G,HU S W,etal.Development of primers specific for LMW-GS genes at Glu-D3 and Glu-B3 loci and PCR amplification [J].JournalofAgronomicaSinica,2004,30(2):126.
[21]JACKSON E A,HOLT L M,PAYNE P L.Characterization of high molecular weight gliadin and low-molecular-weight glutenin subunits of wheat endosperm by two-dimensional electrophoresis and the chromosomal localization of their controlling genes [J].TheoreticalandAppliedGenetics,1983,66:29.
[22]CLOUTIER S,RAMPITSCH C,PENNER G A,etal.Cloning and expression of a LMW-i glutenin gene [J].JournalofCerealScience,2001,33:143.
[23]LEW E J L,KUZMICKY D D,KASARDA D D.Characterization of low molecular weight glutenin subunits by reversed-phase high-performance liquid chromatography,sodium-dodecyl sulfate-polyacrylamide gel electrophoresis,and N-terminal amino acid sequencing [J].CerealChemistry,1992,69:508.
[24]SISSONS M J,BEKES F,SKERRITT J H.Isolation and functionality testing of low molecular weight glutenin subunits [J].CerealChemistry,1998,75:30.
[25]MASCI S,D′OVIDIO R,LAFIANDRA D,etal.Characterization of a low-molecular-weight glutenin subunit gene from bread wheat and the corresponding protein that represents a major subunit of the glutenin polymer [J].PlantPhysiology,1998,118:1147.
[26]IKEDA T M,NAGAMINE T,FUKUOKA H,etal.Characterization of new low-molecular-weight glutenin subunit genes in wheat [J].TheoreticalandAppliedGenetics,2002,104:680.
[27]TABIKI T,IKEGUCHI S,IKEDA T M.Effects of high-molecular-weight and low-molecular-weight glutenin subunit alleles on common wheat flour quality [J].BreedingScience,2006,56:131.
[28] 孙 辉,李保云,王岳光,等.普通小麦谷蛋白亚基与烘烤品质的关系[J].中国农业大学学报,2000,5(3):18.
SUN H,LIU B Y,WANG Y G,etal.Correlation between glutenin subunits and bread-making quality characteristics of common wheat [J].JournalofChinaAgriculturalUniversity,2000,5(3):18.
[29] 李艳亮.小麦品种“陕253”低分子量谷蛋白基因克隆、原核表达及功能鉴定[D].杨凌:西北农林科技大学,2010:30.
LI Y L.Expression,purification andinvitrofunctional identification of the low-molecular-weight glutenin with different repetitive domain [D].Yangling:Northwest A&F University,2010:30.
[30]SISSONS M J,BEKES F,SKERRITT J H.Isolation and functionality testing of low molecular weight glutenin subunits [J].CerealChemistry,1998,75(1):30.
[31]GIANIBELLI M C,LARROQUE O R,MACRITCHIE F,etal.Biochemical,genetic,and molecular characterization of wheat glutenin and its component subunits [J].CerealChemistry,2001,78:635.
Isolation,Prokaryotic Expression and Functional Analysis of LMW-GS from Xinong 538 (TriticumaestivumL.)
LI Wan1,YANG Mingming1,2,GAO Xiang1,2,DONG Jian1,2,ZHAO Wanchun1,2
(1.College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China; 2.Wheat Engineering Research Center of Shaanxi Province/Study Centre of Wheat Breeding of Shaanxi Province,Yangling,Shaanxi 712100,China)
Low-molecular-weight glutenin subunits (LMW-GS) play an important role in determining the processing quality of wheat (TriticumaestivumL.) flour. In this study,we isolated a LMW-GS gene (915 bp,GenBank accession number:KX452081) from wheat cultivar Xinong 538,using a pair of specific primers. The comprehensive analysis of deduced amino acid sequence,and phylogenetic and evolutionary analyses of full sequence,N- and C-terminal domains revealed that KX452081 was closely related to Glu-D3 loci,C-group,Type V (Group 10) and m-type LMW-GS. The target DNA fragments were subcloned into the pEASY-Blunt E1 expression vector and expressed inEscherichiacoliTrans B(DE3) cell under IPTG induction. The gene was successfully expressed inE.colisystem according to SDS-PAGE analysis and western-blotting assay. The fusion protein was purified and recovered by His-Trap affinity chromatography,and then integrated into the control flour by using a 4 g Micro-dough LAB Farinograph. Results showed that the LMW-GS originated from Xinong 538 had a negative effect on dough quality properties.
Wheat; LMW-GS gene; Prokaryotic expression; Farinograph
时间:2017-04-07
2017-01-25
2017-02-20 基金项目:国家现代农业产业技术体系研究项目(CARS-3-2-47);“十二五”农村领域国家科技计划课题(2011AA100501) 第一作者E-mail:599092122@qq.com 通讯作者:高 翔(E-mail:gx@nwsuaf.edu.cn)
S512.1;S331
A
1009-1041(2017)04-0445-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170407.1020.006.html
