转 GmDREB1基因小麦新品系G19-349的抗旱特性
2017-05-15齐学礼张建周赵明忠韩刘鹏许为钢
齐学礼,张建周,李 艳,赵明忠,韩刘鹏,胡 琳,许为钢
(河南省农业科学院小麦研究所/小麦国家工程实验室/农业部黄淮中部小麦生物学与遗传育种重点实验室/河南省小麦生物学重点实验室,河南郑州 450002)
转 GmDREB1基因小麦新品系G19-349的抗旱特性
齐学礼,张建周,李 艳,赵明忠,韩刘鹏,胡 琳,许为钢
(河南省农业科学院小麦研究所/小麦国家工程实验室/农业部黄淮中部小麦生物学与遗传育种重点实验室/河南省小麦生物学重点实验室,河南郑州 450002)
为明确转 GmDREB1基因小麦G19-349的抗旱特性,以分子检测为阳性的转基因植株和受体对照济麦19为材料,利用小区试验测定和分析了浇二水和浇四水条件下小麦叶片叶绿素含量、气体交换、叶绿素荧光等光合参数,SOD、POD和CAT活性,以及MDA含量和籽粒产量,同时通过大区试验分析了在浇三水条件下小麦水分消耗特征参数和籽粒产量。对供试材料分子检测结果表明,目的基因已整合到小麦基因组中,并已正确转录。小区试验结果表明,在浇二水条件下,G19-349的旗叶叶绿素相对含量,气体交换参数Pn、Gs、Tr和Ci,叶绿素荧光参数Fv/Fm和ΦPSⅡ,以及三种抗氧化酶活性和产量均显著高于对照,而MDA含量显著低于对照;浇四水条件下,G19-349的各项指标与对照均无显著差异。大区试验结果表明,在浇三水条件下,G19-349较对照济麦19耗水量显著降低,而水分利用效率和产量均显著增加。说明转 GmDREB1基因小麦G19-349在缺水条件下具有较高的抗氧化和光合能力,这是其在有限灌水条件下较受体济麦19具有较好水分利用特性的生理基础。
小麦;干旱; GmDREB1基因
干旱缺水是农业面临的严峻问题之一。在世界范围内,水分亏缺所造成的小麦减产远超其他非生物逆境所导致的产量损失[1-3],干旱缺水已是许多地区小麦生产的主要限制因素,抗旱节水已成为小麦遗传育种研究的重要目标。转基因育种能打破基因在不同物种间交流的障碍,克服传统育种方法难以解决的问题[4],近年来已发展成为小麦遗传育种的重要研究方向[5]。因此,发掘利用抗旱节水基因,开展抗旱转基因小麦新品种培育研究,将有助于增强小麦的持续稳产和高产能力,对保障我国粮食安全具有重要意义。干旱应答元件结合蛋白质(dehydration responsive element binding protein,DREB)是一类重要的信号转导转录因子,它通过特异性的结合启动子中的顺式作用元件来调控多个与植物抗逆相关的基因表达,从而提高转基因植物对逆境胁迫适应性[6-8]。中国农业科学院马有志研究员课题组成功将来源于大豆的脱水应答转录因子 GmDREB1基因导入到小麦品种济麦19中,获得了抗旱特性较对照明显提高的转基因小麦新品系G19-349。本课题组将该转基因小麦新品系引进到了河南省,研究了其在不同水分处理下的生理特性、水分利用效率和产量,以期为该抗旱转基因小麦品系的应用和新品种培育提供理论指导。
1 材料与方法
1.1 试验材料与 GmDREB1基因的分子检测
虽然基因已经转入到了小麦之中,但为了说明本次试验所用的转基因小麦确实为阳性转基因植株,且阳性率已经较高,我们对试验材料进行分子检测,以说明试验材料的可靠性。
1.1.1 供试材料
供试材料为T4代转 GmDREB1基因小麦新品系G19-349及其受体对照品种济麦19,均由中国农业科学院作物科学研究所提供,上述材料种植于国家黄淮海转基因小麦中试与产业化基地本部(位于河南省新乡市平原新区河南现代农业研究开发基地)。该基地是农业部批准建设的从事转基因小麦相关研究的专业机构,设置有隔离栅栏和门卫监控室,周围500 m内均无小麦种植,符合转基因小麦田间试验的安全隔离距离要求。
1.1.2 GmDREB1基因的PCR检测
参照Lin等[9]的方法提取DNA,对转基因品系进行单株PCR检测。 GmDREB1引物F:5′-CGGGTAGAAGAAGTCCAACATCG-3′,R:5′-AGTCGGGCTTGAGATTGAGAGAG-3′,引物序列由中国农业科学院作物科学研究所马有志研究员课题组提供,并由上海生工生物技术服务有限公司合成。该引物扩增目的片段为423 bp。PCR反应条件:94 ℃预变性10 min;94 ℃变性45 s,62 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。
PCR反应体系:10×Buffer 2 μL,10 mmol·L-1dNTP0.4 μL,20 μmol·L-1上下游引物各0.2 μL,DNA 1.0 μL,5 U·μL-1Taq酶0.1 μL,H2O 16.1 μL,总体积20 μL;扩增产物经1.0%琼脂糖凝胶电泳分离30 min(5 V·cm-1)、溴化乙锭染色后,在凝胶成像系统中观察,并计算转基因品系的PCR阳性率[10]。1.1.3 GmDREB1基因的实时荧光定量PCR检测
用植物总RNA提取试剂盒(CW Biotech,Beijing,China)提取试验材料的总RNA,用Prime ScriptTM RT reagent Kit with gDNA Eraser试剂盒(Takara,Japan)进行cDNA合成。TaPHR1引物和反应条件同1.1.2。Actin引物F:5′-GTTCCAATCTATGAGGGATACACGC-3′,R:5′-GAACCTCCACTGAGAACAACATT ACC-3′。Actin基因的PCR反应条件:94 ℃预变性2 min,94 ℃变性15 s,55 ℃复性15 s,72 ℃延伸15 s,35个循环;反应体系:SYBR Green Realtime PCR Master Mix 10 μL、H2O 7.8 μL、20 μmol·L-1上游引物各0.1 μL、cDNA 2 μL,总体积20 μL;用Toyobo公司SYBR Green RT-PCR试剂盒,反应体系在Bio-Rad CFX96型实时荧光定量PCR仪上进行扩增,基因相对表达量参照Livak等的2-ΔΔCt法进行计算[11],将野生型对照济麦19的 GmDREB1基因表达水平定为1。
1.2 小区试验
1.2.1 试验设计
试验于2014-2015年度在国家黄淮海转基因小麦中试与产业化基地进行。2014年10月播种前期降水多,底墒足,出苗好,小麦拔节后降雨量较少,土壤墒情差,抽穗到成熟期试验地点出现连续高温天气,田间出现干旱胁迫。2014-2015年度小麦生育期间苗期墒情较好,拔节后田间连续出现干旱胁迫。在河南新乡小麦高产田全生育期一般浇水3~4次。试验采用品种(系)和灌水二因素随机区组设计,其中灌水设浇二水(冬灌、孕穗期灌水)和浇四水(冬灌、返青期、孕穗期、灌浆期)两个水平,3次重复,小区面积6.67 m2,基本苗180万株·hm-2,每次灌水700 m3·hm-2,灌水方式为漫灌。不同灌水处理的小区之间设置5 m宽的隔离带(保护行),隔离带全生育期不浇水。底施尿素225 kg·hm-2和二铵300 kg·hm-2,返青期追施尿素150 kg·hm-2,浇二水处理用播肥料机将肥料直接施到土壤中,浇四水处理随浇水施肥,其余栽培管理措施同大田生产管理,于小麦开花后16 d测定各项生理指标,成熟期调查每个小区的有效穗数,全小区收获测定籽粒产量。
1.2.2 叶绿素相对含量测定
各小区选取10片长势一致的旗叶,使用SPAD-502型叶绿素计(MINOLTA CAMERA,Japan),测定每片旗叶中部的SPAD值,计算平均值。1.2.3 气体交换参数测定
气体交换参数测定参照Hu等[12]的方法。利用便携式光合测定仪(Ciras-3,PP-systems,USA)测定各小区供试材料的旗叶净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci) 和蒸腾速率(Tr),CO2浓度设为380 μL·L-1,光强设为1 500 μmol·m-2·s-1,每小区6次重复。
1.2.4 荧光参数测定
叶绿素荧光参数测定参照Genty等[13]的方法。旗叶先暗适应20 min后,再利用饱和脉冲式荧光仪(FMS-2,Hansatech Co.,UK)测定并计算旗叶的荧光参数,6次重复。PSⅡ的最大光化学效率Fv/Fm=(Fm-Fo)/Fm;ФPSⅡ=(Fm-Fs)/Fm。
1.2.5 抗氧化酶活性测定
田间选取长势一致的小麦旗叶用液氮处理,放入-80 ℃冰箱保存。称取剪碎的小麦叶片0.5 g,加5 mL预冷的提取液(pH 7.8的磷酸缓冲液),冰浴研磨,于4 ℃下12 000×g离心20 min,上清液即为提取液。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性按Tan等[14]的方法进行测定,3次重复。
1.2.6 丙二醛(MDA)含量测定
MDA含量测定参照Heath and Packer[15]的方法,略作修改。取2 mL旗叶提取液,加入0.5%硫代巴比妥酸的5%三氯乙酸溶液3 mL,于沸水浴上加热10 min,迅速冷却。于4 500转·min-1离心10 min。取上清液于532、600 nm波长下,测定吸光度,3次重复。
1.3 大区试验
1.3.1 田间试验设计
每材料种植200 m2,返青期、拔节期和灌浆期分别灌水500、450和625 m3·hm-2,基本苗180万株·hm-2,栽培管理措施同丰产田,成熟期随机选取3点进行土壤含水量测定,同时每点选取2.4 m2测产,调查有效穗数,取成熟籽粒500粒称重,换算成千粒重,3次重复。1.3.2 土壤水分消耗特征参数测定
用土钻取0~200 cm土层的土壤样品,每20 cm为一层,取土后立即装入铝盒,称鲜重,110 ℃烘干至恒重,称干重,用于计算土壤含水量。土壤含水量=(土壤鲜质量-土壤干质量)÷土壤干质量×100%。
土壤贮水量=土壤容重×土壤含水量×土层厚度[9],分别计算20、40、60、80、100、120、140、160、180、200 cm厚度的土壤贮水量,然后求和,可得每公顷土壤贮水量。
水分利用效率=籽粒产量÷作物耗水量[10]
作物耗水量=播前土壤贮水量-收获期土壤贮水量+灌水量+降水量[16]
土壤水分消耗参数均测定3次重复。
1.4 统计分析
用DPS7.05进行统计分析,Microsoft Excel 2003绘图。
2 结果与分析
2.1 目的基因 GmDREB1的分子检测
2.1.1 目的基因 GmDREB1的PCR检测
PCR检测结果表明,阳性转基因植株与阳性对照均扩增出423 bp的目的条带,而未转化植株和空白均未扩增出该条带(图1),共检测转基因植株117株,其中阳性单株101棵,阳性率达到86.32%,表明 GmDREB1基因已整合到小麦基因组中并已基本稳定遗传。

1:Maker I;2~8:部分转基因植株;9:野生型对照;10:水;11:阳性对照质粒。
1:Marker I; 2-8:Transgenic plants;9:Wild-type control;10:Water;11:Positive control.
图1 GmDREB1在转基因植株中的PCR检测
Fig.1 PCR analysis of GmDREB1 gene in transgenic wheat
2.1.2 目的基因 GmDREB1的实时荧光定量PCR检测
经实时荧光定量PCR分析,转基因小麦G19-349中 GmDREB1基因的表达量是其对照济麦19的17.38倍(图2),二者差异达极显著水平,说明外源基因已在转基因小麦中正确转录。
2.2 G19-349与济麦19的生理特性比较
2.2.1 不同水分处理下G19-349与济麦19的叶绿素相对含量
浇四水处理下,转基因小麦G19-349的叶绿素相对含量与其受体对照济麦19无显著差异。浇二水处理下,G19-349、济麦19的叶绿素相对含量分别较浇四水处理下降9.66%和19.14%;G19-349较济麦19高13.16%,二者差异达显著水平(图3)。

图柱上不同字母表示不同处理间在0.05水平上存在显著性差异。下图同。
Different letters above the columns indicate significant difference among different treatments at 0.05 level. The same in the other figures.
图3 两种灌水处理下G19-349与济麦19的叶绿素相对含量
Fig.3 Relative chlorophyll content of G19-349 and Jimai 19 under two irrigation treatments
2.2.2 不同水分处理下G19-349与济麦19的气体交换参数
浇四水处理下,转基因小麦G19-349的Pn、Gs、Tr和Ci与其受体对照济麦19均无显著差异。浇二水处理下,G19-349和济麦19的Pn、Gs、Tr和Ci均较浇四水处理显著降低;G19-349的Pn、Gs、Tr和Ci较济麦19分别高11.55%、17.26%、18.56%和14.27%,差异均达显著水平(图4)。这表明水分胁迫下气孔限制因素是转基因小麦与对照光合速率降低的主要原因,但转基因小麦受到的气孔限制小于对照。
2.2.3 不同水分处理下G19-349与济麦19的叶绿素荧光参数
浇四水处理下,转基因小麦G19-349的Fv/Fm和ΦPSⅡ与其受体对照济麦19均无显著差异。浇二水处理下,G19-349和济麦19的Fv/Fm和ΦPSⅡ均较浇四水处理显著降低;G19-349的Fv/Fm和ΦPSⅡ较济麦19分别高7.04%和17.37%,差异均达显著水平(图5),表明水分胁迫下转基因小麦和对照的最大光化学效率和实际光化学效率均显著下降,但转基因小麦仍能维持相对较高的光化学效率。

图4 两种灌水处理下G19-349与济麦19的气体交换参数
2.2.4 不同水分处理下G19-349与济麦19的抗氧化酶活性和丙二醛(MDA)含量
浇四水处理下,转基因小麦G19-349的SOD、POD、CAT活性和MDA含量与对照济麦19均无显著差异。浇二水处理下,G19-349和济麦19的SOD、POD和CAT活性均较浇四水处理显著降低,MDA含量显著上升,但G19-349的SOD、POD和CAT酶活性较济麦19分别高12.20%、15.56和16.18%,而MDA含量低11.99%,差异均达显著水平(图6),表明干旱胁迫下转基因小麦的抗氧化酶活性较高,其叶片膜脂过氧化程度较轻,表现出较好的抗氧化特性。
2.3 小区试验中G19-349与济麦19的产量及其构成
由表1可知,浇二水处理下,G19-349较济麦19显著增产10.32%,千粒重较济麦19增加5.2%,这是其增产的主要原因;浇四水处理下,G19-349较济麦19增产3.15%,差异未达显著水平。
2.4 大区试验中G19-349与济麦19的水分利用效率和产量差异
由表2可知,G19-349较济麦19耗水量降低5.89%,而产量和水分利用效率分别增加9.37%和16.39%。G19-349穗数和穗粒数较济麦19略有降低,而千粒重显著高于济麦19。表明G19-349具有节水和高产特性。
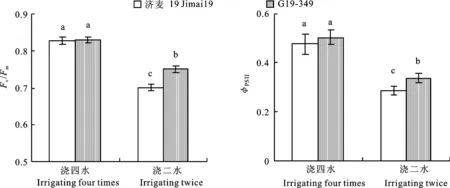
图5 两种灌水处理下G19-349与济麦19的荧光参数
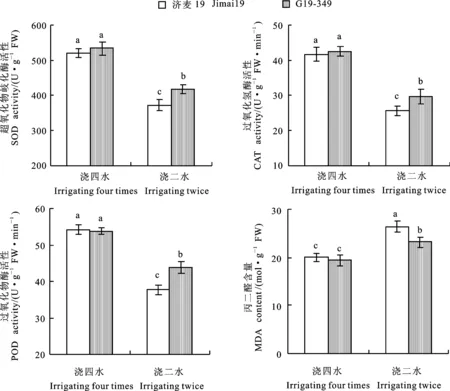
图6 两种灌水处理下G19-349与济麦19的抗氧化酶活性和丙二醛(MDA)含量

处理Treatment品种(系)Variety(line)穗数Numberofspikes/(104·hm-2)穗粒数Grainnumberperspike千粒重1000⁃kernelweight/g产量Yield/(kg·hm-2)浇二水Twoirrigation济麦19Jimai19556.55±7.14a21.51±0.58a40.69±1.05b4869.10±83.12bG19⁃349580.15±7.09a21.63±0.55a42.83±0.98a5371.75±127.36a浇四水Fourirrigation济麦19Jimai19560.70±11.75a26.13±0.17a47.22±0.53a6918.15±401.71aG19⁃349596.90±2.10a25.05±0.24a47.72±0.27a7136.35±51.54a
同列数据后不同字母分别表示两个材料间均在0.05水平上存在显著性差异。表2同。
Different letters after the values in a column indicate significant difference between two materials at 0.05 level. The same in table 2.

表2 大田条件下G19-349和济麦19的水分消耗、产量及其构成因素
3 讨 论
转录因子对信号传递和基因表达调控起非常重要的作用,当作物遭受干旱、盐害等非生物逆境胁迫时,DREB亚族可同时启动多个与植物抗逆相关的分子途径,提高作物的抗逆能力,从而使作物农艺性状得到综合改良[17-18]。利用转基因的方法将植物抗逆调节相关转录因子导入到植物中,已成为改良植物抗逆性的重要途径之一[19-22]。
前人研究表明,植物的光合作用对环境胁迫反应极为敏感,受到干旱等逆境胁迫后植物的光合速率显著降低,且气孔限制因素和非气孔限制因素均可引起植物光合速率降低[23],本研究结果表明,干旱胁迫下小麦的气孔导度较正常处理显著下降,而胞间二氧化碳浓度也显著下降(图2),表明气孔限制是转 GmDREB1基因小麦与受体对照光合速率下降的主要原因,转基因小麦受到的气孔限制较小,是其在干旱胁迫下维持相对较高碳同化速率的原因。Han等[24]研究了转NFYB转录因子拟南芥在干旱胁迫下的气体交换参数变化,得到了与本研究相似的结果。
干旱胁迫下小麦旗叶光合速率的降低,是因为叶片光合元件的结构受到破坏或活性受到抑制。有研究报道,干旱直接或间接影响植物的光系统Ⅱ(PSⅡ)[25]。叶绿素荧光参数可反映逆境对植物光合机构(主要是PSⅡ)的影响,以及光合机构对环境的适应机制,荧光参数Fv/Fm和ФPSⅡ对逆境胁迫反应十分敏感,Fv/Fm反映PSⅡ的最大光化学效率,ФPSⅡ反映光下PSⅡ的实际光化学效率实线[26]。本研究中,干旱胁迫强烈抑制了小麦旗叶PSⅡ的光化学活性,而外源 GmDREB1基因的表达可以减轻转基因小麦叶片PSⅡ损伤,从而使其维持相对较高的光合电子传递链活性和光化学效率。干旱胁迫下小麦叶片内部发生的生理生化变化是其生理表型发生变化的根本原因。本研究发现,在干旱胁迫下转基因小麦的叶绿素含量显著高于受体对照,这可能是由于转基因小麦具有较高的光合电子传递活性,产生的过剩光能和有害物质较少,减轻了干旱对叶绿素分子的破坏程度。此外,在干旱胁迫条件下转基因小麦较受体对照济麦19具有较高的抗氧化酶活性,这可能是因为外源基因上调了小麦自身的抗氧化酶相关基因表达。Bhatnagar-Mathur等[27]研究了转 DREB1A基因花生的抗旱特性,得到与本研究一致的结果,较高的抗氧化酶活性可有效清除干旱胁迫下产生的有害物质,进而保护细胞膜系统和叶绿素分子。丙二醛是膜脂过氧化的产物之一,其在逆境条件下的含量高低可反映植物受逆境伤害的程度。前人在小麦和玉米等作物上研究均发现干旱胁迫下耐旱品种的丙二醛含量显著低于不耐旱品种[28]。本研究也发现,干旱胁迫下转基因小麦的丙二醛含量显著低于受体对照,说明其膜脂过氧化程度较轻,原因可能是转基因小麦的抗氧化酶活性增强,有效清除了活性氧类物质,保护了细胞膜系统。
本研究中,转基因小麦较受体对照济麦19增产的因素是千粒重提高,干旱胁迫下转基因小麦较对照具有更好的生理特性是其获得较高千粒重的重要原因,这与Shavrukov等[29]在转 TaDREB3基因小麦上的研究结果一致。
本研究表明,干旱胁迫下外源 GmDREB1基因可降低小麦的气孔限制,减轻PSⅡ损伤,维持较高的光合电子传递活性和叶绿素含量,还通过上调抗氧化酶活性,减轻其膜脂过氧化程度,使转基因小麦在干旱胁迫下维持较高的光合速率和水分利用效率,并最终较对照获得更高产量,因而转 GmDREB1基因小麦新品系G19-349在河南省表现出了较好的抗旱节水特性。下一步我们将以河南省主推小麦品种和本课题组苗头品系为受体,对 GmDREB1基因进行遗传转化,同时将开展该基因在不同遗传背景下的作用机制研究,以期为抗逆小麦转基因育种提供试验材料和理论参考。
致谢:感谢中国农业科学院作物科学研究所马有志研究员课题组提供试验材料。
[1] 赵丽英,邓西平,山 仑.水分亏缺下作物补偿效应类型及机制研究概述[J].应用生态学报,2004,15(3):523.
ZHAO L Y,DENG X P,SHAN L.A review on types and mechanisms of compensation effect of crops under water deficit [J].ChineseJournalofAppliedEcology,2004,15(3):523.
[2] FAROOP M,HUSSAIN M,SIDDIQUE K H M.Drought stress in wheat during flowering and grain-filling periods [J].CriticalReviewsinPlantSciences,2014,33(4):331.
[3] 张龙龙,杨明明,董 剑,等.三个小麦新品种不同生育阶段抗旱性的综合评价[J].麦类作物学报,2016,36(4):426.
ZHANG L L,YANG M M,DONG J,etal.Comprehensive analysis of drought resistance of three new wheat cultivars at different growth stages [J].JournalofTriticeaeCrops,2016,36(4):426.
[4] 黎 裕,王建康,邱丽娟,等.中国作物分子育种现状与发展前景[J].作物学报,2010,36(9):1425.
LI Y,WANG J K,QIU L J,etal.Crop molecular breeding in China:current status and perspectives [J].ActaAgronomicaSinica,2010,36(9):1425.
[5] 肖兴国,张爱民,聂秀玲.转基因小麦的研究进展与展望[J].农业生物技术学报,2008,8(2):111.
XIAO X G,ZHANG A M,NIE X L.Wheat genetic transformation:advances and prospects [J].JournalofAgriculturalBiotechnology,2008,8(2):111.
[6] 王巧燕,陈 明,邱志刚,等.一个新的编码大豆DREB转录因子基因的克隆及鉴定[J].西南农业学报,2005,18(5):625.
WAMG Q Y,CHEN M,QIU Z G,etal.Cloning and identification of a new gene encoding DREB transcription factors fromGlycinemaxL.[J].SouthwestChinaJournalofAgriculturalSciences,2005,18(5):625.
[7] HSIEH T S,LEE J T,YANG P T,etal.Heterology expression of theArabidopsisC-repeat/dehydration response element binding factor1 gene confers elevated tolerance to chilling and oxidative stresses in transgenic tomato [J].Plant Physiology,2002,129(3):1086.
[8] CHEN M,WANG Q Y,CHENG X G,etal. GmDREB2,a soybean DRE-binding transcription factor,conferred drought and high-salt tolerance in transgenic plants [J].BiochemicalBiophysicalResearchCommunications,2007,353(2):299.
[9] LIN R C,DING Z S,LI L B,etal.A rapid and efficient DNA minipreparation suitable for screening transgenic plants [J].PlantMolecularBiologyReporter,2001,19(4):379.
[10] 吴 琼,许为钢,李 艳,等.田间条件下转玉米C4型PEPC基因小麦的光合生理特性[J].作物学报,2011,37(11):2046.
WU Q,XU W G,LI Y,etal.Physiological characteristics of photosynthesis in transgenic wheat with maize-pepc gene under field conditions [J].ActaAgronomicaSinica,2011,37:2046.
[11] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression date using real-time quantitative PCR and 2-ΔΔCtmethod [J].Methods,2001,25:402.
[12] HU L,LI Y,XU W,etal.Improvement of the photosynthetic characteristics of transgenic wheat plants by transformation with the maize C4phosphoenolpyruvate carboxylase gene [J].PlantBreeding,2012,131:231.
[13] GENTY B,BRIANTAIS J,BAKER N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence [J].BiochimicaetBiophysicaActa,1989,990:87.
[14] TAN W,LIU J,DAI T,etal.Alterations in photosynthesis and antioxidant enzyme activity in winter wheat subjected to post-anthesis water-logging [J].Photosynthetica,2008,46:21.
[15] HEATH R L and PACKER L.Photoperoxidation in isolated chloroplasts:I.Kinetics and stoichiometry of fatty acid peroxidation [J].ArchivesofBiochemistryandBiophysics,1968,125(1):189.
[16] 王德梅,于振文.灌溉量和灌溉时期对小麦耗水特性和产量的影响[J].应用生态学报,2008,19(9):1965.
WANG D M,YU Z W.Effects of irrigation amount and stage on water consumption characteristics and grain yield of wheat [J].ChineseJournalofAppliedEcology,2008,19(9).
[17] 张艳艳,张永丽,于振文,等.测墒补灌对冬小麦耗水特性、旗叶水势、籽粒产量和水分利用率的影响[J].麦类作物学报,2012,32(3):510.
ZHANG Y,ZHANG Y,YU Z,etal.Effects of supplemental irrigation based on soil moisture test on water consumption characteristics,water potential of flag leaf,grain yield and WUE in winter wheat [J].JournalofTriticeaeCrops,2012,3:25.
[18] 成雪峰,张凤云,柴守玺.灌水处理对春小麦穗部性状和产量的影响 [J].干旱地区农业研究,2010,28(3):13.
CHENG X F,ZHANG F Y,CHAI S X.The effects of different water supplies on spring wheat spikelet traits and yield [J].AgriculturalResearchintheAridAreas,2010,28(3):13.
[19] 郑甲成,徐兆师,胡银岗,等.小麦DREB转录因子TaAIDFa的互作蛋白筛选 [J].麦类作物学报,2010,30(2):189.
ZHENG J C,XU Z S,HU Y G,etal.Screening for the interacting proteins of DREB transcription factorTaAIDFain wheat [J].JournalofTriticeaeCrops,2010,30(2):189.
[20] 倪志勇,徐兆师,李连城,等.DREB转录因子在植物抗逆胁迫中的作用机理及应用研究进展[J].麦类作物学报,2008,28(6):1100.
NI Z Y,XU Z S,Li L C,etal.Mechanism and application prospect of DREB transcription factors in plant stress resistance [J].JournalofTriticeaeCrops,2008,28(2):1100.
[21] 荣红颖,张立全,杨凤萍.DREB1B基因在转基因小麦后代的稳定表达[J].分子植物育种,2009,7(3):437.
RONG H Y,ZHANG L Q,Yang F P,etal.Stable expression of exogenous DREB1B in transgenic wheat progeny [J].MolecularPlantBreeding,2009,7(3):437.
[22] JIANG Q,HU Z,ZHANG H,etal.Overexpression of GmDREB1 improves salt tolerance in transgenic wheat and leaf protein response to high salinity [J].TheCropJournal,2014,2(2):120.
[23] ASHRAF M,HARRIS P J C.Photosynthesis under stressful environments:an overview [J].Photosynthetica,2013,51(2):163.
[24] HAN X,TANG S,AN Y,etal.Over expression of the poplar NFYB7 transcription factor confers drought tolerance and improves water-use efficiency inArabidopsis[J].JournalofExperimentalBotany,2013,64:4589.
[25] CHEN H X,LI W J,An S Z,etal.Dissipation of excess energy in mehler-peroxidase reaction inRumexleaves during salt shock [J].Photosynthetica,2004,42(1):117.
[26] MAXWELL K,JOHNSON G N.Chlorophyll fluorescence-a practical guide [J].JournalofExperimentalBotany,2000,51(345):659.
[27] BHATNAGAR-MATHUR P,DEVI M J,VADEZ V,etal.Differential antioxidative responses in transgenic peanut bear no relationship to their superior transpiration efficiency under drought stress [J].JournalofPlantPhysiology,2009,166(11):1207.
[28] 武玉叶,李德全.土壤水分胁迫下小麦叶片渗透调节与光合作用[J].作物学报,1999,25(6):752.
WU Y Y,LI D Q.Osmotic adjustment and photosynthesis of wheat leaves under soil water stress [J].ActaAgronomicaSinica,1999,25(6):752.
[29] SHAVRUKOV Y,BAHO M,LOPATO S,etal.The TaDREB3 transgene transferred by conventional crossings to different genetic backgrounds of bread wheat improves drought tolerance [J].PlantBiotechnologyJournal,2016,14(1):313.
Drought Resistance Characteristics of Transgenic Wheat Line G19-349 Containing GmDREB1 Gene
QI Xueli,ZHANG Jianzhou,LI Yan,ZHAO Mingzhong,HAN Liupeng,HU Lin,XU Weigang
(Wheat Research Institute,Henan Academy of Agricultural Sciences/ National Engineering Laboratory for Wheat/ Henan Key Laboratory for Wheat Biology/ Key Laboratory for Wheat Biology and Genetic Breeding in Central Huang-Huai Region,Ministry of Agriculture,Zhengzhou,Henan 450002,China)
Drought may be one of the most important abiotic stresses limiting crop growth and yield. It was reported that more than 50% of the wheat planting area is affected by periodic drought in recent years,and drought has become a main limiting factor of wheat production. Here,we report the drought tolerance of a transgenic wheat line G19-349 containing GmDREB1 gene. The transgenic wheat line G19-349 and its receptor parent Jimai 19 were used as materials. Relative chlorophyll content,gas exchange and chlorophyll fluorescence parameters,the activity of antioxidant enzyme including superoxide dismutase(SOD) peroxidase(POD) and catalase(CAT),the content of malondialdehyde(MDA),and grain yield were determined. The results showed that G19-349 had higher SPAD value,net photosynthetic rate(Pn),transpiration rate(Tr),stomatal conductance(Gs),intercellular CO2concentration(Ci),maximum photochemical efficiency(Fv/Fm),actual photochemical efficiency of photosystem Ⅱ(ФPSⅡ) the activity of SOD,POD and CAT,and grain yield,but lower content of MDA than those of Jimai 19 under treatment with twice irrigation. While these indicators showed no significant difference between G19-349 and Jimai 19,under treatment with four irrigation. Compared with Jimai 19,G19-349 exhibited lower water consumption,but higher water use efficiency and grain yield,under treatment with three irrigation. The results indicate that G19-349 had higher chlorophyll content and activity of antioxidant enzyme than Jimai19,which can alleviate membrane lipid peroxidatione,maintain relatively higher photosynthetic efficiency,and ultimately its drought tolerance was improved.
Wheat(TriticumaestivumL.); Drought stress; GmDREB1 gene
2016-10-24
2016-12-13 基金项目:国家转基因生物新品种培育科技重大专项(2016ZX08002002-006);国家现代产业技术体系项目(CARS-3-1-9) 第一作者E-mail:xueliqi888@163.com;同等贡献作者张建周 E-mail:zhangjianzhou00@163.com 通讯作者:许为钢(E-mail:xuwg1958@163.com)
S512.1;S336
A
1009-1041(2017)04-0491-09
