壳寡糖糖基化修饰对酪蛋白分子特性及流变性质的影响
2017-05-15宋春丽陈佳鹏
宋春丽,陈佳鹏,任 健
(齐齐哈尔大学 农产品加工黑龙江省普通高校重点实验室,黑龙江 齐齐哈尔161006)
油料蛋白
壳寡糖糖基化修饰对酪蛋白分子特性及流变性质的影响
宋春丽,陈佳鹏,任 健
(齐齐哈尔大学 农产品加工黑龙江省普通高校重点实验室,黑龙江 齐齐哈尔161006)
研究利用转谷氨酰胺酶催化酪蛋白与壳寡糖发生糖基化交联反应,并控制反应时间 (1、2 h和4 h) 制备3种糖基化交联酪蛋白。经SDS-聚丙烯酰胺凝胶电泳、傅里叶红外光谱和游离氨基含量分析,表明酪蛋白同时发生了分子交联和糖基导入反应;经流变学分析,表明产物的表观黏度显著提高(剪切速率为1 s-1时,反应4 h的修饰产物的表观黏度增加了约10倍),且表现出剪切稀释特性;同时,频率扫描实验表明,产物分散液由类固体性质转变为类流体性质。
酪蛋白;糖基化;交联;壳寡糖;转谷氨酰胺酶
转谷氨酰胺酶(E.C. 2.3.2.13,TGase)能够催化蛋白质分子中谷氨酰胺残基与赖氨酸残基中的ε-氨基发生反应,在分子内和/或分子间形成ε-(γ-谷氨酰基)赖氨酸异肽键,导致蛋白质分子发生交联[1]。其中,赖氨酸残基能够被伯胺类物质取代[2],也就是说,TGase能够催化蛋白质分子中的谷氨酰胺残基与伯胺类物质发生反应。壳寡糖是壳聚糖通过水解多聚链制得的低相对分子质量糖,它的基本单位是D-氨基葡萄糖,单糖之间以β-(1,4)糖苷键连接[3],而且具有较好的溶解性。利用TGase的催化特性和壳寡糖的伯胺活性,制备糖基化交联蛋白质,可以改变蛋白质的某些功能性质[4-6],是一种新型的蛋白质修饰技术。理论上,壳寡糖分子中亲水性羟基能够增加蛋白质的亲水性质,对蛋白质的功能性质具有显著的影响。然而,目前对酪蛋白的壳寡糖的糖基化修饰,尤其是不同催化时间的产物的分子特性和流变特性的研究未见报道。
本研究以酪蛋白及亲水性的壳寡糖为底物,通过TGase催化酪蛋白(酰基供体)与壳寡糖(酰基受体)反应,制备糖基化交联酪蛋白,并分析不同反应时间所得产物的分子特性及流变性质,为酶法糖基化制备功能性配料提供理论依据和技术支持。
1 材料与方法
1.1 实验材料
酪蛋白:购于Sigma公司;转谷氨酰胺酶:江苏一鸣精细化工有限公司;壳寡糖(平均相对分子质量为1 kDa,脱乙酰度≥90%):浙江金壳生物化学有限公司;其他试剂均为分析纯。
Spectrum One型傅里叶变换红外光谱仪,美国PE公司;Kinexus pro+型高级旋转流变仪,英国马尔文公司;DYY-10C型电泳仪,北京六一仪器厂;UV5100型紫外可见分光光度计,上海元析仪器有限公司。
1.2 实验方法
1.2.1 糖基化交联酪蛋白的制备
酪蛋白质量浓度为50 g/L,按照酰基供体与酰基受体摩尔比为1∶3加入壳寡糖,TGase添加量为10 U/g(以酪蛋白质量计),pH为7.5、37℃下恒温振荡,反应时间分别为1、2 h和4 h,随后85℃灭酶5 min,冷却,酸沉、水洗去除未反应的壳寡糖,将沉淀溶解并调节pH 至7.0,冻干备用。
1.2.2 糖基化交联酪蛋白性质的测定
1.2.2.1 SDS-聚丙烯酰胺凝胶电泳法(SDS-PAGE)分析
参照Laemmli[7]的方法,采用恒压法电泳分析。浓缩胶、分离胶质量分数分别为4%和12%,进样量为每孔10 μL,样品处于浓缩胶时电压为80 V,待溴酚蓝前沿进入分离胶后加压至120 V。电泳结束后,拨胶,胶片进行染色和脱色。
1.2.2.2 傅里叶变换红外光谱(FTIR)分析
参照Sang等[8]的方法,采用溴化钾压片法进行傅里叶变换红外光谱分析,扫描波段为400~4 000 cm-1。
1.2.2.3 游离氨基含量的测定
采用Church等[9]的方法,即邻苯二甲醛(OPA)法测定游离氨基含量。一定体积(3 mL)的样品稀释液与同体积的OPA试剂混合,5 min后立即测定340 nm 处的吸光值。以亮氨酸标准曲线计算酪蛋白及其修饰产物中的游离氨基含量。其中,OPA试剂的配制方法为:准确称取2.00 g 十二烷基磺酸钠,分别加入30 mL硼酸缓冲液(0.4 moL/L,pH 9.5),1 mL质量浓度为80 g/L的OPA乙醇溶液和200 μLβ-巯基乙醇,最后定容至100 mL,使用前配制。
1.2.2.4 流变学分析
静态流变特性测定。用马尔文高级旋转流变仪测定蛋白质分散液的表观黏度。酪蛋白及其修饰产物质量浓度均为55 g/L(pH 7.0)。测试夹具为PU60,剪切速率为1~100 s-1。
动态流变特性测定。上述样品低振幅振荡测试确定样品分散液的线性黏弹区的应力振幅值(strain)为0.3%。在剪切频率0.1~10 Hz范围进行频率扫描实验,分析样品分散液的弹性模量(G′)和黏性模量(G″)随剪切频率的变化。
2 结果与讨论
2.1 SDS-PAGE分析
不同反应时间的酪蛋白修饰产物(糖基化交联酪蛋白,下同)的SDS-PAGE电泳谱图如图1所示。
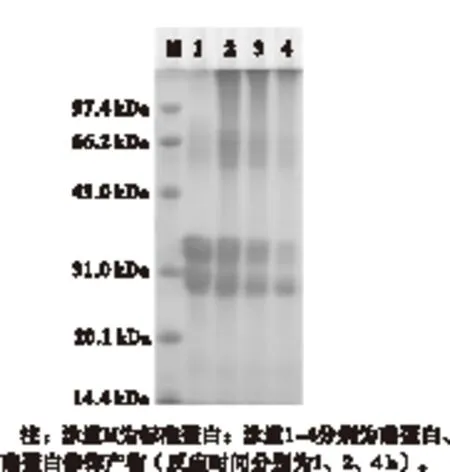
图1 酪蛋白修饰产物的SDS-PAGE电泳谱图
由图1可以看出,与酪蛋白相比,酪蛋白修饰产物的α-,β-等亚基谱带减少;同时伴随着形成了高相对分子质量的肽,随着反应的进行,出现了蛋白质共聚物,该共聚物截留在浓缩胶和分离胶的交界处,无法进入分离胶。电泳谱图的分析结果显示,TGase催化酪蛋白分子发生了交联反应,形成大分子的蛋白质共聚物。
2.2 傅里叶变换红外光谱分析
根据每种分子的组成和结构决定其独有的红外吸收光谱这一特性,利用红外光谱分析酪蛋白分子的侧链结构变化。酪蛋白及其修饰产物的红外光谱图如图2所示。由图2可以看出,与酪蛋白相比,酪蛋白修饰产物在1 050~1 150 cm-1处的伸缩振动增强,而此处为C—C、C—O的伸缩振动区和O—H的变形振动[10]。这是由于壳寡糖中含有较多的羟基引起的。傅里叶变换红外光谱结果表明,TGase催化壳寡糖连接到酪蛋白分子中。

图2 酪蛋白及其修饰产物的红外光谱图
2.3 游离氨基含量的变化
酪蛋白及其修饰产物的游离氨基含量如图3所示。
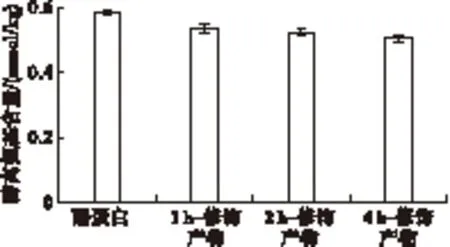
图3 酪蛋白及其修饰产物游离氨基含量的变化
由图3可以看出,酪蛋白修饰产物的游离氨基含量明显低于原料酪蛋白。随着反应时间的延长,游离氨基含量逐渐下降,主要是由于酪蛋白分子中赖氨酸的ε-氨基参与了蛋白质的自交联。结果表明,TGase在催化壳寡糖导入酪蛋白的过程中,同时酪蛋白分子发生了自交联反应。同时表明,随着反应时间的延长,蛋白质的自交联程度增加。
2.4 流变性质分析
2.4.1 表观黏度
表观黏度是液态物质的流变性质的一个重要评价指标,表征液体或流体中分子间的吸引力[11]。酪蛋白及其修饰产物的表观黏度测定结果如图4所示。
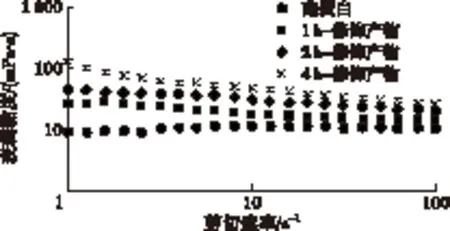
图4 酪蛋白及其修饰产物分散液的表观黏度
由图4可以看出,与酪蛋白相比,酪蛋白修饰产物分散液的表观黏度增高,而且4 h-修饰产物的表观黏度最高。此外,糖基化交联修饰改变了分散液的流变行为,由接近牛顿流体特性转变为非牛顿流体特性(黏度随剪切速率的增加而降低)。这是因为蛋白质的交联会使蛋白质分子的相对分子质量增加和体积增加[12],进而蛋白质的表观黏度会增加。随着剪切速率逐渐增加,蛋白质分子的表观体积减小,酪蛋白修饰产物表现出剪切稀释特性。而糖基的水合作用也会增加蛋白质的表观黏度[13],因而糖基化交联酪蛋白的表观黏度显著增加。
2.4.2 黏弹特性
弹性模量(G′)和黏性模量(G″)一定程度上可以分别用来表征样品的类似固体和类似液体的程度[14]。酪蛋白及其修饰产物分散液的G′和G″随剪切频率的变化如图5所示。
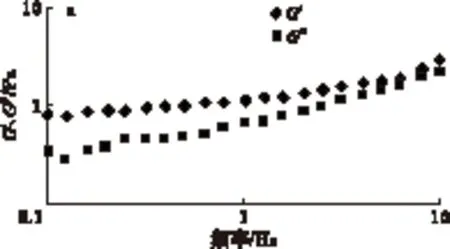
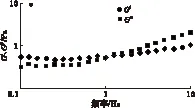
由图5可以看出,在测定的振荡频率范围内,酪蛋白分散液的弹性模量高于黏性模量,表现出固体的特性。与酪蛋白相比,糖基化交联酪蛋白表现出不同的黏弹特性,从图5b可以看出,糖基化交联酪蛋白在测试频率范围内(0.1~10 Hz),黏性模量较弹性模量增加或基本相同,表明糖基化交联酪蛋白的类液体性质表现得更突出。此外可以看出,不同反应时间所得的糖基化交联酪蛋白的黏弹性质存在较大的差异;表明TGase在不同条件下的修饰作用会导致相应酪蛋白产品内部结构上的差异。
3 结 论
转谷氨酰胺酶能够催化酪蛋白与壳寡糖发生糖基化交联反应,该反应显著地改变了酪蛋白的分子特性和流变性质。反应过程中,酪蛋白分子发生了交联,形成了酪蛋白聚合物,同时导入了壳寡糖分子。产物的表观黏度显著增加,黏弹性质发生改变。
[1] KIELISZEK M, MISIEWICZ A. Microbial transglutaminase and its application in the food industry: a review [J]. Folia Microbiol, 2014, 59(3):241-250.
[2] DEJONG G, KOPPELMAN S. Transglutaminase catalyzed reactions: impact on food applications [J]. J Food Sci, 2002, 67(8): 2798-2806.
[3] 蒋挺大. 壳聚糖 [M]. 北京: 化学工业出版社, 2001.
[4] SONG C L, ZHAO X H. Structure and property modification of an oligochitosan-glycosylated and crosslinked soybean protein generated by microbial transglutaminase[J]. Food Chem, 2014, 163(3):114-119.
[5] SONG C L, ZHAO X H. The preparation of an oligochitosan-glycosylated and cross-linked caseinate obtained by a microbial transglutaminase and its functional properties[J]. Int J Dairy Tech, 2013, 67(1):110-116.
[6] 刘金玲, 刘晓兰, 郑喜群. 转谷氨酰胺酶催化壳寡糖糖基化修饰玉米谷蛋白[J]. 食品科技, 2015(9):7-11.
[7] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 [J]. Nature, 1970, 227(5259): 680-685.
[8] SANG L Y, ZHOU X H, YUN F, et al. Enzymatic synthesis of chitosan-gelatin antimicrobial copolymer and its characterisation [J]. J Sci Food Agric, 2010, 90(1): 58-64.
[9] CHURCH F C, SWAISGOOD H E, PORTER D H, et al. Spectrophotometric assay usingo-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins [J]. J Dairy Sci, 1983, 66(6): 1219-1227.
[10] GUAN J J, QIU A Y, LIU X Y, et al. Microwave improvement of soy protein isolate-saccharide graft reactions[J]. Food Chem, 2006,97:577-585.
[11] 李里特. 食品物性学 [M]. 北京:中国农业出版社, 2001.
[12] BÖNISCH M P, LAUBER S, KULOZIK U. Improvement of enzymatic cross-linking of casein micelles with transglutaminase by glutathione addition [J]. Int Dairy J, 2007, 17(1): 3-11.
[13] BRANCA C, MAGAZS, MAISANO G, et al.α,α-trehalose/water solutions. 5. hydration and viscosity in dilute and semidilute disaccharide solutions [J]. J Phys Chem B, 2001, 105(41): 10140-10145.
[14] 刘晓恒,华欲飞,吕玉翠. 改性大豆浓缩蛋白强化对酸奶的流变和感官性质的影响[J]. 中国油脂,2013,38(4): 26-30.
Effects of oligochitosan glycation modification on molecular characteristics and rheological properties of casein
SONG Chunli, CHEN Jiapeng, REN Jian
(Key Laboratory of Processing Agricultural Products of Heilongjiang Province,Qiqihar University, Qiqihar 161006, Heilongjiang, China)
Transglutaminase was used to catalyze glycation cross-linking reaction of casein and oligochitosan. Three kinds of glycation cross-linked casein were prepared by controlling reaction time of 1, 2, 4 h. The results of SDS-polyacrylamide gel electrophoresis, Fourier infrared spectrum and analysis of free amino acid content indicated that the casein was crosslinked and glycosylated. The rheological analysis result indicated that the apparent viscosity of the product increased significantly and exhibited shear thinning behavior. The apparent viscosity of modified product obtained by reacting for 4 h increased by about ten times under the condition of shear rate 1 s-1. The frequency scan experiment showed that the product dispersion transformed from solid-like character into fluid-like character.
casein; glycosylation; cross-linking; oligochitosan; transglutaminase
2016-05-28;
2016-10-27
黑龙江省自然科学基金项目(B201421)
宋春丽(1980),女,副教授,博士,研究方向为蛋白质化学(E-mail)songchunlilily@sina.com。
TQ931;TS201.2
A
1003-7969(2017)03-0095-04
