基于UPLC-Q-TOF MSE的凝固型酸奶的代谢图谱研究
2017-05-15
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,呼和浩特010018)
基于UPLC-Q-TOF MSE的凝固型酸奶的代谢图谱研究
王越男,席晓敏,米智慧,孙天松
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,呼和浩特010018)
将益生菌L.Plantarum P-8与传统酸奶发酵剂YC-X11共同接种进行发酵乳制备,采用UPLC-Q-TOF MSE代谢组学技术分析凝固型酸奶的代谢图谱。结果表明:L.Plantarum P-8和YC-X11共同发酵的酸奶和传统酸奶的的BPI基峰图存在较大差异。不同发酵剂发酵的凝固型酸奶中,共鉴定亮氨酸、甲硫氨酸、苯丙氨酸、色氨酸、脯氨酸、缬氨酸、4-羟基苯乳酸、泛酸、4-吡哆酸、柠檬酸、胆碱、乙酰胆碱、His-Val、Trp-Ser等43个代谢物。
酸奶;代谢图谱;UPLC-Q-TOF MSE;代谢组学
0 引言
自从人类开始驯化哺乳动物以来,人类就开始消费乳及乳制品,被公认为是世界上最古老牛乳贮藏的乳制品[1-2]。在发酵过程中,牛乳中的乳糖、蛋白质和脂肪等成分在微生物的作用下发生理化变化,产生的代谢物能够使酸奶的pH值降低、形成凝胶结构和产生特殊风味[3-4]。
代谢组学技术(MS和NMR)已经成功的应用到乳制品在发酵、成熟和贮藏过程中代谢物的测定[5-9]。然而,利用代谢组学技术研究乳制品在发酵过程中益生菌活性的报道非常少[10]益生菌L.plantarum P-8是从传统发酵乳中分离的具有较强耐酸、耐胆盐、抗菌活性等优良特性的乳杆菌[11]。本文主要利用益生菌L.Plantarum P-8和传统发酵剂YC-X11共同发酵凝固型酸奶,利用UPLC-Q-TOF MSE代谢组学技术结合主成分分析(PCA)和最小二乘判别分析(OPLS-DA)研究凝固型酸奶的代谢图谱,并对差异代谢物进行鉴定。
1 实验
1.1材料与试剂
实验菌株Lactobacillus plantarum P-8(L.plantarum P-8)由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供,传统发酵剂(含Streptococcus thermophi⁃lus和Lactobacillus delbrueckii subsp.bulgaricus,YC-X11)以直投式发酵剂形式提供,脱脂乳粉,甲酸、和乙腈(质谱纯)。
1.2酸奶的制备
在还原牛乳(脱脂乳粉11%)经95°C、5 min巴氏杀菌后,冷却至37°C,按接种量1.0×107CFU/mL分别接入益生菌L.plantarum P-8和0.0003%的传统发酵剂,于37°C恒温培养箱中培养至pH值为4.5终止发酵,并置于-80°C冰箱备用。
1.3酸奶样品的预处理
将-80°C的酸奶样品置于室温下解冻,经4 500 g离心10 min,取上清液1 mL,加入7 mL的乙腈溶液,漩涡震荡2 min后12 000 g高速离心15 min,取上清液真空浓缩至干,加入500μL体积分数为40%的乙腈溶液复溶,经0.22μm微孔滤膜过滤后置于-20°C保存备用。
1.4方法
使用ACQUITY UPLC-Q-TOF MSE(Waters,USA)对凝固型酸奶进行代谢组学分析,Q-TOF质谱仪采用ESI源和PDA检测器。色谱柱为BEH C18(2.1mm×100mm,1.7μm),样品进样量为10μL,流速0.45 mL/min,柱温为40°C。正离子扫描模式下,流动相A为水和0.1%甲酸溶液,流动相B为乙腈溶液和0.1%甲酸溶液,液相条件如表1所示。
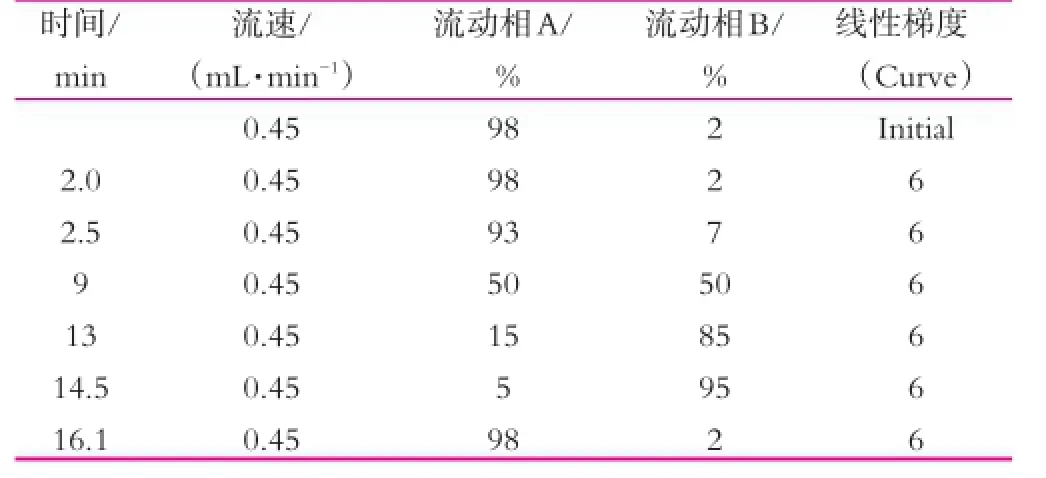
表1 酸奶的UPLC-Q-TOF MSE的液相条件
Q-TOF质谱仪采用ESI+扫描模式,质谱条件为:毛细管电压3/2.5 kV(+/-);锥孔电压40 V;离子源温度100°C;去溶剂气温度350°C;去溶剂气(氮气)流速800/600 L/h(+/-);进样锥气体(氮气)流速50 L/h。质荷比扫描范围50~1 000 m/z,低能量和高能量的碰撞能分别为6 eV和20~45 eV。采用质量浓度为2 ng/mL亮氨酸脑啡肽(m/z 556.2771u[M+H]+/m/z)作为质量校正液,流速为30μL/min。
1.5数据处理及代谢物的鉴定
UPLC-Q-TOF MSE获得的原始数据经Marker⁃Lynx和Progenesis QI软件进行数据提取,完成锋对齐、峰识别、去卷积化等数据预处理,然后将此数据集导入EZinfo软件(Waters,USA)中进行处理,并对数据进行PCA分析和OPLS-DA分析。结合VIP值≥1,差异倍数≥2和P值≤0.05确定酸奶样品之间的显著差异代谢物。
经筛选出的差异代谢物根据其质核比,保留时间以及碎片信息通过Progenesis QI软件在HMDB(http: //www.hmdb.ca/), ECMDB (http://www.ecmdb. ca/),YMDB(http://www.ymdb.ca/)和 METLIN(http://www.metlin.scripps.edu/)等数据库进行结构的鉴定。
2 结果与分析
2.1凝固型酸奶UPLC-Q-TOF MSE色谱图分析
本研究采用了UPLC-Q-TOF MSE代谢组学技术研究传统发酵剂发酵的酸奶(b)和添加益生菌L. plantarum P-8和传统发酵剂共同发酵的酸奶(bp)中代谢物变化。图1分别显示了传统发酵剂发酵的酸奶(b)、添加益生菌L.plantarum P-8和传统发酵剂共同发酵的酸奶(bp)在ESI+扫描模式下的基峰图(base peak intensity chromatograms,BPI chromatograms)。由图1可以看出,在该色谱条件下,各组图谱之间存在较大差异。
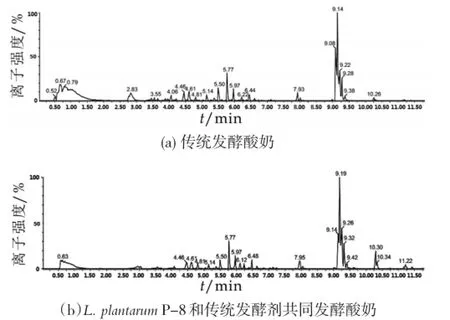
图1 发酵酸奶的基峰
2.2凝固型酸奶代谢组学分析
为了观察两组样品之间的代谢物的差异性,将Progenesis QI软件提取到的质谱数据导入EZinfo软件进行了PCA和OPLS-DA多元统计分析。
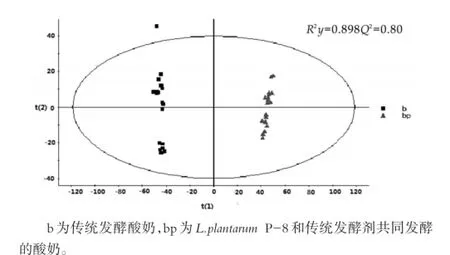
图2 两组酸奶样品的PCA得分
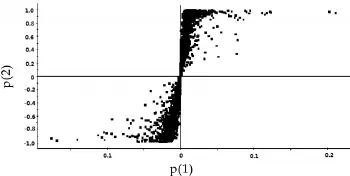
图3 两组酸奶样品的OPLS-DA得分
由图2和图3可以看出,由PCA和OPLS-DA的得分图可见,两组样品(b和bp)组间能够完全区分,组内具有一定的聚类作用。该模型的解释率和预测率R2Y=0.898,Q2=0.80,R2Y和Q2均在0.79以上,该模型的区分程度和预测度较好。OPLS-DA的得分图结合P值等参数能够更好解释不同的代谢物在不同的酸奶样品中代谢物含量的变化。
2.3代谢差异物的鉴定和分析
本研究采用MSE数据采集方法得到母离子和相应的碎片离子信息,应用Progenesis QI软件进行代谢物鉴定。在ESI+模式下共检测到2617个代谢物,其中43个代谢物满足筛选原则,并对其进行了鉴定,主要为氨基酸、有机酸、小肽和脂类的衍生物,结果见表2。
由表2可知,传统发酵酸奶与L.plantarum P-8和传统发酵剂共同发酵的酸奶相比,在传统发酵酸奶中,参与氨基酸代谢的亮氨酸、甲硫氨酸、苯丙氨酸和色氨酸等代谢物明显增加,游离氨基酸的种类和数量直接影响酸奶风味。His-Val,Trp-Ser,Phe-Gly-Asp等短肽在发酵后增加。泛酸、4-吡哆酸参与维生素代谢的也显著增加,参与TCA循环的2-羟基-2-乙基琥珀酸、柠檬酸等代谢物增加,甘油磷酸胆碱、胆碱、乙酰胆碱、羟基丁酸胆碱等参与脂质代谢的代谢物增加。在发酵过程中,在Streptococcus thermophilus和Lacto⁃bacillus delbrueckii subsp.bulgaricus共同作用下,能够把牛乳中的成分有效的转化为各种代谢物[12]。

表2 传统发酵酸奶和L.plantarum P-8和传统发酵剂共同发酵的酸奶中的差异代谢物
在L.plantarum P-8和传统发酵剂共同发酵的酸奶中,Lys-Glu-Ser-Thr-Leu、Ala-Ala-Pro-Thr、Leu-Lys-Leu和Leu-Lys-Leu等短肽类的代谢物显著增加,脯氨酸和缬氨酸的在发酵过程中增加,4-羟基苯乳酸在共同发酵的酸奶中也显著增加。乳酸菌发酵过程中会产生众多具有抗真菌功能的小分子代谢产物,其中苯乳酸与4-羟基苯乳酸是目前生物防腐剂的研究热点[13]。Lavermicocca等人从 L.plantarum 21B发酵液中分离纯化得到两种具有强烈抑制真菌作用的分子,分别鉴定为苯乳酸和4-羟基苯乳酸[14]。随后Valerio等人发现乳酸菌可以普遍发酵生成4-羟基苯乳酸,其发酵产量为0~52.78μg/mL[15]。
在传统发酵酸奶与L.plantarum P-8和传统发酵剂共同发酵的酸奶中,小肽的数量增加,这些短肽可能对人体的健康有益,如降低胆固醇、缓解紧张和抗氧化等作用,这些小肽也有利于人们对酸奶的消化吸收[16]。Ghosh D[17]等人研究S.thermophilus和L.planta⁃rum混合发酵牛乳,能够提高酸奶的功能和益生特性,蛋白降解为大量的短肽和氨基酸,并且这些短肽具有一定的生物活性。Khalid N M[18]等人通过SDS-PAGE的方法测定L.plantarum水解牛乳蛋白,发现L.plantarum主要降解牛乳中的β-酪蛋白,产生游离氨基酸和短肽。在酸奶中,我们只发现两种参与TCA循环的有机酸2-羟基-2-乙基琥珀酸和柠檬酸,Kamalrul[19]等人利用GC-MS的方法研究在不同的条件下培养乳酸菌的代谢产物,发现除了各种氨基酸外,参与TCA循环的的琥珀酸、苹果酸和柠檬酸等有机酸的数量显著增加。甘油磷脂代谢和肉毒碱代谢是脂质代谢中发生变化的主要代谢途径,其中甘油磷酸胆碱、胆碱、乙酰胆碱、羟基丁酸胆碱在传统发酵酸奶中显著增加,Seline K G,Johein H[20]等人发现在发酵乳制品中,胆碱的最大量为8~530 mg/kg。
3 结论
(1)传统发酵剂发酵的酸奶和添加益生菌L.plan⁃tarum P-8和传统发酵剂共同发酵的酸奶的BPI基峰图存在较大差异。
(2)在不同发酵剂的凝固型酸奶中,共鉴定亮氨酸、甲硫氨酸、苯丙氨酸、色氨酸、脯氨酸、缬氨酸、4-羟基苯乳酸、泛酸、4-吡哆酸、柠檬酸、胆碱、乙酰胆碱、His-Val和Trp-Ser等43个代谢物。
[1]SFAKIANAKIS P,TZIA C.Conventional and innovative processing of milk for yogurt manufacture;development of texture and flavor:a review[J].Foods,2014,3(1):176-193.
[2]LEE W J,LUCEY JA.Formation and physical properties of yogurt[J]. Asian-Australasian Journal of Animal Sciences,2010, 23(9):1127-1136.
[3]SMIT G,SMIN B A,ENGELS W J M.Flavour formation by lactic acid bacteriaand biochemical flavour profiling ofcheese products[J]. FEMS Microbiology Reviews,2005,29(3):591-610.
[4]IYER R,TOMAR S K,MAHESWARI T U,et al.Streptococcus ther⁃mophilus strains:Multifunctional lactic acid bacteria[J].International Dairy Journal,2010,20(3):133-141.
[5]SETTACHAIMONGKON S,NOUT M JR,FERNANDES E C A, et al.The impact of selected strains of probiotic bacteria on metabolite formation in set yoghurt[J].International Dairy Journal,2014,38(1): 1-10.
[6]BOUDONCK K J,MITCHELL M W,WULFF J,et al.Characteriza⁃tion of the biochemical variability of bovine milk using metabolomics [J].Metabolomics,2009,5(4):375-386.
[7]PIRAS C,MARINCOLA F C,SAVORANIF,et al.A NMR metab⁃olomics study of the ripening process of the Fiore Sardo cheese pro⁃duced with autochthonous adjunct cultures[J].Food chemistry,2013, 141(3):2137-2147.
[8]MOZZI F,ORTIZ M E,BLECKWEDEL J,et al.Metabolomics as a tool for the comprehensive understanding of fermented and functional foods with lactic acid bacteria[J].Food research international,2013,54 (1):1152-1161.
[9]LE BOUCHER C,COURANT F,JEANSON S,et al.First mass spectrometry metabolic fingerprinting of bacterial metabolism in a modelcheese[J].Food chemistry,2013,141(2):1032-1040.
[10]RODRIGUES D,SANTOS C H,ROCHA-SANTOS T A P,et al.Metabolic profiling of potential probiotic or synbiotic cheeses by nuclear magnetic resonance(NMR)spectroscopy[J].Journal of agri⁃culturaland food chemistry,2011,59(9):4955-4961.
[11]何秋雯,王水泉,鲍雅静,礼贺,王记成,张和平,陈卫.益生菌Lactobacil⁃lusplantarum P8与Streptococcus thermophilus混合发酵对发酵乳品质的影响[J].中国乳品工业,2012,(10):8-13.
[12]SETTACHAIMONGKON S,VALENBERG H J F,GAZI I,et al. Influence of Lactobacillus plantarum WCFS1 on post-acidification,me⁃tabolite formation and survival of starter bacteria in set-yoghurt[J]. Food Microbiology,2016,59:14-22.
[13]沐万孟,杨钰,贾江花,张涛,江波.4-羟基苯乳酸的HPLC检测研究[J].食品工业科技,2011,(07):432-434.
[14]LAVERMICOCCA P,VALERIO F,EVIDENTE A,et al.Purifica⁃tion and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarum strain 21B[J].Appl Environ Micro⁃biol,2000,66:4084-4090.
[15]VALERIO F,LAVERMICOCCA P,PASCALE M.Production of phenyllactic acid by lactic acid bacteria:an approach to the selection of strains contributing to food quality and preservation[J].FEMS Mi⁃crobiol Lett,2004,233:289-295.
[16]PARK M K,CHOIH K,KWON D Y,KIM,Y S.Study of organic acids in freeze dried Chongkukjang formed during fermentation us⁃ing SPME and stableisotope dilution assay(SIDA)[J].Food Chemistry, 2007,105:1276-1280.
[17]GHOSH D,CHATTORAJ D K,CHATTOPADHYAY P.Studies on changes in microstructure and proteolysis in cow and soy milk curd during fermentation using lactic cultures for improving protein bioavailability[J].Journal of food science and technology,2013,50 (5):979-985.
[18]KHALID N M,MARTH E H.Proteolytic activity by strains of Lacto⁃bacillus plantarum and Lactobacillus casei[J].Journal of Dairy Science, 1990,73(11):3068-3076.
[19]AZIZAN K A,BAHARUM S N,MOHD NOOR N.Metabolic profiling of Lactococcus lactis under different culture conditions[J].Mol⁃ecules,2012,17(7):8022-8036.
[20]SELINE K G,JOHEIN H.The determination of L-carnitine in sev⁃eralfood samples[J].Food Chemistry,2007,105(2):793-804.
Study on metabolic profile of set yogurt based UPLC-Q-TOF MSE
WANG Yuenan,XIXiaomin,MIZhihui,SUN Tiansong
(Key Laboratory of Dairy Biotechnology and Engineering,Ministry of Education,Inner Mongolia Agricultural Universi⁃ty,Hohhot 010018,China)
Yogurt was prepared with L.plantarum P-8 and traditional yogurt starter YC-X11 in this study,metabolic profile of set yogurt were systematically analysed by UPLC-Q-TOF MSE based metabolomics.The results indicated that changes in the UPLC-Q-TOF MSE base peak intensity(BPI)chromatogram profiles of co-culture L.plantarum P-8 with YC-X11 and traditional yogurt were significant differ⁃ences.A total of 43 metabolites including L-Leucine,L-Phenylalanin,L-Tryptophan,Methionine,L-Proline,L-Valine,4-Hydroxy⁃phenyllactic acid,Pantothenic Acid,4-Pyridoxic acid,Citric acid,L-Carnitine,Acetylcarnitine,His-Val,Trp-Ser etc.were indentified in set yogurt fermented by different starters.
yogurt;metabolite profile;UPLC-Q-TOF MSE;metabolomics
Q935
A
1001-2230(2017)04-0004-04
2016-08-17
王越男(1978-),女,博士研究生,研究方向为农产品加工及贮藏工程。
孙天松
