制油工艺对菜籽油微量成分和氧化稳定性的影响
2017-05-15李世刚曹培让李进伟刘元法
张 亮,李世刚,曹培让,蒋 将,李进伟,刘元法
(1.江南大学 食品学院,江苏 无锡 214122; 2.菏泽学院 生命科学系,山东 菏泽 274015)
油脂加工
制油工艺对菜籽油微量成分和氧化稳定性的影响
张 亮1,李世刚2,曹培让1,蒋 将1,李进伟1,刘元法1
(1.江南大学 食品学院,江苏 无锡 214122; 2.菏泽学院 生命科学系,山东 菏泽 274015)
以不同制油工艺制得的菜籽油为原料,比较研究了菜籽油的酸值、过氧化值、脂肪酸和甘三酯的组成及微量营养成分。结果表明:制油工艺对菜籽油的脂肪酸和甘三酯组成无显著性影响;水酶法制得菜籽油的酸值(KOH)相对较高,为0.995 mg/g,但富含β-胡萝卜素、植物多酚,含量分别为5.40 mg/kg和152.08 mg/kg;浸出菜籽毛油富含生育酚和植物甾醇,含量分别为833.74 mg/kg和6 607.35 mg/kg;精炼菜籽油的酸值(KOH)最低,仅为0.233 mg/g,但精炼菜籽油的微量营养成分相对较少。分别以氧化诱导时间和DPPH自由基清除能力为指标,评价了不同制油工艺制得菜籽油的氧化稳定性,结果发现5种菜籽油的氧化稳定性大小是:水酶法菜籽油最强,精炼菜籽油最弱,而浸出菜籽毛油、热榨菜籽油和冷榨菜籽油介于其间,这一性质和油中的植物多酚和β-胡萝卜素含量呈显著正相关。
制油工艺;菜籽油;微量成分;氧化稳定性;水酶法;多酚
不同的制油工艺对出油率、产品质量等方面有显著影响[1-2]。目前,我国的制油工艺主要有冷榨、热榨、溶剂(如正己烷)浸出和水酶法等。冷榨法属于物理挤压压榨法,加压不升温,最大程度地保留了油脂的营养物质,但出油率相对较低;热榨法是油料经过高温蒸炒工序后再进行压榨的制油工艺,出油率优于冷榨法,但营养物质会有一定程度的损失;溶剂浸出法是利用有机溶剂(如正己烷)的“相似相溶”原理来实现的,出油率高,缺点是其他非油脂物质和有机溶剂残留,需要进一步的化学精炼[3];水酶法是近年来开发利用的一种新的制油工艺,它是在对油料进行机械破碎的基础上, 采用酶降解油料植物细胞获得油脂[4]。目前的菜籽油制取工艺主要是预榨与溶剂浸出等方法,然后再经过脱胶、脱酸、脱色和脱臭等工艺对菜籽油进行精炼,精炼会导致大部分生物活性的脂肪伴随物如生育酚、植物甾醇、多酚、β-胡萝卜素等的损失,降低了菜籽油的营养价值。
不同制油工艺影响油脂的物理化学性质和品质,其中包括微量成分的含量,例如生育酚、甾醇、多酚和类胡萝卜素等。这些微量成分是重要的生物活性物质,具有防治心脑血管等疾病的功能。因此,油脂的制取技术影响着食用油的品质和营养价值,进而影响着人们的身体健康。在菜籽油的制取过程中发现,一些新的制油工艺,如经过脱壳蒸炒压榨、冷榨后正己烷提取、双螺旋压榨后甲醇选择性提取等工艺与传统精炼菜籽油比较,其所获得的菜籽油中微量活性物质含量高。Attorri 等[5]在对动物喂养的实验中发现,这些菜籽油能够显著降低血液总胆固醇含量,以及和心脑血管疾病相关的风险因子。然而在国内,系统地评价单一油料不同制油工艺所获得油脂的理化性质和微量成分的差异还未见报道。本文将冷榨法、热榨法、水酶法、溶剂浸出法制取的菜籽毛油与浸出精炼后的菜籽油比较,研究比较不同制油工艺对菜籽油品质的影响,旨在为菜籽油的适度加工提供参考。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
油菜籽、正己烷浸出的新鲜菜籽毛油和浸出精炼后的菜籽油由渤海油脂有限公司提供。所用的菜籽油都来自于同一批油菜籽,所有的油样中均未添加任何抗氧化剂。
正己烷、氢氧化钠、氢氧化钾、无水甲醇、无水乙醇、乙酸乙酯、无水乙醚、异辛烷、冰乙酸、三氟化硼、酚酞、碘化钾、硫代硫酸钠、可溶淀粉、抗坏血酸、福林酚试剂、焦性没食子酸均为分析纯,购于国药集团化学试剂有限公司;β-胡萝卜素标准品,购于上海源叶生物科技有限公司;BSTFA+TMCS(99∶1)硅烷化试剂、α-胆甾烷醇标准品、脂肪酸标准品和DPPH(二苯代苦味酰基自由基),购于美国Sigma公司;生育酚混合标准品(含有α、β、γ、δ4 种类型,纯度>95%),购于瑞士Roche公司;果胶酶、纤维素酶和碱性蛋白酶,购于诺维信公司。
1.1.2 仪器与设备
Rancimat743氧化稳定仪,瑞士Rancimat公司;ST310型全自动索氏抽提仪,福斯赛诺公司;海能K9840自动凯氏定氮仪,济南海能仪器有限公司;6YZ-26液压榨油机,郑州市鼎盛机械制造有限公司;Diol-SPE二乙醇基固相萃取小柱(500 mg,6 mL),美国赛芬公司;Agilent 7820A 气相色谱仪,Agilent公司;Waters1525高效液相色谱仪、Waters2996二极管阵列检测器,美国Waters公司;Trace GC Ultra气相色谱仪、ISQ质谱检测仪,美国Thermo公司。
1.2 实验方法
1.2.1 油脂制取
(1)冷榨菜籽油:在室温下,油菜籽经液压榨油机在40 MPa下压榨得到菜籽油,4 000 r/min离心10 min,收集得到的油为冷榨菜籽油。
(2)热榨菜籽油:油菜籽经120℃下蒸炒15 min后,在室温下,经液压榨油机40 MPa下压榨得到菜籽油,4 000 r/min离心10 min,收集得到的油为热榨菜籽油。
(3)水酶法菜籽油:将油菜籽用粉碎机粉碎,过50目筛。取粉碎后的油菜籽放入酶解罐中,按1∶5的料液比加水,并加入0.5%的果胶酶和0.5%的纤维素酶,调节pH至4.5,在温度50℃下酶解2 h。再调酶解液pH 到9,加入1%碱性蛋白酶,继续酶解2 h。酶解结束后,将酶解液4 000 r/min离心10 min,收集上清液油层,于40℃真空干燥箱至恒重,所得的油为水酶法菜籽油。
1.2.2 酸值和过氧化值的测定
酸值按GB/T 5530—2005测定,过氧化值按GB/T 5538—2005测定。
1.2.3 生育酚含量的测定
精确称取1.0 g油样,置于棕色容量瓶中,加入正己烷溶解,超声10 min后,定容至10 mL,经微孔滤膜(0.22 μm)后进行高效液相色谱分析。以1 mg/mL 混合生育酚标准品的正己烷溶液,用外标法计算测定生育酚含量[6]。
色谱条件:Sepherisorb Silica柱(25 cm×4.6 mm×5 μm);流动相为正己烷-异丙醇(98∶2);流速1 mL/min;柱温25℃;检测波长295 nm;进样量20 μL。
1.2.4 脂肪酸组成分析
参照GB/T 17376—2008方法,将菜籽油甲酯化后,以Agilent 7820A气相色谱仪进行分析。
1.2.5 甘三酯组成的测定
参照AOCS Ce 5b-89方法利用高效液相色谱仪进行测定。
1.2.6 植物甾醇含量的测定
参照文献[7]的方法将油样进行皂化,制备物以Trace GC Ultra气相色谱仪、ISQ质谱检测仪测定菜籽油中的甾醇含量。
1.2.7 多酚含量的测定
参照文献[8]的方法进行多酚的固液萃取以及前处理,用焦性没食子酸作标准品参照GB/T 8313—2008,计算油样中的多酚含量。
1.2.8β-胡萝卜素含量的测定
参照文献[9]的方法,选用反向高效液相色谱测定,HederaODS-2柱(25 cm×4.6 mm×5 μm)。
1.2.9 DPPH自由基清除能力的测定
用无水乙醇将各油样稀释至1.0、2.5、5.0、7.5、10.0、12.5、15.0 g/L的质量浓度。取不同质量浓度的样品 1 mL,加入4 mL DPPH乙醇溶液(新鲜配制,10-4mol/L),摇匀并封口,在室温下密闭暗置90 min。用无水乙醇作参比液,于515 nm 波长下测定吸光值[10]。以样品的质量浓度对自由基清除率作图并进行线性拟合,计算出IC50。
1.2.10 统计学分析
采用SPSS19.0统计软件对结果进行分析,用Turkey法进行组间比较,相关性分析采用Pearson法分析;实验结果以“均值±标准差”(X±SD)表示,以P<0.05为具有统计学意义。
2 结果与讨论
2.1 菜籽油酸值和过氧化值
5种菜籽油的酸值和过氧化值如表1所示。
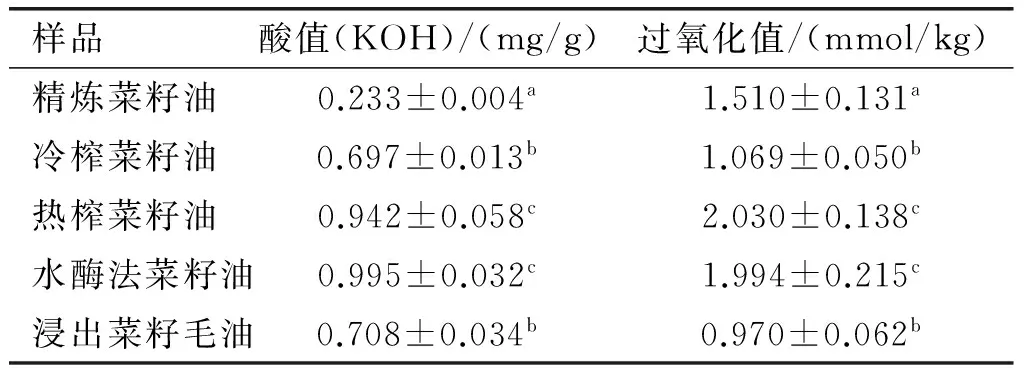
表1 不同制油工艺对菜籽油酸值、过氧化值的影响
注:数据为3次独立实验的“均值±标准差”;同列不同字母表示差异显著。
从表1可以看出,5种菜籽油的过氧化值均小于 5 mmol/kg,符合国家一级菜籽油标准。 但是不同制油工艺所制取菜籽油的酸值和过氧化值之间具有显著差异。相比而言,精炼菜籽油的酸值最低,而水酶法和热榨法制取的菜籽油酸值最高,这可能是水酶法或热榨法制油过程中内源性脂肪酶反应催化甘三酯生成游离脂肪酸所致。菜籽油精炼过程去除游离脂肪酸降低了精炼菜籽油的酸值。
2.2 菜籽油脂肪酸组成分析
表2是5种不同制油工艺菜籽油的脂肪酸组成。
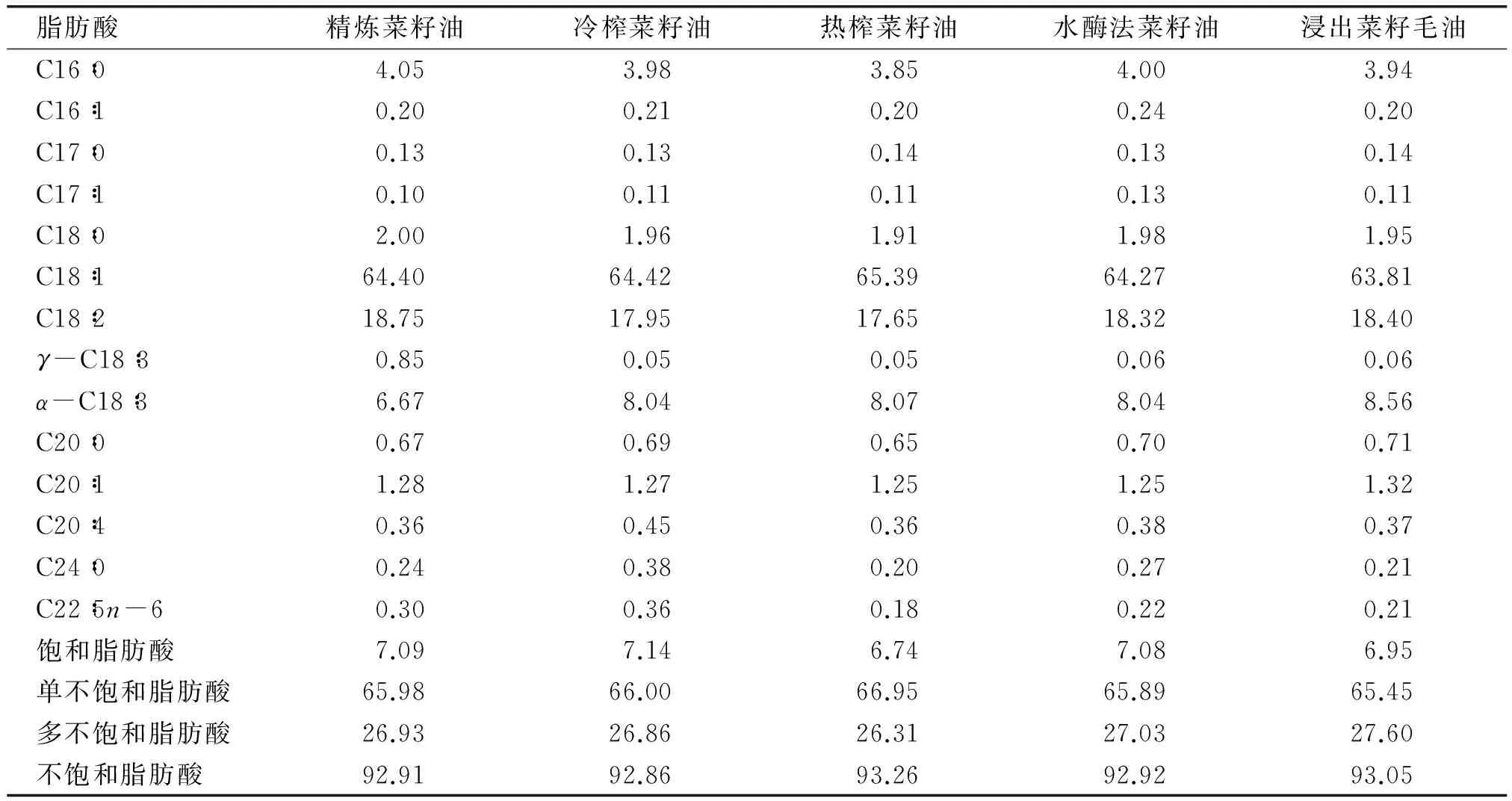
表2 不同制油工艺对菜籽油脂肪酸组成的影响 %
从表2可以看出,其脂肪酸组成中油酸(C18∶1)、亚油酸(C18∶2)含量较高。菜籽油经过5种不同制油工艺后,其主要脂肪酸组成并无显著变化,可见制油工艺对于菜籽油的主要脂肪酸组成并无显著影响。然而,精炼菜籽油中的γ-亚麻酸(γ-C18∶3)升高是高温精炼导致的不饱和脂肪酸的异构化,这种转化导致ω-3不饱和脂肪酸的降低和ω-6不饱和脂肪酸升高,降低油脂的营养价值[11]。
2.3 菜籽油甘三酯组成分析
参照AOCS Ce 5b-89方法和OPO甘三酯标准品,对菜籽油的甘三酯组成进行分析,其结果如表3所示。从表3可以看出,本实验所制得菜籽油的甘三酯主要以OOO、LOO和OOLn为主。5种不同制油工艺所得的菜籽油甘三酯组成基本相似,表明制油工艺对菜籽油的甘三酯组成无明显影响。但相比而言,精炼菜籽油中的OOLn、LLL、LOO等的含量变化可能是精炼过程中高温使得油酸和亚麻酸氧化、异构化或酯交换造成的[11]。

表3 不同制油工艺对菜籽油甘三酯组成的影响 %
注:P为棕榈酸,O为油酸,L为亚油酸,Ln为亚麻酸。
2.4 不同制油工艺对菜籽油微量成分的影响
2.4.1 生育酚含量分析
生育酚作为抗氧化剂,能够淬灭单线态的氧,是菜籽油微量物质的重要组成成分。不同制油工艺所得菜籽油中生育酚含量如表4所示。从表4可以看出,冷榨法和水酶法制得的菜籽油生育酚含量较高,热榨菜籽油较冷榨法和水酶法菜籽油生育酚含量分别降低6.22%和10.21%。虽然浸出菜籽毛油中生育酚含量最高,达833.74 mg/kg,但经过精炼,其含量仅为500.96 mg/kg,较浸出菜籽毛油降低40%。这是因为生育酚是热敏感性物质,油脂精炼过程和热榨过程中的高温处理会破坏生育酚[12]。

表4 不同制油工艺对菜籽油生育酚含量的影响 mg/kg
注:ND表示未检出。
2.4.2 甾醇含量分析
不同制油工艺制得菜籽油中甾醇含量如图1所示。从图1可以看出,不同制油工艺制得的菜籽油中的甾醇种类一致,均含有菜籽甾醇、菜油甾醇和β-谷甾醇;但不同制油工艺对菜籽油中植物甾醇含量有一定影响,其中浸出法制得的菜籽毛油中总甾醇含量最高,达到6 607.35 mg/kg,较其他方式高出10%左右,而其他制油方式的菜籽油甾醇含量差异不大。由于甾醇为脂溶性物质,在浸出的过程中能溶于正己烷而和油一同浸出,从而使得浸出菜籽毛油中甾醇含量升高[13]。

图1 不同制油工艺制得菜籽油中甾醇含量
2.4.3β-胡萝卜素含量分析
胡萝卜素是重要的营养成分,其含量影响油的营养价值。胡萝卜素的3种异构体α、β、γ都存在于油脂中,其中以β-胡萝卜素为主[14]。图2为不同制油工艺制得菜籽油中β-胡萝卜素的含量。
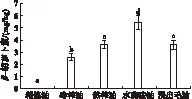
图2 不同制油工艺制得菜籽油中β-胡萝卜素含量
从图2可以看出,水酶法制得的菜籽油β-胡萝卜素含量最高,达到了5.40 mg/kg,这是因为水酶法中酶对细胞壁的破坏,促进β-胡萝卜素释放[15]。而热榨菜籽油和浸出菜籽毛油的β-胡萝卜素含量两者没有显著差异,但相对冷榨菜籽油要高。精炼菜籽油中未检测到β-胡萝卜素, 表明精炼过程中脱色工艺去除了浸出菜籽毛油中的β-胡萝卜素。
2.4.4 植物多酚含量分析
植物多酚富含酚羟基,可以提供活泼氢,使自由基灭活,本身被氧化成具有较高稳定性的氧自由基[16-17],起到抗氧化的作用。植物多酚含量的多少影响食用油的品质和营养价值。不同制油工艺制得菜籽油中多酚含量如图3所示。
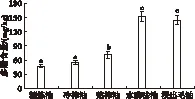
图3 不同制油工艺制得菜籽油中多酚含量
从图3可以看出,不同制油工艺对菜籽油中多酚含量的影响是显著的,其中以水酶法和正己烷浸出法制得的菜籽油的多酚含量最高。水酶法可达152.08 mg/kg。这一结果与Latif[18]、Vierhuis[19]等报道的水酶法菜籽油中多酚含量一致。原因可能是水酶法中果胶酶、纤维素酶和蛋白酶的加入减少了多酚与高分子多糖和蛋白质的络合,促进多酚释放。冷榨法和热榨法得到的菜籽油总酚含量相对较少,这可能是物理压榨仅能够提取出游离的多酚。浸出法正己烷辅助多酚的浸出,使菜籽油中的多酚含量达144.77 mg/kg。但精炼所得的菜籽油的多酚含量最少,只有47 mg/kg,这可能是因为精炼过程中碱能与酚类的酚羟基结合,再者精炼过程中的高温会氧化酚羟基进一步导致多酚的损失。
2.5 不同制油工艺制得菜籽油氧化稳定性评价
2.5.1 Rancimat加速氧化
采用Rancimat法测定油脂样品的氧化诱导时间(OSI)来评价菜籽油的氧化稳定性。OSI的大小表征油脂自动氧化变质的敏感程度,即油脂抵御自动氧化的能力,反映了油脂的耐贮性[20-21]。结果如表5所示。

表5 5种菜籽油OSI比较
从表5可以看出,制油工艺对菜籽油的氧化稳定性有显著的影响。其中,水酶法所得菜籽油的OSI最长,冷榨法和热榨法菜籽油的OSI仅为水酶法的1/2;精炼菜籽油的OSI是最短的,远小于其他4种。这一结果与油脂中的微量成分含量(β-胡萝卜素、植物多酚类等)结果是一致的。油脂氧化稳定性取决于本身的化学性质和所含的化学成分。不同制油工艺制得菜籽油的化学组成是一致的,油脂中的微量成分含量将起决定性作用。水酶法制得的菜籽油由于β-胡萝卜素、植物多酚类等微量成分含量高于其他4种的。再者,水酶法菜籽油中可能含有其他的抗氧化活性成分,使其具有很强的氧化稳定性。
2.5.2 DPPH自由基清除能力
以DPPH自由基清除能力(IC50)来评价菜籽油的抗氧化性[10]。IC50越小则表明其自由基的清除能力越强。5种菜籽油的DPPH自由基清除率如表6所示。

表6 5种菜籽油的DPPH自由基清除率比较
从表6可以看出,不同制油工艺制得菜籽油的DPPH自由基清除能力(IC50)强弱顺序为水酶法油>浸出毛油>热榨油>冷榨油>精炼油。以DPPH自由基清除能力与OSI体现的抗氧化效果而言,水酶法菜籽油最强和精炼菜籽油最弱是一致。
2.6 相关性分析
不同制油工艺制得菜籽油的氧化稳定性和抗氧化能力与其微量成分以SPSS进行相关性分析。结果如表7所示。从表7可以看出,植物多酚含量和β-胡萝卜素的含量与OSI和DPPH自由基清除能力呈显著强正相关性(r>0.9,P<0.05)。尤其植物多酚对菜籽油的氧化稳定性影响最为突出。

表7 微量成分与OSI和IC50的相关性分析
3 结 论
不同制油工艺对菜籽油的酸值和过氧化值有一定的影响,对菜籽油的脂肪酸和甘三酯组成无显著性影响;对菜籽油微量成分的影响较大,水酶法制得菜籽油的微量成分β-胡萝卜素、植物多酚等含量最高,浸出菜籽毛油经过精炼所得菜籽油的微量成分最少;菜籽油中的微量成分(植物多酚、β-胡萝卜素含量)与油脂氧化稳定性呈显著正相关,不同制油工艺制得的菜籽油的氧化稳定性不同,其中以水酶法制得菜籽油的氧化稳定性最强,而精炼菜籽油的氧化稳定性最弱。
[1] 李宁. 不同方法提取茶籽油的工艺对比研究[J]. 粮食与食品工业, 2013(1): 11-13.
[2] 聂明, 杨水平, 姚小华, 等. 不同制油工艺对油茶籽油理化性质及营养成分的影响[J]. 林业科学研究, 2010 (2): 165-169.
[3] 王兴国.油料科学原理[M].北京:中国轻工业出版社, 2011.
[4] ROSENTHAL A, PYLE D L, NIRANJAN K. Aqueous and enzymatic processes for edible oil extraction[J]. Enzyme Microb Technol, 1996, 19(6): 402-420.
[5] ATTORRI L, DI BIASE A, DI BENEDETTO R, et al. Micronutrient-enriched rapeseed oils reduce cardiovascular disease risk factors in rats fed a high-fat diet[J]. Atherosclerosis, 2010, 213(2): 422-428.
[6] RANALLI A, CABRAS P, IANNUCCI E, et al. Lipochro-mes, vitamins, aromas and other components of virgin olive oil are affected by processing technology[J]. Food Chem, 2001, 73(4): 445-451.
[7] 朱晋萱, 朱跃进, 刘国艳, 等. 13 个省茶叶籽油脂肪伴随物分析[J]. 中国油脂, 2013, 38(1): 84-88.
[8] 李志晓, 金青哲, 叶小飞, 等. 制油工艺对油茶籽油品质的影响[J]. 中国油脂, 2015,40(4): 47-51.
[10] MISHRA K, OJHA H, CHAUDHURY N K. Estimation of antiradical properties of antioxidants using DPPH assay: a critical review and results[J]. Food Chem, 2012, 130(4): 1036-1043.
[11] CHAN H W S, PRESCOTT F A A, SWOBODA P A T. Thermal decomposition of individual positional isomers of methyl linoleate hydroperoxide: evidence of carbon-oxygen bond scission[J]. J Am Oil Chem Soc, 1976, 53(9): 572-576.
[12] 王霞, 金青哲, 王兴国. 大豆油精炼过程中生育酚的损失[J]. 中国油脂, 2009, 34 (7): 4-7.
[13] BRUFAU G, CANELA M A, RAFECAS M. Phytosterols: physiologic and metabolic aspects related to cholesterol-lowering properties[J]. Nutr Res, 2008, 28(4): 217-225.
[14] 李福枝, 刘飞, 曾晓希, 等. 天然类胡萝卜素的研究进展[J]. 食品工业科技, 2007, 28(9): 227-232.
[15] 车振明, 朱秀灵, 万国福, 等. 酶法提高胡萝卜汁中β-胡萝卜素含量[J]. 食品与发酵工业, 2005, 31(4): 77-80.
[17] SOOBRATTEE M A, NEERGHEEN V S, LUXIMON-RAMMA A, et al. Phenolics as potential antioxidant therapeutic agents: mechanism and actions[J]. Mutat Res-Fund Mol M, 2005, 579(1): 200-213.
[18] LATIF S, ANWAR F. Effect of aqueous enzymatic processes on sunflower oil quality[J]. J Am Oil Chem Soc, 2009, 86(4): 393-400.
[19] VIERHUIS E, SERVILI M, BALDIOLI M, et al. Effect of enzyme treatment during mechanical extraction of olive oil on phenolic compounds and polysaccharides[J]. J Agric Food Chem, 2001, 49(3): 1218-1223.
[20] FARHOOSH R. The effect of operational parameters of the Rancimat method on the determination of the oxidative stability measures and shelf-life prediction of soybean oil[J]. J Am Oil Chem Soc, 2007, 84(3): 205-209.
[21] 王宪青, 余善鸣, 刘妍妍. 油脂的氧化稳定性与抗氧化剂[J]. 肉类研究, 2003(3): 18-20.
Impact of oil extraction processes on trace components content and oxidative stability of rapeseed oil
ZHANG Liang1, LI Shigang2, CAO Peirang1, JIANG Jiang1,LI Jinwei1, LIU Yuanfa1
(1.School of Food Science and Technology, Jiangnan University, Wuxi 214122,Jiangsu,China;2.Biology Department, Heze College, Heze 274015,Shandong,China)
The acid values, peroxide values, compositions of fatty acid and triglyceride and trace components of rapeseed oils prepared by different extraction processes were comparatively studied. The results showed that there was no obvious effect of extraction process on compositions of fatty acid and triglyceride of rapeseed oil. The acid value of aqueous enzymatic extracted rapeseed oil was relatively higher (0.995 mgKOH/g), but the oil was rich inβ-carotene and polyphenol with contents of 5.40 mg/kg and152.08 mg/kg, respectively. The hexane extracted rapeseed oil had high contents of tocopherol and plant sterol, which were 833.74 mg/kg and 6 607.35 mg/kg,respectively. The acid value of refined rapeseed oil was the lowest, only 0.233 mgKOH/g, while the content of trace components was relatively lower. The oxidative stabilities of rapeseed oils prepared by different extraction processes were evaluated with oxidative induction time and scavenging capacity on DPPH free radical as indexes. The results showed that the oxidative stability of aqueous enzymatic extracted rapeseed oil was the stongest, refined rapeseed oil was the weakest, hexane extracted rapeseed oil, hot pressed rapeseed oil and cold pressed rapeseed oil were in middle. These properties were significantly related to contents of polyphenol andβ-carotene in different processed rapeseed oils.
extraction process; rapeseed oil; trace component; oxidative stability; aqueous enzymatic method; polyphenol
2015-12-27;
2016-09-27
粮食公益性行业科研专项(201313011-7-3);863项目(2013AA102103);国家重点研发计划项目(2016YFD0401404);国家自然基金(31171703,31671786)
张 亮(1991),男,硕士研究生,主要从事油脂营养及加工的研究工作(E-mail)jiangnanzhangl@126.com。
刘元法,教授,博士生导师(E-mail)foodscilyf@163.com。
TS224;TQ646
A
1003-7969(2017)02-0001-06
