65例次万古霉素血药浓度监测分析
2017-05-15林良沫黄春新韩方璇海南省人民医院药学部海南海口570311
林良沫,黄春新,韩方璇(海南省人民医院药学部,海南 海口 570311)
65例次万古霉素血药浓度监测分析
林良沫,黄春新,韩方璇(海南省人民医院药学部,海南 海口 570311)
目的:通过对万古霉素血药浓度监测数据的分析,探讨血药浓度监测对优化治疗方案的作用。方法:回顾性分析2014年10月 – 2016年2月在我院进行万古霉素血药浓度监测的患者,对患者的一般资料、血药浓度监测结果、肾毒性等进行统计分析。结果:万古霉素平均血药浓度(17.49 ± 9.81)mg·L-1,处于有效浓度范围内的占41.54%。当患者肌酐清除率≥110 mL·min-1·1.73 m-2时,按常规剂量给药其平均血药浓度(7.47 ± 3.32)mg·L-1,难以达到有效治疗浓度。血药浓度的升高增加肾毒性的发生风险。结论:万古霉素血药浓度监测在优化治疗方案中发挥重要作用。
万古霉素;血药浓度监测;肌酐清除率;肾毒性
万古霉素为三环糖肽类抗生素,具有强大的抗革兰阳性球菌,尤其是耐甲氧西林金黄色葡萄球菌(MRSA)的作用。其个体差异大,具有潜在的耳、肾毒性,且药物浓度与疗效相关性好,血药浓度监测能及时指导临床调整给药方案规避不良反应风险。笔者回顾性分析2014年10月 – 2016年2月我院万古霉素血药浓度监测情况并进行分析,旨为临床合理用药提供参考。
1 材料和方法
1.1 病例资料
收集2014年10月 – 2016年2月期间在我院进行万古霉素血药浓度监测的患者资料。排除年龄小于18岁的儿科患者;排除取样不正确的标本(包括用药不足3剂取样和药物静脉滴注过程中取样的标本);排除停药复查的标本。
1.2 评判标准
参考《万古霉素临床应用中国专家共识(2011版)》[1],万古霉素血药谷浓度应控制在10 ~ 20 mg·L-1。治疗MRSA引起的复杂感染如菌血症、心内膜炎、骨髓炎、脑膜炎和医院获得性肺炎时,万古霉素血药谷浓度应维持在15 ~ 20 mg·L-1[2]。参考2012年改善全球肾脏病预后组织(KDIGO)发布的相关指南[3],满足以下3项中的任何一项即可认为该患者在使用万古霉素期间发生了急性肾损伤:1)在48 h内血清肌酐(Scr)上升≥0.3 mg·dl-1(≥26.5 μmol·L-1);2)已知或假定肾功能损害发生在7 d之内,Scr上升至≥基础值的1.5倍;3)尿量<0.5 mL·kg-1·h-1。
1.3 血样采集
谷浓度采血时间为第4剂或第5剂给药前30 min[1],峰浓度采血时间为给药结束后30 min。本研究纳入的患者均监测万古霉素血药谷浓度。采用西门子Viva-E血药浓度分析仪和西门子万古霉素检测试剂盒,以酶放大免疫测定法检测。质控品由伯乐生物试剂公司提供,检测时维持稳定的仪器运行环境并保证质控合格。
1.4 统计学方法
应用SPSS19.0软件对数据进行分析,主要分析方法有描述性分析、独立样本t检验分析等。计量数据以均值±标准差表示,t检验以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
共纳入40例患者,男性26人,监测38例次;女性14人,监测27例次。年龄最小者18岁,最大者93岁,平均年龄58.3岁,中位年龄61.5岁,大于60岁的老年患者20例,占50%。其中24例在重症医学科,10例在呼吸内科,其它还有传染科、烧伤科等。感染部位为:单纯肺部感染14例,肺部合并腹腔、血流等其它感染12例,皮肤软组织感染7例,腹腔感染3例,颅内感染1例,脓毒血症1例,关节感染1例。
2.2 病原学检查
每例使用万古霉素的患者都在用药前和用药期间采取痰、血、分泌物等标本送检,其中有10例未检出致病菌,13例检出1种致病菌,其余检出多种致病菌,检出率75%。检出金黄色葡萄球菌7例,其中3例为耐甲氧西林金黄色葡萄球菌(MRSA),屎肠球菌6例,粪肠球菌3例,溶血性葡萄球菌2例。多数患者存在阳性菌和阴性菌混合感染,阴性菌检出率由高至低依次为肺炎克雷伯杆菌、鲍曼不动杆菌、铜绿假单胞菌和大肠埃希菌。
2.3 联合用药情况
40例患者中仅3例单独使用万古霉素(不包括抗真菌药物),其余都联合1种或2种其它抗菌药物,主要有联用美罗培南14例,亚胺培南11例,头孢哌酮舒巴坦8例。
2.4 用法用量及疗程
多数患者按照相关共识或万古霉素说明书推荐的用法用量,最大日剂量3 g,最大单次剂量1 g,给药频次以q 12 h和q 8 h为主。给药天数最少的为3 d,最多为54 d,平均给药天数(14.88 ± 10.30)d。
2.5 血药浓度监测情况
40例患者共监测万古霉素血药谷浓度65例次,平均血药浓度(17.49±9.81) mg·L-1,最大值48.5 mg·L-1,最小值2.9 mg·L-1。在推荐的治疗浓度范围10 ~ 20 mg·L-1内有27例次(41.54%)。
2.5.1 患者性别与平均谷浓度 男性患者和女性患者之间的谷浓度采用独立样本t检验得P= 0.430,首次谷浓度采用独立样本t检验得P= 0.527,无统计学意义。说明万古霉素血药谷浓度与患者性别没有明显相关性。详见表1。

表1 患者性别分布和平均谷浓度Tab 1 Distribution of gender and average trough concentration of patients
2.5.2 患者年龄与平均谷浓度 将患者分为小于60岁、60 ~ 80岁,大于80岁三个年龄组,再将血药浓度按<10 mg·L-1、10 ~ 20 mg·L-1、>20 mg·L-1分三个浓度范围,计算各个年龄组在不同浓度范围内的例次和构成比。同时应用SPSS的交叉列联表分析功能,对三个年龄组在三个浓度范围的分布进行双向有序卡方检验,得χ2= 6.16,P= 0.187>0.05,显示各年龄组血药浓度分布差异无统计学意义,与相关研究[4]报道结果一致。
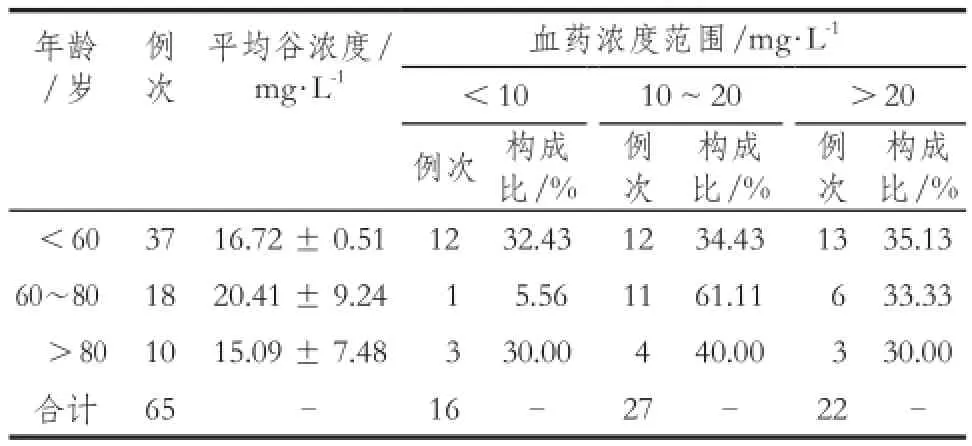
表2 各年龄组万古霉素血药浓度分布Tab 2 Distribution of the vancomycin concentration in patients of different age groups
2.5.3 患者用药前肌酐清除率(Ccr)与首次谷浓度 在监测万古霉素血药浓度的过程中,我们发现有些用药前Ccr很高的患者,在按照专家共识对Ccr≥50 mg·min-1时推荐剂量1 g,q 12 h用药[1]时,首次万古霉素血药谷浓度往往达不到10 mg·L-1。收集用药前Ccr≥110 mg·min-1的患者资料(见表3),7例患者有5例日剂量为2 g,符合专家共识的推荐,2例日剂量1.5 g,考虑与患者体重较轻相关,7例患者中只有1例的血药浓度达到目标浓度。共识中采用的是Cockcroft-Gault(C-G)公式,本文采用美国慢性肾脏病流行病合作工作组开发的CKD-EPI方程,代入年龄、性别及用药前3天内的肌酐值计算Ccr。C-G公式受患者年龄和体重影响较大,已有比较分析表明CKD-EPI公式适用人群更广,对于肾小球滤过率>60mL·min-1·1.73 m-2者也更准确[5],因此对肾功能的评价有较好的相关性和预测能力[6]。

表3 用药前高肌酐清除率的患者资料Tab 3 The information of patients with high Ccr before therapy
为了更进一步探索用药前Ccr和首次谷浓度之间的关系,我们采用两独立样本t检验,以首次谷浓度为检验变量,用药前Ccr为分析变量,得出各个Ccr范围下的平均首次谷浓度和P值。详见表4。

表4 用药前Ccr和首次谷浓度差异性Tab 4 The variability between Ccr and the first average trough concentration of patients before vancomycin therapy
由上述分析可见,以Ccr<70 mL·min-1·1.73 m-2和Ccr≥70 mL·min-1·1.73 m-2分组进行t检验得P= 0.035,表明两组间首次谷浓度具有显著性差异,但各组平均首次谷浓度都>10 mg·L-1。以Ccr<110 mL·min-1·1.73 m-2和Ccr≥110 mL·min-1·1.73 m-2分组进行t检验得P= 0.000,差异同样具有统计学意义,而且Ccr≥110 mL·min-1·1.73 m-2组平均首次谷浓度7.47 mg·L-1,<10 mg·L-1。以上分析提示我们,当患者Ccr高于110 mL·min-1·1.73 m-2时,按常规用法用量1 g,q 12 h给药时可能达不到推荐的最低有效浓度。
2.6 肾损伤发生情况
共有16例(40%)患者在使用万古霉素期间发生了肾损伤,包括新发的AKI和原有肾损伤加重。其中81.3%的患者在用药前已有肾功能不全,87.5%的患者年龄大于50岁,81.3%的患者联合使用呋塞米、托拉塞米、质子泵抑制剂、卡托普利等有肾毒性药物。万古霉素首次血药谷浓度大于20 mg·L-1的有8例,占50%,其中大于30 mg·L-1的5例。而没有发生肾损伤的患者中血药浓度大于20 mg·L-1的仅4例,占16.7%,没有大于30 mg·L-1的病例。所有5例谷浓度大于30 mg·L-1的病例资料如表5所示。

表5 首次血药浓度大于30 mg·L-1患者情况Tab 5 The information of patients with first trough concentration> 30 mg·L-1
4 讨论
很多实验和研究表明以AUC/MIC的比值作为预测万古霉素疗效的最佳参数,在体外实验中AUC/ MIC≥400被认为对MRSA感染有效。虽然万古霉素血药谷浓度是否是估算AUC的最佳选择仍有争议,但由于监测谷浓度的可操作性和与疗效、毒性的相关性,有关万古霉素的指南都强调了其重要性,并以谷浓度作为目标AUC的指代[7]。
我院绝大多数患者监测血药谷浓度,目前检出的阳性致病菌均对万古霉素敏感,MIC≤2或≤1。经分析,可见万古霉素血药浓度在不同性别和年龄之间无统计学差异,达到有效治疗浓度的比率只有41.54%,较低。这与我院目前万古霉素血药浓度监测的强度不足有关,有待提高医务人员的监测意识。由于万古霉素90%以原形由尿排除,故肾功能与万古霉素的清除直接相关。Ccr检测可反映肾小球滤过功能,在临床应用广泛。邱志宏等[8]进行的一项纳入303例患者的前瞻性实验,采用多重回归分析揭示Ccr是显示个体万古霉素清除率差异的最强因素。已有研究[7]表明肥胖、烧伤患者通常显示出较高的万古霉素清除率,而接受透析的患者Ccr则存在不稳定性,对于此类特殊患者更应严密监测万古霉素血药浓度,最好能采取持续滴注使稳态血药浓度维持在15~ 20 mg·L-1。本项研究结果显示,用药前Ccr≥110 mL·min-1·1.73 m-2的患者,首次血药谷浓度平均值只有7.47 mg·L-1,与Ccr低的患者相比差异具有统计学意义。一方面与给药剂量偏低有关,按万古霉素临床应用剂量中国专家共识,推荐的日剂量可达3 g[9]。另一方面结合特殊病例的分析提示,以110 mL·min-1·1.73 m-2为调高给药剂量的一个参考因素,同时增加给药频次(q 4 h)或持续泵入可能有助于达到目标浓度。不足之处是纳入分析人数较少,具体给药方案有待进一步验证。本项研究中有40%的患者在使用万古霉素期间发生了肾损害,相关的危险因素有高龄、原有肾功能不全、高万古霉素血药浓度和联合使用其它有肾毒性药物。其中血药浓度>30 mg·L-1的患者显示出明显的肾毒性。有研究[10]表明万古霉素谷浓度和肾毒性发生率之间具有良好的相关性,谷浓度从10 mg·L-1上升至20 mg·L-1时,肾毒性的发生率呈直线上升。共识[1]也指出发生肾功能损害患者血药谷浓度多超过30 mg·L-1。李刚等[11]分析指出万古霉素血药浓度≥15 mg·L-1和治疗时间≥14 d,是发生肾毒性的两个独立预测因素,在他们的研究中有42.9%的患者发生了肾毒性,与本研究结果相似。可见对存在肾毒性高发风险的患者,密切监测血药浓度、及时调整给药方案,避免浓度过高导致肾损害是十分必要的。
综上,万古霉素是目前抗MRSA感染的最主要药物,为了防止耐药性的产生,提高治疗效果规避不良反应风险,合理的治疗方案十分必要。方便易行的血药浓度监测在优化治疗方案中起到了关键作用,值得临床关注。
[1] 翁心华,黄仲义,陈佰义,等.万古霉素临床应用中国专家共识(2011版)[J].中国新药与临床杂志,2011,30(8):561-573.
[2] 陈春辉,李光辉,译.美国感染病学会治疗成人及儿童甲氧西林耐药金黄色葡萄球菌感染临床实践指南[J].中国感染与化疗杂志,2011,11(6):428-435.
[3] Khwaja A. KDIGO clinical practice guidelines for acute kidney injury[J]. Nephron Clin Pract, 2012, 120(4): c179-c184.
[4] 黄春燕,郭代红,朱曼.154例患者664次万古霉素血药浓度监测分析[J].中国药物应用与监测,2014,11(2):68-71.
[5] 王寅,王蓓莉.肾小球滤过率计算公式的发展和比较[J].检验医学,2015,30(7):668-673.
[6] 王汉敏,饶珺,赵妍,等.CKD-EPI开发方程在评价慢性肾脏病患者病情中的作用[J].国际检验医学杂志,2015,36(11):1515-1517.
[7] Álvarez R, López Cortés LE, Molina J. Vancomycin: Optimizing its clinical use[J]. Antimicrob Agents Chemother, 2016, 60(5): 1-37.
[8] 邱志宏,高占红,王绍志,等.心肾功能对万古霉素的清除率影响分析[J].中国医院药学杂志,2015,35(9):825-829.
[9] 万古霉素临床应用剂量专家组.万古霉素临床应用剂量中国专家共识[J].中华传染病杂志,2012,30(11):641-646.
[10] 门鹏,李慧博,翟所迪.万古霉素血药谷浓度与肾毒性相关性的验证:基于双变量模型的Meta分析[J].中国临床药理学杂志,2015,31(20):2058-2061.
[11] 李刚,朱以翠,黎庆萍.万古霉素相关肾毒性的观察及血药浓度监测的意义[J].中国生化药物杂志,2015,35(3):85-88.
Therapy drug monitoring analysis of vancomycin in 65 cases
LIN Liang-mo, HUANG Chun-xin, HAN Fang-xuan(Department of Pharmacy, Hainan Provincial People's Hospital, Haikou 570311, China)
Objective: To optimize the clinical use of vancomycin by analyzing the blood concentration of vancomycin Methods: A retrospective analysis was carried out, which involved 40 patients (65 cases) who received the monitoring of blood concentration of vancomycin from October 2014 to February 2016. We analyzed their general conditions, blood concentration, nephrotoxicity and so on. Results: The average concentration of vancomycin was (17.49 ± 9.81) mg·L-1, only 41.54% of these cases were in the effective range. When the creatinine clearance rates (Ccr) of these patients were more than 110 mL·min-1·1.73 m-2, the average blood concentration of vancomycin was only (7.47 ± 3.32) mg·L-1with the conventional dose, which was lower than the low limit of effective range. However, high concentration increased the risk of nephrotoxicity. Conclusion: The monitoring of vancomycin blood concentration was very important for optimizing the clinical use of vancomycin.
R978.1
A
1672 – 8157(2017)01 – 0023 –04
2016-07-05
2016-11-08)
黄春新,男,主任药师,研究方向:治疗药物监测、药物基因。E-mail:huangcx88@126.com
林良沫,女,药师,研究方向:治疗药物监测。E-mail:llm077@126.com
