氨磷汀对人巨核细胞白血病Dami细胞促分化作用的机制研究
2017-05-15迟小华王海英田欢欢蔡力力卢学春童卫杭解放军火箭军总医院药剂科北京00800
迟小华,王海英,杨 波,田欢欢,蔡力力,刘 萃,卢学春,童卫杭(.解放军火箭军总医院药剂科,北京 00800;
2.深圳市中医院口腔科,广州 深圳 518033;3.解放军总医院南楼血液科,北京 100853;4.解放军总医院南楼临检科,北京 100853;5.解放军总医院南楼超声科,北京 100853)
·实验研究·
氨磷汀对人巨核细胞白血病Dami细胞促分化作用的机制研究
迟小华1,王海英2,杨 波3,田欢欢1,蔡力力4,刘 萃5,卢学春3,童卫杭1(1.解放军火箭军总医院药剂科,北京 100800;
2.深圳市中医院口腔科,广州 深圳 518033;3.解放军总医院南楼血液科,北京 100853;4.解放军总医院南楼临检科,北京 100853;5.解放军总医院南楼超声科,北京 100853)
目的:探索氨磷汀对人巨核细胞白血病Dami细胞的促分化作用的机制。方法:采用氨磷汀1 mmol·L-1刺激人巨核细胞白血病Dami细胞系,共诱导12 d,利用RT-PCR及Western blot方法检测在诱导的0、4 d、8 d、12 d时巨核细胞分化相关转录因子GATA-1、NF-E2的表达变化,并通过对Dami细胞进行核质分离以及利用免疫荧光的方法研究两种转录因子在核质中的分布。结果:RT-PCR及Western blot没有检测到巨核细胞分化相关转录因子GATA-1和NF-E2表达水平升高,但入核实验结果表明转录因子NF-E2、GATA-1入核活性增加。结论:氨磷汀诱导Dami细胞向成熟巨核细胞分化是通过增加转录因子NFE2、GATA-1入核活性而发挥作用。
氨磷汀;Dami细胞;转录因子;NF-E2;GATA-1
氨磷汀(amifostine,AMF)是磷酸化的氨基硫醇,近年来在临床上广泛地被应用于癌症的辅助治疗,作为一个广谱的细胞保护剂特异性保护正常组织[1-2]。血小板减少是临床上骨髓增生异常综合征(MDS)和特发性血小板减少性紫癜(ITP)等疾病的主要症状之一。血小板由分化成熟的巨核细胞产生,巨核细胞的分化涉及多个复杂的过程,包括DNA倍体化、血小板特异性颗粒形成、分界膜系统的产生等。巨核细胞成熟及血小板释放的机制极其复杂并且至今没有被阐释清楚。本实验室之前的研究发现,AMF能诱导人巨核细胞白血病细胞Dami向成熟巨核细胞分化,并得到AMF促进Dami细胞分化的最适浓度为1 mmol·L-1[3],但其具体的机制仍未阐明。文献报道缺失转录因子NF-E2的小鼠巨核细胞成熟后期发生阻滞。缺乏造血细胞特异性亮氨酸拉链转录因子p45NF-E2的小鼠最明显的表型是巨核细胞成熟障碍、血小板严重减少。巨核细胞特异性敲除锌指结构转录因子GATA-1的小鼠巨核细胞分化阻滞、血小板严重减少。缺失NF-E2导致巨核细胞体积变大,缺失GATA-1导致未成熟的巨核细胞聚集成团[4-5]。因此本研究选择NF-E2和GATA-1两个转录因子,旨在探究AMF诱导Dami向成熟巨核细胞分化的作用机制,旨为AMF的临床应用提供更多指导。
1 材料与方法
1.1 试剂
Dami细胞系(美国ATCC公司);RPMI 1640培养基(美国Hyclone公司);氨磷汀(大连卓悦美罗有限公司药业分公司),4℃避光保存,每次使用时用RPMI 1640培养基配制成液体;兔抗人NF-E2抗体(美国Santa Cruz生物技术公司);RNA Trizol(美国Sigma公司);反转录试剂盒(北京全式金生物技术有限公司);兔抗人GATA-1抗体(美国CST公司);辣根过氧化物酶标记的羊抗兔/羊抗鼠二抗(北京中杉金桥有限公司);实时定量PCR试剂SYBR®Green Real Time PCR Master Mix(日本Takara公司);ECL化学发光检测系统(美国Cell Signaling公司)。
1.2 主要仪器设备
细胞培养箱(3111型,美国Thermo Scientific公司);超净工作台(BLLIN型,济南亚龙公司);普通PCR仪(580BR 7853型,美国BIO-RAD公司);SDSPAGE电泳仪及转膜仪(580BR 7853型,美国BIORAD公司);Real Time PCR仪(IQ5型,美国BIO-RAD公司);激光共聚焦显微镜(Ultra View型,美国Perkin Elmer公司)。
1.3 引物合成
本文所需引物及其序列如表1所示,所有引物均由北京奥科鼎盛生物科技有限公司合成。

表1 转录因子引物序列Tab 1 Primer sequences of transcription factors
1.4 细胞培养及增殖
Dami细胞在含10%加热灭活的胎牛血清、100 U·mL-1青/链霉素双抗的RPMI 1640培养基中呈悬浮生长,在37 ℃,含5% CO2饱和湿度条件下培养,细胞密度达90%时传代。
1.5 RT-PCR
在氨磷汀处理的0(Control)、4、8、12 d,分别取1×106个细胞,Trizol提取总RNA,取1 μg RNA,反转录试剂盒反转录成cDNA,使用iCycler thermocycler平台进行实时定量PCR检测,溶解温度设定在64 ℃。与管家基因(GAPDH)相比,计算目的基因相对表达水平,利用Bio-Rad iQ5-standard Edition软件分析结果。
1.6 Western Blotting
Dami细胞在氨磷汀处理的第0(Control)、4、8、12 d,收集1×106个细胞,加入适量M2 buffer 0 ℃裂解15 min,12 000 r·min-1、4 ℃离心15 min,收集上清总蛋白。提取的细胞总蛋白定量后进行SDS/PAGE跑分离胶(12%),电泳结束后将目的蛋白转移至nitrocellulose膜,5%脱脂牛奶室温封闭1 h,分别和兔抗人NF-E2、GATA-1及鼠抗人GAPDH抗体4 ℃孵育过夜,T-BST洗3次,辣根过氧化物酶(HRP)标记的羊抗兔/羊抗鼠二抗室温孵育1 h,T-BST洗3次,ECL显色系统暗室显影检测目的蛋白。
1.7 免疫荧光检测NF-E2、GATA-1入核情况
在氨磷汀处理第12天,将细胞甩片后,分别和GATA-1、NF-E2抗体室温孵育30 min,PBS冲洗3遍,4%多聚甲醛固定15 min,PBS冲洗3遍,滴加50 μg·mL-1的DAPI染液,室温避光5 min;PBS洗3遍后激光共聚焦显微镜观察,LSM Image Browser软件对图片进行处理。
1.8 统计学分析
使用SPSS19.0软件,计量资料用均数±标准差(Mean ± SEM)表示,两组之间均数比较采用t检验,P< 0.05为差异具有统计学意义。
2 结果
2.1 氨磷汀处理后Dami细胞转录因子的变化
根据本实验室前期实验结果,氨磷汀刺激Dami细胞分化的最佳药物浓度为1 mmol·L-1,处理时间为12 d[3]。巨核细胞成熟的后期阶段包括有丝分裂、细胞质成熟和前血小板形成,此过程需要各种转录因子协同作用,才能最终成熟并产生血小板。为了研究氨磷汀对转录因子表达的影响,我们通过实时定量PCR(Q-PCR)检测了GATA-1、NF-E2等转录因子mRNA的水平。与对照组相比,处理组细胞三种转录因子mRNA水平并没有明显差异(图1A,P> 0.05)。进一步检测三种转录因子蛋白水平随时间的变化,发现GATA-1、NF-E2表达量也没有明显变化(图1B)。转录因子在总量不变的情况下,其激活和失活也可以调节基因转录,进行了入核实验,分析GATA-1、NF-E2活性的变化。发现在氨磷汀处理的第12天,GATA-1、NF-E2在Dami细胞核内聚集(图1C),结果表明氨磷汀可通过增加转录因子入核来促进Dami细胞分化。
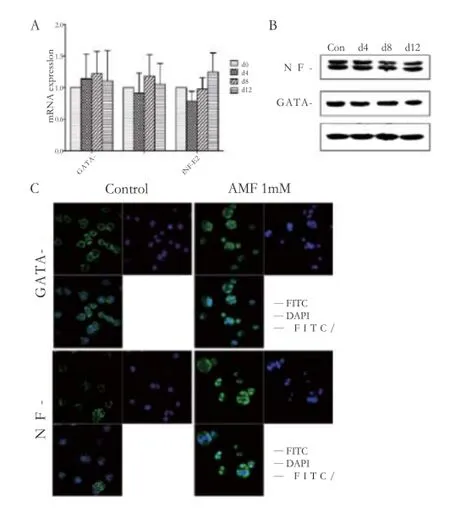
图1 氨磷汀(1 mmol·L-1)对Dami细胞分化相关转录因子GATA-1、NF-E2的影响A – mRNA水平表达的结果,B – 蛋白水平表达的结果,C – 免疫荧光结果Fig 1 The effects of amifostine exposure (1 mmol·L-1) for the indicated numbers of days on the differentiation-related transcription factors GATA-binding factor 1 (GATA-1) and nuclear factor-erythroid 2 (NF-E2) in Dami cellsA – results of mRNA expression,B – results of protein expression,C– results of immunof l uorescence
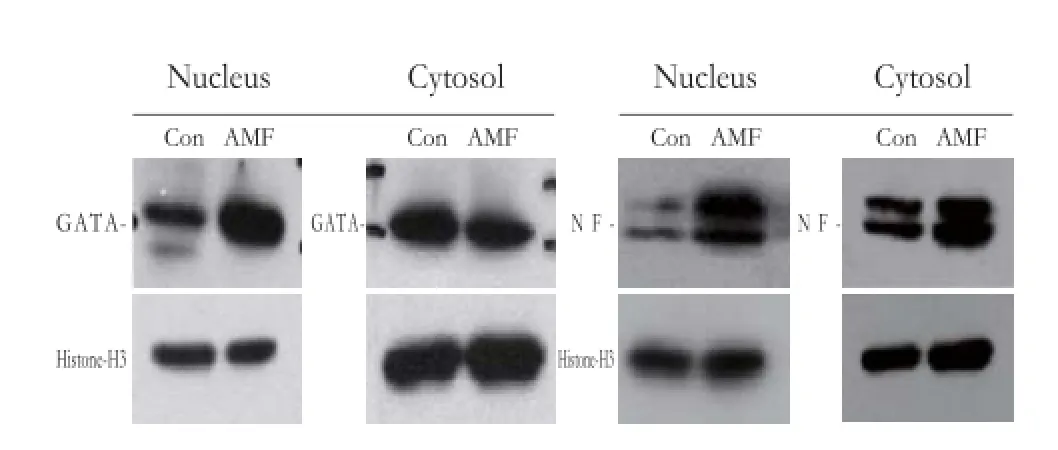
图2 Western blotting实验结果Fig 2 Results of Western blotting experiment
2.2 核质分离实验
为了进一步确定GATA-1和NF-E2的入核增加,我们随后进行了核质分离实验,核质分离后Western blotting实验结果表明对照组GATA-1和 NF-E2聚集在细胞质,而处理Dami细胞12 d后,GATA-1和NF-E2在细胞核中的聚集明显增加,细胞质中的聚集并没有明显增加,Histone-H3和GAPDH作为内参(图2)。
3 讨论
3.1 巨核细胞分化的调控
血小板产生的速率约为每日1011个,应激情况需求量增加时可增至20倍[6]。因此确保血小板的正常供应对于健康至关重要。产生血小板的巨核细胞的生长成熟调控过程极其复杂,巨核细胞在发育成熟过程中受到巨核细胞集落刺激因子(megakaryocyte colony stimulating factor,MCSF)、促血小板生成素(thrombopoietin,TPO)、IL-6、IL-11、c-Mpl配体等细胞因子的调控,MCSF主要刺激前体巨核细胞的增殖,TPO则刺激巨核细胞的成熟[7],此外c-Mpl配体是TPO相关的一个糖蛋白,在人和鼠中均可以增加血小板的数目,有文献[8-9]指出c-Mpl配体会调节巨核细胞分化的整个过程,包括核内有丝分裂和胞质成熟。因此提示氨磷汀诱导Dami细胞分化也有可能是通过c-Mpl配体起作用的。此外,HIF2α(hypoxia-inducible factor 2α)通路和VEGF(vascular endothelial growth factor)通路均参与巨核细胞的生成,铁离子浓度也影响巨核细胞的分化,缺铁会增加巨核细胞分化和前血小板形成,在缺铁大鼠的巨核细胞中,HIF2α蛋白表达增加,体外缺铁培养的巨核细胞上清中VEGF-A的浓度明显升高,提示HIF2α蛋白和VEGF-A在巨核细胞成熟过程中具有潜在作用[10]。本研究结果表明转录因子NF-E2、GATA-1在巨核细胞分化中发挥重要功能,在转录水平阐释了巨核细胞分化的机制。
3.2 氨磷汀的新见解
AMF在人表皮成纤维细胞中能够保护细胞不受放化疗药物的损伤并且促进断裂DNA双链的修复,而在乳腺癌MCF7细胞中却会阻抑DNA的修复[11],但它选择性抑制断裂DNA修复的具体机制还有待研究。这种两面性使AMF成为目前临床批准使用的唯一一个符合杀死肿瘤细胞而不损伤正常组织的标准的放射防护剂[12-13]。AMF还能够预防铂类化疗药物引起的儿童听力减退[14-16]。乳腺切除的女性使用AMF能够保护扩张的软组织免受辐射诱导的病理性血管增生,保持血管数量接近正常组织,并显著减少并发症[1],但它诱导细胞分化作用最近才被发现,其作用机理更是鲜有报道。本实验室发现AMF诱导Dami细胞向巨核细胞分化的作用后进一步探究了这一过程的发生机制,AMF诱导Dami细胞向成熟巨核细胞分化是通过增加转录因子NF-E2、GATA-1入核活性而发挥作用,使得人们过往对于AMF的认识有了一个全新的见解,也扩大了该药物的临床应用范围。
3.3 GATA-1、Fli-1、NF-E2等转录因子在巨核细胞分化过程中的作用
氟波酯(PMA)和TPO能诱导K562细胞[7]和Dami细胞[17]向巨核细胞分化,在诱导Dami分化过程中,GATA-1、Fli-1、NF-E2等转录因子蛋白表达水平升高。其中Fli-1对巨核细胞有丝分裂及细胞质成熟起作用,NF-E2(包括两个剪切体aNF-E2和fNF-E2)对前血小板形成起作用,而GATA-1对上述三个过程均有重要作用[16-19]。我们最初推测AMF增加上述转录因子表达来促进Dami细胞分化,但Q-PCR和Western blot未见GATA-1、Fli-1、NF-E2表达水平增高。我们用入核实验检测了转录因子GATA-1和NF-E2的活性,发现AMF能激活GATA-1和NF-E2入核。这说明AMF通过改变转录因子的活性而不是表达量来诱导Dami细胞分化,即AMF能直接或者间接激活转录因子,这一发现有助于全面理解AMF的生物学功能。
综上所述,本研究结果表明AMF能诱导Dami细胞分化,并发现AMF诱导Dami细胞的分化作用和转录因子GATA-1和NF-E2的活性相关,这些结果扩展了我们对于血小板减少症的认识,从而对MDS和ITP等存在巨核细胞分化障碍的疾病治疗提供指导。但因为有研究者发现少量的AMF能成功进入肿瘤细胞[11],所以AMF发挥作用的是它本身还是其活性代谢物WR-1065仍有待确定。AMF促进巨核细胞分化的作用机制还需要在更多的细胞系及动物模型体内研究加以证实。新的分子遗传学、基因组学和其他方法的迅速发展为药物机制的进一步研究提供了新的方向。
[1] Polyatskaya Y, Nelson NS, Rodriguez JJ,et al. Prophylactic amifostine prevents a pathologic vascular response in a murine model of expander-based breast reconstruction[J]. J Plast Reconstr Aesthet Surg, 2015, 69(2): 234-240.
[2] Lawrence YR, Paulus R, Langer C,et al. The addition of amifostine to carboplatin and paclitaxel based chemoradiation in locally advanced non-small cell lung cancer: long-term follow-up of Radiation Therapy Oncology Group (RTOG) randomized trial 9801[J]. Lung Cancer, 2013, 80(3): 298-305.
[3] 汪海涛,杨波,卢学春,等.氨磷汀对人巨核细胞白血病Dami细胞增殖及分化的影响[J].中国药理学与毒理学杂志,2016,30(7):723-727.
[4] Shivdasani RA, Rosenblatt MF, Zucker-franklin D,et al. Transcription factor NF-E2 is required for platelet formation independent of the actions of thrombopoietin/MGDF in megakaryocyte development[J]. Cell, 1995, 81(5): 695-704.
[5] Shivdasani RA, Fujiwara Y, Mcdevitt MA,et al. A lineage-selective knockout establishes the critical role of transcription factor GATA-1 in megakaryocyte growth and platelet development[J]. EMBO J, 1997, 16(13): 3965-3973.
[6] Kaushansky K. Historical review: megakaryopoiesis and thrombopoiesis[J]. Blood, 2008, 111(3): 981-986.
[7] 刘胜兵,潘魏巍,沈忠飞,等.Daxx抑制K562细胞向巨核细胞分化[J].中国病理生理杂志,2016,32(6):1004-1010.
[8] de Sauvage FJ, Hass PE, Spencer SD,et al. Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand[J]. Nature, 1994, 369(6481): 533-538.
[9] Lok S, Kaushansky K, Holly RD,et al. Cloning and expression of murine thrombopoietin cDNA and stimulation of platelet production in vivo[J]. Nature, 1994, 369(6481): 565-568.
[10] Jimenez K, Khare V, Evstatiev R,et al. Increased expression of HIF2α during iron deficiency-associated megakaryocytic differentiation[J]. J Thromb Haemost, 2015, 13(6): 1113-1127.
[11] Hofer M, Falk M, Komůrková D,et al. Two new faces of amifostine: protector from DNA damage in normal cells and inhibitor of DNA repair in cancer cells[J]. J Med Chem, 2016, 59(7): 3003-3017.
[12] Grochova D, Smardova J. The antimutagenic and cytoprotective effects of amifostine: the role of p53[J]. J Appl Biomed, 2007, 5: 171-178.
[13] Seed TM, Inal CE, Singh VK. Radioprotection of hematopoietic progenitors by low dose amifostine prophylaxis[J]. Int J Radiat Biol, 2014, 90(7): 594-604.
[14] Gurney JG, Bass JK, Onar-Thomas A,et al. Evaluation of amifostine for protection against cisplatin-induced serious hearing loss in children treated for average-risk or high-risk medulloblastoma[J]. Neuro Oncol, 2014, 16(6): 848-855.
[15] Lev PR, Goette NP, Glembotsky AC,et al. Production of functional platelet-like particles by the megakaryoblastic DAMI cell line provides a model for platelet biogenesis[J]. Platelets, 2011, 22(1): 28-38.
[16] Szalai G, Larue AC, Watson DK. Molecular mechanisms of megakaryopoiesis[J]. Cell Mol Life Sci, 2006, 63(21): 2460-2476.
[17] Tijssen MR, Ghevaert C. Transcription factors in late megakaryopoiesis and related platelet disorders[J]. J Thromb Haemost, 2013, 11(4): 593-604.
[18] Muntean AG, Pang L, Poncz M,et al. Cyclin D-Cdk4 is regulated by GATA-1 and required for megakaryocyte growth and polyploidization[J]. Blood, 2007, 109(12): 5199-5207.
[19] Lecine P, Villeval JL, Vyas P,et al. Mice lacking transcription factor NF-E2 provide in vivo validation of the proplatelet model of thrombocytopoiesis and show a platelet production defect that is
Mechanism research of amifostine on inducing the differentiation of human megakaryoblastic leukemia Dami cell line
CHI Xiao-hua1, WANG Hai-ying2, YANG Bo3, TIAN Huan-huan1, CAI Li-li4, LIU Cui5, LU Xue-chun3, TONG Wei-hang1
(1. Department of Pharmacy, General Hospital of Chinese PLA Rocket Force, Beijing 100800, China; 2. Department of Stomatology, Shenzhen Hospital of TCM, Shenzhen 518033, China; 3. Department of Nanlou Hematology, Chinese PLA General Hospital, Beijing 100853, China; 4. Department of Nanlou Clinical Laboratory, Chinese PLA General Hospital, Beijing 100853, China; 5. Department of Nanlou Ultrasonics, Chinese PLA General Hospital, Beijing 100853, China)
Objective: To explore the mechanism of amifostine on inducing the differentiation of human megakaryoblastic leukemia Dami cell line. Methods: The human megakaryoblastic leukemia Dami cell line were exposed to amifostine (1 mmol·L-1) for 12 days. At different time points (0、4 d、8 d、12 d), the expression of megakaryocytic differentiation-associated transcription factors such as GATA-binding factor 1 (GATA-1) and nuclear factor erythroid 2 (NF-E2) were detected by RT-PCR and Western blot. Then in order to measure the distribution of the two transcription factors in nucleoplasm, nuclear and cytoplasmic were isolated, and immunofluorescence was used. Results: There was no elevation on the mRNA or protein levels of megakaryocytic differentiationassociated transcription factors GATA-1 and NF-E2 by RT-PCR and Western blot, but nuclear import assay revealed an increased nuclear translocation activity of GATA-1 and NF-E2. Conclusion: Amifostine induced the differentiation of Dami cells into mature megakaryocytes via the mechanism involving increased nuclear translocation activity of the transcription factors GATA-1 and NF-E2.
R979.1
A
1672 – 8157(2017)01 – 0019 –04
国家自然科学基金项目(81302801,81273597);解放军总医院科技创新苗圃基金项目(15KMM21);解放军总医院临床科研扶持基金项目(2016FC-ZHCG-1004)
童卫杭,男,主任药师,研究方向:临床药理学。E-mail:chixiaohua93@126.com
迟小华,女,副主任药师,研究方向:临床药理学。E-mail:yangsongru312@163.com
