脱髓鞘假瘤五例临床分析
2017-05-15谷芙蓉阎晓玲徐小林
谷芙蓉 阎晓玲 秦 洁 徐小林
脱髓鞘假瘤五例临床分析
谷芙蓉 阎晓玲 秦 洁 徐小林
目的回顾分析5例经病理学证实的脱髓鞘假瘤患者的临床表现、影像学和病理学特点、治疗及预后。方法与结果共5例经术后病理学证实的脱髓鞘假瘤患者,均为男性,临床主要表现为肢体无力(3例),头晕和记忆力减退(2例),癫痫发作(1例);头部MRI显示占位效应,呈T1 WI低信号、T2 WI和FLAIR成像高信号,增强扫描病灶多呈强化征象,其中3例为开环状强化;手术全切除(4例)或部分切除(1例)病变;术后病理学提示炎性脱髓鞘改变;1例复发后死亡,4例预后较好。结论脱髓鞘假瘤是表现为占位效应的炎性脱髓鞘病变,应注意与中枢神经系统肿瘤相鉴别,以避免不必要的手术治疗和放射治疗。
脱髓鞘疾病;磁共振成像;病理学
This study was supported by Tianjin Research Program of Application Foundation and Advanced Technology(No.13JCYBJC22700).
脱髓鞘假瘤(DPT)系指在影像学上病灶直径≥2 cm的肿瘤样脱髓鞘改变[1],呈占位效应,临床常误诊为胶质瘤、中枢神经系统淋巴瘤(CNSL)等肿瘤性病变,需行组织病理学检查明确诊断。本文回顾分析天津市环湖医院2012年2月-2013年4月诊断与治疗的5例经术后病理学证实的脱髓鞘假瘤患者的临床资料,并结合文献进行复习。
临床资料
例1男性,62岁,主因间断性头痛、头晕1周,于2013年4月19日入院。患者入院前1周无明显诱因出现全头部轻度胀痛,有时伴昏沉感,间断发作,每次持续约10 min,自觉记忆力略减退,尚未影响正常生活。遂至我院门诊就诊,头部CT检查(2013年4月16日)显示,右侧侧脑室旁低密度影,呈轻度占位效应,周围未见水肿(图1a)。头部MRI显示,右侧基底节区和侧脑室旁T2WI(图1b)和扩散加权成像(DWI,图1c)高信号影;增强扫描右侧侧脑室旁病灶呈中度点片状强化,信号强度欠均匀,边界欠清晰(图1d),考虑肿瘤性病变。门诊以“疑似肿瘤性病变”收入院。患者既往高血压3年,余既往史、个人史及家族史均无特殊。入院后体格检查和实验室检查均未见明显异常。遂于2013年4月25日行病变切除术,术中可见病变位于右侧侧脑室额角旁尾状核头部附近,呈灰红色,质地柔软,血供欠丰富,无包膜,与周围脑组织界限不清。手术全切除病变,术后病理学显示,局部病变组织较多吞噬细胞浸润,Luxol快蓝(LFB)染色可见髓鞘脱失,吞噬细胞内可见LFB染色阳性的髓鞘碎片,轴索保留,伴血管周围淋巴细胞浸润,考虑炎性脱髓鞘改变(图1e)。术后肢体活动良好,头痛、头晕和记忆力减退改善。患者共住院18 d,出院后电话随访,分别于术后6和18个月出现全面性强直⁃阵挛发作(GTCS),予丙戊酸钠0.50 g/次、2次/d口服,目前有时反应稍慢,肢体活动良好。
例2男性,28岁,主因短暂性抽搐发作10 d,于2013年2月28日入院。患者入院前10 d无明显诱因于安静状态下突然自觉头晕,四肢抽搐,发作时意识不清,伴非喷射状呕吐胃内容物一次,持续约1 min后自行缓解,此后出现左侧肢体麻木症状,持续不缓解。遂至我院门诊就诊,头部MRI检查(2013年2月20日)显示,右侧额叶异常信号影,形状不规则,无明显占位效应,周围可见水肿;增强扫描病灶呈开环状强化,强化环欠完整,信号强度欠均匀(图2a),考虑肿瘤性病变可能性大,不排除脱髓鞘病变。既往史、个人史及家族史均无特殊。入院后体格检查和实验室检查均未见明显异常。遂于2013年3月4日行病变切除术,术中可见病变呈灰白色,质地坚韧,血供欠丰富,无包膜,与周围脑组织无明显粘连。手术全切除病变,术后病理学显示,病变组织内大量CD68+细胞(图2b)和泡沫细胞沉积,胞质内可见LFB染色阳性的髓鞘碎片(图2c),神经微丝蛋白(NF)染色可见轴索保留(图2d),周围胶质细胞和小血管增生,局部可见血管周围淋巴“袖套”形成,最终病理诊断为脱髓鞘假瘤。术后左侧肢体麻木症状缓解。患者共住院15 d,出院后电话随访未再出现抽搐发作,无新发症状。
例3男性,57岁,主因颅内占位性病变切除术后1个月症状进行性加重,于2013年1月31日入院。患者入院前2个月无明显诱因出现间断性头晕和昏沉感,伴轻度记忆力减退、工作效率下降,有时需提醒方能记起待办事宜,无明显头痛、肢体活动障碍。遂至我院门诊就诊,头部MRI检查(2012年12月17日)显示,右侧额叶T1WI低信号影(图3a);增强扫描病灶呈轻度斑片样强化,信号强度欠均匀(图3b),考虑颅内占位性病变,可疑胶质瘤。遂于2012年12月24日首次收入院。入院后体格检查:神志清楚,语言流利;双侧瞳孔等大、等圆,直径约为3 mm,视力、视野正常,各向眼动充分;近记忆力和计算力未见明显异常;四肢肌力5级、肌张力正常;右下腹可见造瘘口;余未见明显异常。遂于2012年12月25日行病变切除术,术中可见病变呈灰白色,质地较韧,无包膜,与周围组织无明显粘连。手术全切除病变,术后病理学显示,病变组织可见大量泡沫细胞沉积、淋巴细胞和浆细胞散在浸润及血管周围淋巴“袖套”形成,伴大量反应性增生的星形胶质细胞(图3c,3d),考虑脱髓鞘改变。术后静脉注射免疫球蛋白(IVIg)25 g/d,连续治疗5 d,左侧肢体肌力4级、右侧5级,肌张力均正常,头晕和记忆力减退无明显改善。术后1个月左侧肢体肌无力症状较前加重,需搀扶行走,左手持物不能,伴眼球活动受限,看左侧物体时需向左侧转头,遂于2013年1月31日再次入院。患者自发病以来,精神、睡眠、饮食可,大小便正常,体重无明显变化。15年前因溃疡性结肠炎行结肠和直肠切除术+回肠造瘘术,余既往史、个人史及家族史无特殊。入院后体格检查:神志清楚,语言流利;双侧瞳孔等大、等圆,直径约3 mm,左眼外展仅至中线,双眼可见水平眼震;左侧中枢性面瘫;左侧肢体肌力4-级、右侧5级,肌张力均正常;余未见明显异常。实验室检查各项指标均于正常值范围。复查头部MRI显示,右侧额叶、胼胝体、基底节区和侧脑室旁占位性病变切除术后改变,脑桥腹侧小片状异常信号影,呈T1WI低信号、T2WI高信号。颈椎MRI未见髓内异常信号。结合患者首次发作为假瘤样脱髓鞘病变,再次发作出现脑桥病灶,考虑多发性硬化(MS)。入院第4天左侧肢体症状加重,肌力3级,予以甲泼尼龙1 g/d静脉滴注,连续5 d后改为泼尼松60 mg/d口服,2周内逐渐递减直至停药。停药时左眼活动正常,左侧肢体肌力4级、右侧5级,肌张力均正常。患者住院22 d,出院后1个月随访时再次发作,四肢瘫痪,自行服用泼尼松15 mg/d,症状无明显改善,逐渐进展至卧床、排尿不能,长期留置导尿管,出院后2年死亡。

图1 头部影像学检查和病理学检查所见1a横断面CT显示右侧侧脑室旁低密度影,呈轻度占位效应(箭头所示),周围无明显水肿1b横断面T2WI显示,右侧侧脑室旁高信号影,呈轻度占位效应(箭头所示),周围无明显水肿1c横断面DWI显示,右侧侧脑室旁高信号影(箭头所示)1d横断面增强T1WI显示,右侧侧脑室旁病灶呈中度点片状强化,信号强度欠均匀(箭头所示)1e光学显微镜观察显示,大量泡沫细胞沉积,血管周围可见淋巴细胞浸润HE染色×100图2头部MRI检查和病理学检查所见2a冠状位增强T1WI显示,右侧额叶病变呈开环状强化,强化环欠完整,开口朝向皮质,信号强度欠均匀(箭头所示),周围可见水肿2b光学显微镜观察显示,病变组织内大量CD68+细胞,提示吞噬细胞免疫组织化学染色(En Vision二步法)×100 2c光学显微镜观察显示,灰质和白质髓鞘脱失,髓鞘碎片被巨噬细胞吞噬LFB染色×100 2d光学显微镜观察显示,脑组织部分轴索保留,呈NF阳性免疫组织化学染色(EnVision二步法)×100Figure 1 Head imaging and pathological findings Axial CT showed right lateral paraventricular low⁃density shadow with mild mass effect(arrow indicates),without surrounding edema(Panel 1a).Axial T2WI showed right lateral paraventricular high⁃intensity signal with mild mass effect(arrow indicates),without surrounding edema(Panel 1b).Axial DWI showed right lateral paraventricular high⁃intensity signal(arrow indicates,Panel 1c).Axial contrast⁃enhanced T1WI showed moderate heterogeneous patchy enhancement of the right lateral paraventricular lesion(arrow indicates,Panel 1d).Optical microscopy showed a large number of foam cells,and perivascular lymphocytes infiltration(Panel 1e).HE staining×100 Figure 2 Head MRI and pathological findings Coronal contrast⁃enhanced T1WI showed heterogeneous open⁃ring enhancement(the opening faced toward the cortex)of the lesion in right frontal lobe(arrow indicates),with surrounding edema(Panel 2a).Optical microscopy showed a large number of CD68+cells in the lesion,indicating macrophages(Panel 2b).Immunohistochemical staining(EnVision)×100 Optical microscopy showed demyelinating of grey matter and white matter,and the myelin debris was phagocytosed by macrophages(Panel 2c).LFB staining×100 Optical microscopy showed residual axon of brain tissue,which was positive for NF(Panel 2d).Immunohistochemical staining(EnVision)×100

图3 头部MRI检查和病理学检查所见3a矢状位T1WI(2012年12月17日)显示,右侧额叶低信号影(箭头所示)3b冠状位增强T1WI(2012年12月20日)显示,右侧额叶和侧脑室旁病灶呈斑片样强化(箭头所示)3c光学显微镜观察显示,病灶内泡沫细胞沉积,血管周围淋巴细胞浸润,伴星形胶质细胞反应性增生HE染色× 100 3d光学显微镜观察可见大量反应性增生的星形胶质细胞HE染色×400Figure 3 Head MRI and pathological findings Sagittal T1WI(December 17,2012) showed hypointense signal in right frontal lobe(arrow indicates,Panel 3a).Coronal contrast⁃enhanced T1WI(December 20,2012)showed patchy enhancement of the lesion in right frontal lobe and paraventricle(arrow indicates,Panel 3b).Optical microscopy showed foam cells deposition,perivasular lymphocytes infiltration associated with reactive astrocytosis(Panel 3c).HE staining×100 Optical microscopy showed reactive hyperplasia of astrocytes(Panel 3d).HE staining×400
例4男性,59岁,主因右侧肢体无力1个月,于2012年4月9日入院。患者1个月前无明显诱因突发右侧肢体无力、行走不稳,右手持物不稳,左侧肢体未见明显异常。遂至我院门诊就诊,头部CT检查(2012年3月15日)显示,左侧半卵圆中心低密度影,考虑脑梗死,于2012年3月15日门诊以“缺血性卒中”首次收入院。入院后体格检查:右侧肢体肌力4级、左侧5级,肌张力均正常。实验室检查:腰椎穿刺脑脊液检查压力100 mm H2O(1 mm H2O= 9.81×10⁃3k Pa,80~180 mm H2O),常规、生化和免疫学指标均于正常水平,细胞学可见大量淋巴细胞,偶见单核细胞。头部MRI检查(2012年3月16日)显示,左侧半卵圆中心DWI(图4a)和FLAIR成像(图4b)呈高信号影,信号强度欠均匀;增强扫描(2012年3月20日)病灶呈中度环形强化,外侧环壁显影欠佳,信号强度欠均匀(图4c)。临床考虑脱髓鞘假瘤。患者家属不同意组织活检术,住院13 d后出院。出院后右侧肢体肌无力症状持续不缓解,于2012年4月9日再次入院。既往高血压病史3个月,余既往史、个人史及家族史无特殊。入院第6天(发病后30 d)予以地塞米松10 mg/d静脉注射,连续5 d后减至5 mg/d,连续5 d后停用。复查头部MRI(2012年4月20日)显示,左侧半卵圆中心病灶较前略增大(图4d,4e)。遂于2013年4月26日行开颅病变探查术,术中可见病变呈灰白色,质地柔软,血供不丰富,无包膜,与周围脑组织分界不清。手术部分切除病变,术后病理学显示,脑组织少量水肿,其内可见泡沫细胞和血管周围炎性细胞浸润(图4f),病变组织胶质纤维酸性蛋白(GFAP)、NF和CD68阳性,髓鞘碱性蛋白(MBP)部分阳性,考虑脱髓鞘假瘤。术后10 d右侧肢体肌力4级、左侧5级,肌张力均正常。患者共住院25 d,出院后未予激素治疗,出院2个月后右侧肢体无力症状好转,四肢肌力5级、肌张力正常。
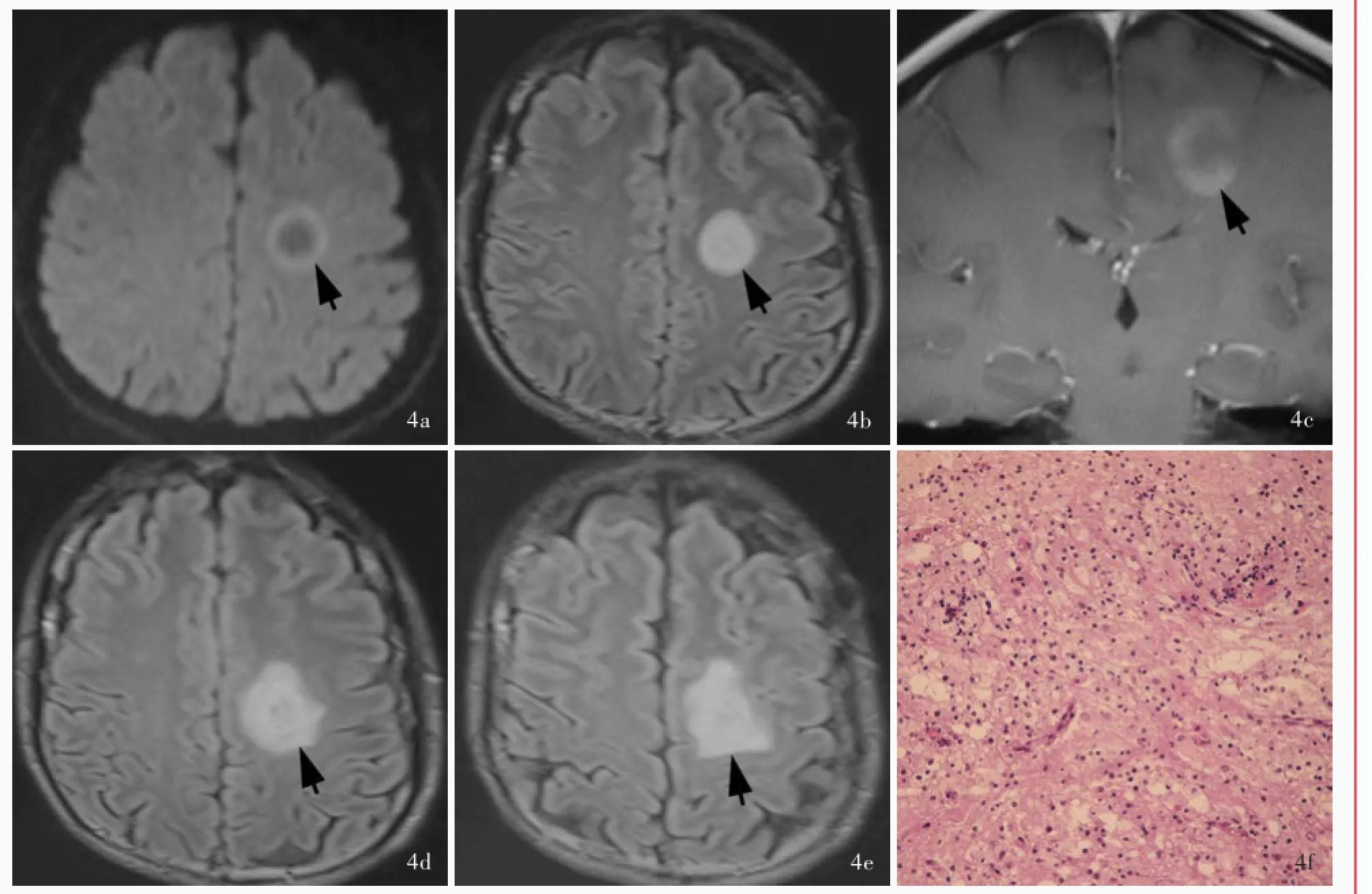
图4 头部MRI检查和病理学检查所见4a横断面DWI(2012年3月16日)显示,左侧半卵圆中心占位性病变,病变中心低信号、周围高信号(箭头所示)4b横断面FLAIR成像(2012年3月16日)显示,左侧半卵圆中心高信号影,边界清晰(箭头所示)4c冠状位增强T1WI(2012年3月20日)显示,左侧半卵圆中心呈开环状不均匀强化,开口朝向皮质(箭头所示)4d,4e横断面FLAIR成像(2012年4月20日)显示,左侧半卵圆中心高信号病变较前增大(箭头所示)4f光学显微镜观察显示脑组织水肿,可见泡沫细胞沉积和血管周围炎性细胞浸润HE染色×100Figure 4 Head MRI and pathological findings Axial DWI(March 16,2012)showed space⁃occupying lesion in left centrum semiovale with central hypointense and peripheral hyperintense signals(arrow indicates,Panel 4a).Axial FLAIR(March 16,2012)showed hyperintensity signal in left centrum semiovale with clear boundary(arrow indicates,Panel 4b).Coronal contrast⁃enhanced T1WI(March 20,2012)showed open⁃ring enhancement of left centrum semiovale and the opening faced toward the cortex(arrow indicates,Panel 4c). Axial FLAIR(April 20,2012)showed the hyperintense lesion in left centrum semiovale was larger than before(arrows indicate;Panel 4d, 4e).Optical microscopy showed brain edema,a large number of foam cells,perivascular infiltration of inflammatory cells(Panel 4f). HE staining×100
例5男性,55岁,主因右手活动不利伴麻木感2周,于2012年2月2日入院。患者入院前2周无明显诱因出现右手小指和环指麻木,并逐渐扩散至右手,同时出现右手活动不利,不能伸直,仅轻微屈曲。患者既往高血压病史2年,余既往史、个人史及家族史无特殊。入院后体格检查:右手伸展不能,仅轻微屈曲,肌力2级,左侧肢体、右上肢近端和右下肢5级,肌张力均正常。实验室检查各项指标均于正常值范围。头部MRI检查(2012年2月6日)显示,左侧额叶T2WI(图5a)和FLAIR成像(图5b)高信号影,边界欠清晰;增强扫描病灶呈轻度开环状强化。磁共振波谱(MRS)显示,左侧额叶病灶N⁃乙酰天冬氨酸(NAA)峰降低,胆碱(Cho)峰和肌酐(Cr)峰升高,病灶内显示含坏死成分的脂质峰,考虑低级别胶质瘤。于入院第6天(2012年2月8日)行病变切除术,术后病理学显示,病变组织主要由大量胞质淡染的泡沫细胞组成,其间可见灶性分布的肥胖型星形胶质细胞增生,即Creutzfeuldt细胞,伴炎性细胞浸润和血管周围淋巴“袖套”形成(图5c),考虑脱髓鞘假瘤。术后右上肢远端肌力4级,余肢体肌力5级,右手仍伸展不能。患者共住院15 d,出院后6个月时随访,右手肌无力症状有所好转,但仍持物不稳。
讨论
本组5例患者均为男性,年龄28~62岁,平均52.20岁,除例3外均为急性发病,临床表现为肢体无力、头晕和记忆力减退、癫痫发作,影像学可见病灶位于皮质和皮质下白质、脑室旁白质,CT均呈低密度,MRI上T1WI呈低信号、T2WI和FLAIR成像呈高信号、DWI呈高信号或中心低信号而周围高信号,增强扫描病灶呈斑片样或开环状不均匀强化,除例3在短期内进展为多发性硬化并于2年后死亡外,余4例均为单相病程,未予标准激素治疗,随访时间30~44个月,均未见复发,预后较好。
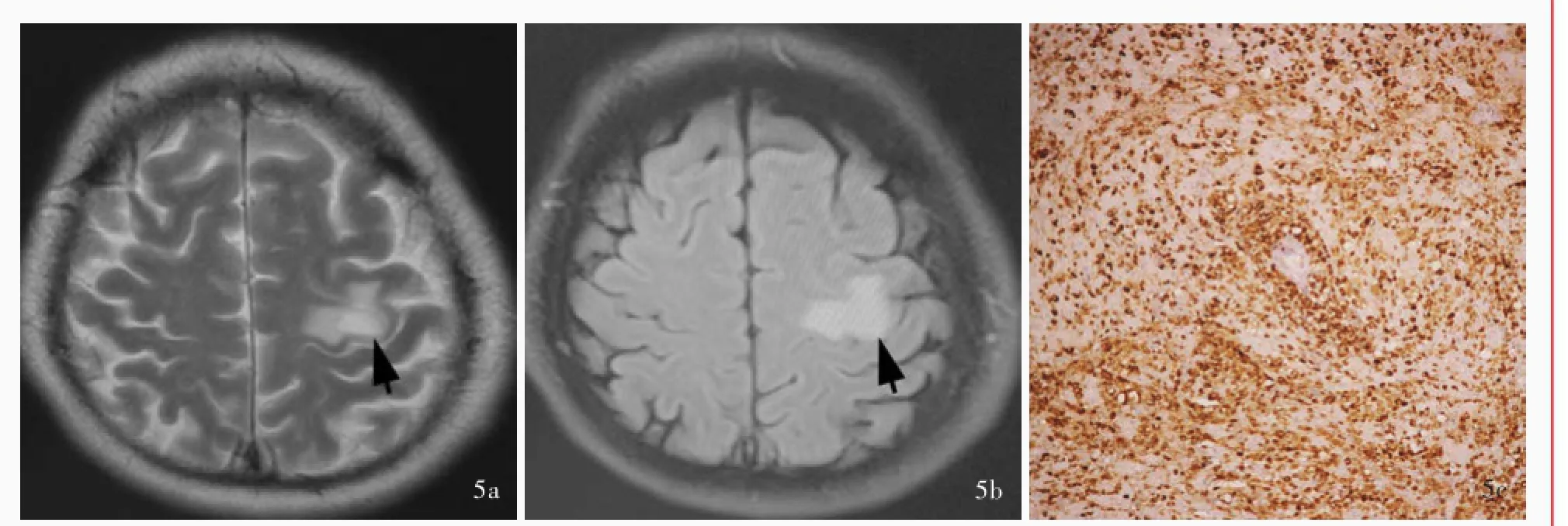
图5 头部MRI检查和病理学检查所见5a横断面T2WI显示,左侧额叶高信号影(箭头所示)5b横断面FLAIR显示,左侧额叶高信号影(箭头所示)5c光学显微镜观察可见肥胖型星形胶质细胞即Creutzfeuldt细胞,胞质GFAP阳性免疫组织化学染色(EnVision二步法)×100Figure 5 Head MRI and pathological findings Axial T2WI showed hyperintensity signal in left frontal lobe(arrow indicates,Panel 5a). Axial FLAIR showed hyperintensity signal in left frontal lobe(arrow indicates,Panel 5b).Optical microscopy showed Creutzfeuldt cells, which were positive for GFAP in cytoplasm(Panel 5c).Immunohistochemical staining(En Vision)×100
1979年,Van der velden等[2]报告,某些中枢神经系统脱髓鞘病变影像学表现以明显占位效应为特点,酷似肿瘤,而临床症状与体征相对轻微,与影像学不符。此后,多位学者相继报告类似病例,称为瘤样炎性脱髓鞘病(TIDD)、肿胀性脱髓鞘病变(TDL)和脱髓鞘假瘤等[3]。临床极易误诊为中枢神经系统肿瘤而接受不必要的手术治疗或放射治疗,严重损伤神经功能。因此,有必要提高对脱髓鞘假瘤的临床表现、影像学和病理学特点的认识,以减少误诊。
一、脱髓鞘假瘤的病因、临床表现、影像学和病理学特点
脱髓鞘假瘤认为是多发性硬化与急性播散性脑脊髓炎(ADEM)的中间型,亦认为是多发性硬化的变异型。仅少数患者发病前有受凉、发热、上呼吸道感染和腹泻等诱因,大多数患者发病前无明显诱因。发病机制目前尚不清楚,免疫介导的对髓鞘成分的攻击是主要原因[4]。发病率无明显性别差异,高峰发病年龄为20~40岁,亦可见发生于儿童和老年人的报道[5]。病变主要累及皮质下白质和脑室旁白质,皮质也可受累;幕上脱髓鞘假瘤多见于额顶叶,也可出现于脑干、小脑和脊髓;病灶可单发或多发[5]。因受累部位不同,临床表现各异,主要表现为实质性占位效应和局灶性神经功能缺损,多呈急性或亚急性发病,以运动障碍和感觉障碍常见,也可伴头痛、恶心、呕吐、癫痫发作、言语障碍、大小便失禁、认知功能障碍等。刘建国和戚晓昆[3]发现,脱髓鞘假瘤患者轻中度认知功能障碍发病率高于中枢神经系统肿瘤,可能与皮质受累或各脑区之间的联系纤维受损有关。本组5例患者除例3呈亚急性发病外,余4例均呈急性发病,临床主要表现为肢体无力、头晕和记忆力减退、癫痫发作。
影像学表现为T1WI低信号,T2WI和FLAIR成像高信号,可见占位效应和周围水肿,且水肿随时间延长而减轻或消失。急性发病者DWI呈高信号,且随时间延长信号强度逐渐降低,亦可见中心低信号、周围高信号[6];增强扫描病灶多呈强化征象,形式多样,可为团块样、斑片样、线样和环状,开口朝向皮质的开环状强化有助于诊断。究其原因,可能是血⁃脑屏障破坏和巨噬细胞浸润所致,强化信号均匀提示脱髓鞘损伤为同时发生[7],环状强化提示病灶周围炎症进展,环状结构代表脱髓鞘病变边界,开口朝向皮质、中心非强化区代表炎症慢性期[8]。Masdeu等[9]研究显示,66%的脱髓鞘假瘤急性期患者呈开环状强化,仅7%的中枢神经系统肿瘤患者呈开环状强化,提示开环状强化对脱髓鞘假瘤的诊断有较高的特异性。
组织病理学表现为血管周围淋巴“袖套”形成,不同程度髓鞘脱失,继发巨噬细胞吞噬髓鞘碎片和反应性星形胶质细胞增生,而轴索相对保留;亦可见散在分布的肥胖型星形胶质细胞,胞质丰富、多核,称为Creutzfeuldt细胞,有助于脱髓鞘假瘤的诊断。孙辰婧等[10]的研究显示,脱髓鞘假瘤不同时期,组织病理学特点各异,急性期可见大量吞噬细胞浸润,炎性细胞以淋巴细胞为主,并多见血管周围淋巴“袖套”形成,亦可见肥胖型星形胶质细胞;慢性期病灶与周围脑组织界限清晰,吞噬髓鞘的吞噬细胞数目减少,纤维型星形胶质细胞增生。
二、脱髓鞘假瘤的诊断与鉴别诊断
脱髓鞘假瘤呈颅内占位效应,临床应注意与中枢神经系统肿瘤如胶质瘤和中枢神经系统淋巴瘤、脑脓肿、颅内寄生虫感染等相鉴别。临床表现方面,脱髓鞘假瘤以急性或亚急性发病为主,胶质瘤多为慢性发病;脱髓鞘假瘤多以头痛为首发症状,早期即可出现认知功能障碍,大小便障碍和运动障碍常见[3,11],胶质瘤则表现为影像学占位效应明显、临床症状相对较轻。影像学表现方面,开环状强化多见于脱髓鞘假瘤,但并非脱髓鞘假瘤的特异性诊断标准。随着时间的推移,脱髓鞘假瘤在DWI上由高信号逐渐演变为低信号,而星形细胞瘤则由低或等信号发展为高信号[12]。CT联合增强MRI对脱髓鞘假瘤与中枢神经系统肿瘤的鉴别诊断有重要意义,MRI强化区域呈CT低密度见于93%脱髓鞘假瘤患者,仅见于4%肿瘤患者[13];CT高密度基本可以排除脱髓鞘假瘤,更支持肿瘤[11]。MRI鉴别诊断困难时可以联合MRS,Cho/NAA>1.73、Cho/Cr>2.58提示原发性中枢神经系统淋巴瘤(PCNSL)[14]。脑脓肿也可表现为颅内占位效应,MRI亦可见环状强化,但开环状强化少见,脓肿内壁光滑,且CT呈环状高密度,可资鉴别。本组5例患者中2例表现为斑片样强化,3例表现为开环状强化;CT呈低密度,DWI呈高信号或者不均匀等或高信号,均支持脱髓鞘假瘤;例5行MRS显示,Cho/NAA>1.73,Cho/Cr<2.58,结果不典型,对鉴别诊断意义不大,因此,明确诊断依靠组织病理学检查。根据髓鞘脱失而轴索相对保留,病变区域和血管周围炎性细胞浸润,大量吞噬细胞,星形胶质细胞反应性增生,亦可见肥胖型星形胶质细胞即Creutzfeuldt细胞可以明确诊断。病变不典型时应注意与以下疾病相鉴别:(1)低级别星形细胞瘤。由分化较好的肿瘤性星形胶质细胞组成,背景疏松,微囊状,细胞密度增加,核异型性少见,易与脱髓鞘假瘤混淆,后者大量吞噬细胞可资鉴别。GFAP染色有助于鉴别星形细胞瘤细胞和反应性星形胶质细胞。(2)中枢神经系统淋巴瘤。高峰发病年龄为60~70岁,男性多见,肿瘤细胞似小淋巴细胞样或组织细胞样,核分裂象多见,肿瘤细胞聚集于小血管周围,形成以血管为中心的“袖套”样特征性生长方式。淋巴瘤标志物如CD45、CD20和CD3阳性可资鉴别。(3)缺血性卒中。早期可见嗜中性粒细胞浸润,髓鞘和轴索变性,亦可见嗜伊红神经元,后期可见大量泡沫细胞沉积,伴星形胶质细胞和纤维增生。脱髓鞘假瘤主要累及白质,病变中轴索相对保留可资鉴别[15]。既往认为拟诊脱髓鞘假瘤的患者均应行组织活检术,目前认为影像学检查联合脑脊液髓鞘碱性蛋白阳性和寡克隆区带(OB)阳性可基本明确诊断,仅部分患者需行组织活检术,如既往无多发性硬化的脱髓鞘病变患者、脑脊液寡克隆区带阴性患者和较少发生脱髓鞘改变的老年或青少年患者。
三、脱髓鞘假瘤的治疗与预后
脱髓鞘假瘤是临床相对少见疾病,无法进行病例对照研究,目前的治疗原则是基于个案报道和系列病例报道的专家经验,激素可以作为一线治疗方法[5],系列病例报道显示,超过80%患者激素治疗显著有效[16];激素无效者二线治疗方法为血浆置换疗法,目前仅为个案报道:利妥昔单抗和那他珠单抗在个案报道中有效[5],环磷酰胺和静脉注射免疫球蛋白在儿童患者中可能较成人有效[17]。而多发性硬化的疾病修正治疗[DMT,如干扰素⁃β(IFN⁃β)和醋酸格拉替雷等]目前推荐用于脱髓鞘假瘤转化为多发性硬化,对于首次孤立发作的脱髓鞘假瘤,除非病情严重、功能障碍明显或其他证据提示很可能转化为多发性硬化,否则不推荐疾病修正治疗[5]。2009年推荐的肿胀性脱髓鞘病变治疗方案是:甲泼尼龙1 g/d静脉滴注,临床症状未见恶化,6~8周后复查MRI,若影像学显示激素治疗有效,继续观察,3个月后再复查MRI;若激素治疗后出现新发症状,考虑疾病修正治疗;若临床或影像学表现显示激素治疗无反应,询问患者既往血浆置换疗法后是否疾病复发,复发即予疾病修正治疗,不复发则行组织活检术确定为脱髓鞘病变后再予血浆置换疗法,有效则出现新发症状时予疾病修正治疗,无效则考虑利妥昔单抗[17]。
系列病例报道显示,脱髓鞘假瘤多表现为单相病程,少数可以转化为多发性硬化。李守华等[18]报告1例以颅内占位效应首发的脱髓鞘假瘤患者,4年后出现颅内新发病灶,首次病灶完全消失,并于再次发作5个月后出现累及颈髓的第3次发作。Yao等[19]报告17例肿胀性脱髓鞘病变患者,其中10例未予治疗,随访4.10年,12例无复发,基本完全恢复。Altintas等[16]报告29例首次发病表现为肿胀性脱髓鞘病变患者,随访38个月,19例转化为多发性硬化,10例未再发作。王起等[20]报告35例脱髓鞘假瘤患者,20例为单相病程,其中80%治疗后好转;15例为多相病程,其中10例(28.57%)发作2次,3例(8.57%)发作3次,2例(5.71%)发作4次,并且发现第2次发作距首次发作时间越短、再次复发可能性越大。不同系列病例报道单相病程和复发比例不同可能与样本量较小有关。本组例3既往有溃疡性结肠炎,提示可能存在免疫功能异常,首次发作后静脉注射免疫球蛋白,第2次发作距首次发作仅为2个月,第2次发作时予足量激素治疗,1个月后出现第3次发作,此后出现肢体瘫痪、排尿不能、长期卧床,最终死亡;余4例患者除例4予小剂量地塞米松外均未予激素治疗,预后均较好。例3头部MRI显示病灶较大,占位效应明显,增强扫描强化征象较其他4例明显;组织学形态观察,炎性细胞浸润程度较其他4例严重,提示病灶强化的特点在一定程度上反映脱髓鞘假瘤的病程和严重程度,同时部分提示发病机制为免疫功能异常,激素治疗不能预防再次发作,故目前不推荐小剂量激素长期维持。
综上所述,脱髓鞘假瘤部分为单相病程,激素治疗后可能完全缓解,应注意与中枢神经系统肿瘤相鉴别,以避免不必要的手术治疗而带来的创伤,部分患者可能接受放射治疗而引起不可逆性放射性脑病,严重影响生活质量。鉴别诊断方面,临床医师在遇到急性或亚急性起病、影像学表现为占位效应、有多种形式尤其是斑片状、环状或开环状强化的病例应考虑脱髓鞘假瘤的可能,进一步行头部MRS、脑脊液髓鞘碱性蛋白和寡克隆区带检查,必要时行激素试验性治疗或组织活检术以明确诊断,从而减少不必要的手术治疗和放射治疗损伤。
[1]Dagher AP,Smirniotopoulos J.Tumefactive demyelinating lesions.Neuroradiology,1996,38:560⁃565.
[2]Van der velden M,Bors GT,Endtz LJ.Cranial CT in multiple sclerosis showing a mass effect.Surg Neurol,1979,12:307⁃310.
[3]Liu JG,Qi XK.Tumor⁃like inflammatory demyelinating disease// Wang WZ.Demyelinating disease in nervous system.Beijing: People's Medical Publishing House,2011:345⁃356[.刘建国,戚晓昆.肿瘤样炎性脱髓鞘疾病//王维治.神经系统脱髓鞘疾病.北京:人民卫生出版社,2011:345⁃356.]
[4]Wang Y,Ma LL,Wang M.Demyelinating pseudomotor in the central nervous system.Zhonghua Shen Jing Yi Xue Za Zhi, 2009,8:964⁃966[.王英,马丽丽,王敏.中枢神经系统脱髓鞘假瘤.中华神经医学杂志,2009,8:964⁃966.]
[5]Hardy TA,Chataway J.Tumerfactive demyelination:an approach to diagnosis and management.J Neurol Neurosurg Psychiatry, 2013,84:1047⁃1053.
[6]Lucchinetti CF,Gavrilova RH,Metz I,Parisi JE,Scheithauer BW,Weigand S,Thomsen K,Mandrekar J,Altintas A,Erickson BJ,Konik F,Giannini C,Lassmann H,Linbo L,Pittock SJ,Bruck W.Clinical and radiographic spectrum of pathologically confirmed tumefactive multiple sclerosis.Brain,2008,131:1759⁃1775.
[7]Kobayashi M,Shimizu Y,Shibata N,Uchiyama S.Gadolinium enhancement patterns of tumefactive demyelinating lesions: correlations with brain biopsy findings and pathophysiology.J Neurol,2014,261:1902⁃1910.
[8]Akimoto J,Nakajima N,Saida A,Haraoka J,Kudo M.Monofocal acute inflammatory demyelination manifesting open ring sign: case report.Neurol Med Chir(Tokyo),2006,46:353⁃357.
[9]Masdeu JC,Momim J,Trasi S,VisintaIner P,Cavaliere R, Grundman M.The open ring:a new imaging sign demyelinating disease.J Neuroimaging,1996,6:104⁃107.
[10]Sun CJ,Liu JG,Gui QP,Lu DH,Qi XK.Analysis of pathological characteristics of acute and chronic cerebral tumefactive demyelinating lesions.Zhonghua Yi Xue Za Zhi,2014,94:3557⁃3561[.孙辰婧,刘建国,桂秋萍,卢德宏,戚晓昆.颅内肿瘤样脱髓鞘病病理分期特点.中华医学杂志,2014,94:3557⁃3561.]
[11]Liu JG,Qiao WY,Zheng KH,Zhao HL,Qian HR,Yao S,Duan F, Qiu F,Qi XK.Comparison of tumefactive demyelinating lesions and glioma by clinical presentations and neuroimaging studies. Zhonghua Yi Xue Za Zhi,2014,94:3047⁃3051[.刘建国,乔文颖,郑奎宏,赵虎林,钱海蓉,姚生,段枫,邱峰,戚晓昆.瘤样脱髓鞘病与胶质瘤的临床、影像对比研究.中华医学杂志,2014, 94:3047⁃3051.]
[12]Qi XK.Improve the diagnosis and differential diagnosis of tumor⁃like inflammatory demyelinating diseases.Zhonghua Shen Jing Ke Za Zhi,2010,43:3⁃6[.戚晓昆.提高对瘤样炎性脱髓鞘病的诊断及鉴别诊断水平.中华神经科杂志,2010,43:3⁃6.]
[13]Kim DS,Na DG,Kim KH,Kim J,Kim E,Yun BL,Chang KH. Distinguishing tumefactive demyelinating lesions from glioma or central nervous system lymphoma:added value of unenhanced CT compared with conventional contrast⁃enhanced MR imaging. Radiology,2009,251:467⁃475.
[14]Lu SS,Kim SJ,Kim HS,Choi CG,Lim YM,Kim EJ,Kim DY, Cho SH.Utility of proton MR spectroscopy for differentiating typical and atypical primary central nervous system lymphomas from tumefactive demyelinating lesions.AJNR Am J Neuroradiol, 2014,35:270⁃277.
[15]Lu DH,Fu YJ,Wang YJ.Pay attention to pathological diagnosis of CNS demyelinating pseudotumor.Zhonghua Bing Li Xue Za Zhi,2013,42:289⁃291[.卢德宏,付永娟,王雅杰.重视中枢神经系统脱髓鞘假瘤的病理学诊断.中华病理学杂志,2013,42: 289⁃291.]
[16]Altintas A,Petek B,Isik N,Terzi M,Bolukbasi F,Tavsanli M, Saip S,Boz C,Aydin T,Arici⁃Duz O,Ozer F,Siva A.Clinical and radiological characteristics of tumefactive demyelinating lesions: follow⁃up study.Mult Scler,2012,18:1448⁃1453.
[17]Dastgir J,DiMario FJ Jr.Acute tumefactive demyelinating lesions in a pediatric patient with known diagnosis of multiple sclerosis: review of the literature and treatment proposal.J Child Neurol, 2009,24:431⁃437.
[18]Li SH,Deng JF,Zhang XH,Long CQ.Multiple sclerosis with brain demyelinating pseudotumor as first manifestation:a case report and review of literatures.Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2014,14:60⁃63[.李守华,邓菊凤,张祥海,龙春琴.以中枢神经系统脱髓鞘性假瘤为首发表现的多发性硬化一例并文献复习.中国现代神经疾病杂志,2014,14:60⁃63.]
[19]Yao J,Huang D,Gui Q,Chen X,Lou X,Wu L,Cheng C,Li J,Wu W.Clinical and radiological characteristics of 17 Chinese patients with pathology confirmed tumefactive demyelinating diseases:follow⁃up study.J Neurol Sci,2015,348:153⁃159.
[20]Wang Q,Qi XK,Liu JG,Wang W,Qiu F,Duan F,Xiong B. Clinical features,neuroimaging findings and pathological characteristics of 35 patients with demyelinating pseudotumors of brain.Zhonghua Shen Jing Ke Za Zhi,2007,40:456⁃459.[王起,戚晓昆,刘建国,王巍,邱峰,段枫,熊斌.脱髓鞘假瘤35例的临床表现和影像及病理特点.中华神经科杂志,2007,40:456⁃459.]
Clinical analysis of five cases of demyelinating pseudotumor
GU Fu⁃rong1,YAN Xiao⁃ling2,QIN Jie1,XU Xiao⁃lin11Department of Neurology,2Department of Pathology,Tianjin Huanhu Hosptial,Tianjin 300350,China Corresponding author:XU Xiao⁃lin(Email:hhyyxxl@163.com)
ObjectiveTo study the clinical manifestations,imaging and pathological features, treatment and prognosis of 5 patients diagnosed as demyelinating pseudotumor(DPT)by pathology.MethodsThe data of clinical features,radiological and histological examination of 5 patients with DPT were retrospectively analyzed,and relevant literatures were reviewed.ResultsAll patients were male. Main symptoms included limb weakness in 3 cases,dizziness and impaired memory in 2 cases,seizures in one case.Head MRI examination revealed space⁃occupying lesions with hypointense signal on T1WI, hyperintense signal on T2WI and FLAIR.Enhanced MRI showed obvious enhancement of lesions(open⁃ring enhancement in 3 cases).The lesion were totally(4 cases)or partially(one case)removed,and postoperative histological examination showed inflammatory demyelination.One case died after twice relapse,and others had favorable prognosis.ConclusionsDPT is an inflammatory demyelination with mass effect.It should be differentiated from central nervous system tumors in order to avoid unnecessary resection or radiotherapy.
Demyelinating diseases;Magnetic resonance imaging;Pathology
2017⁃02⁃28)
10.3969/j.issn.1672⁃6731.2017.03.010
天津市应用基础与前沿技术研究计划项目(项目编号:13JCYBJC22700)
300350天津市环湖医院神经内科(谷芙蓉、秦洁、徐小林),病理科(阎晓玲)
徐小林(Email:hhyyxxl@163.com)
