神经生长因子对糖皮质激素诱导大鼠海马神经元凋亡的保护作用
2017-05-15夏颖华孔晓冬张释双张明义赵子龙葛歆瞳
夏颖华 孔晓冬 雷 平 张释双 张明义 赵子龙 葛歆瞳
神经生长因子对糖皮质激素诱导大鼠海马神经元凋亡的保护作用
夏颖华 孔晓冬 雷 平 张释双 张明义 赵子龙 葛歆瞳
目的探讨神经生长因子对糖皮质激素诱导的大鼠海马神经元凋亡的保护作用。方法体外分离原代培养18只新生Wister大鼠海马神经元,噻唑蓝法测定地塞米松诱导海马神经元凋亡的最低敏感剂量,观察不同质量浓度神经生长因子对地塞米松(0.10×10⁃6mol/L)诱导海马神经元凋亡的保护作用。结果与阴性对照组相比,地塞米松Ⅰ组(10×10⁃6mol/L)、Ⅱ组(1×10⁃6mol/L)和Ⅲ组(0.10× 10⁃6mol/L)大鼠海马神经元活性均降低(P=0.000,0.000,0.000)。予不同质量浓度神经生长因子后,神经生长因子0.18 ng/ml组大鼠海马神经元活性低于阴性对照组(P=0.000)和阳性对照组(P=0.010),神经生长因子18 ng/ml组大鼠海马神经元活性高于阳性对照组(P=0.000)和神经生长因子0.18 ng/ml组(P=0.000)。结论糖皮质激素可以诱导体外培养的大鼠海马神经元凋亡,地塞米松0.10×10⁃6mol/L是诱导海马神经元凋亡的最低敏感剂量,神经生长因子可以拮抗地塞米松诱导的大鼠海马神经元凋亡。
神经生长因子;糖皮质激素类;海马;细胞凋亡;细胞,培养的;疾病模型,动物
This study was supported by Tianjin Research Program of Application Foundation and Advanced Technology(No.15JCYBJC50500),Science and Technology Foundation of Tianjin Health Bureau(No. 2015KZ118),and Tianjin Medical University General Hospital Youth Incubation Fund(No. ZYYFY2015034).
为适应外源性和内源性应激(如创伤、疾病、精神因素等),机体调节生物活动以保持内环境稳态,从而激活下丘脑⁃垂体⁃肾上腺(HPA)轴,导致血清皮质醇水平异常,严重者甚至诱发危重症相关性糖皮质激素不足(CIRCI)[1]或慢性血清皮质醇水平升高,破坏免疫稳态,诱发内环境紊乱、内脏型肥胖和胰岛素抵抗等代谢性疾病[2⁃3]。研究显示,高水平糖皮质激素可以引起海马神经元突触缺失和海马萎缩,加重海马齿状回神经元凋亡,从而影响认知功能[4]。因此,如何选择适宜的糖皮质激素剂量和使用时间,从而在有效发挥外源性糖皮质激素治疗作用的同时,避免应用不合理导致的神经元不良反应,是临床医师一直探索的课题。神经生长因子(NGF)作为临床应用广泛的神经营养因子(NTF),业已证实在神经元存活、生长、分化和再生等方面发挥重要作用[5]。本研究旨在大鼠海马神经元体外培养基础上,采用细胞酶学分析法观察糖皮质激素对新生大鼠海马神经元活性的影响,以及神经生长因子对糖皮质激素诱导的海马神经元凋亡的保护作用。
材料与方法
一、实验材料
1.实验动物健康清洁级24 h内新生Wistar大鼠共18只,性别不限,体重为5~7 g,均由解放军军事医学科学院卫生环境医学研究所提供,每次实验取同一窝别乳鼠6只。所有孕鼠均于万级屏障系统喂以洁净饲料,于室温(22±3)℃、相对湿度40%~70%、12 h昼-12 h夜循环照明环境中饲养,自由摄食、饮水。
2.试剂与仪器(1)药品与试剂:鼠神经生长因子(恩经复,规格:18 μg/支)购自厦门未名生物医药有限公司,地塞米松(规格:1 mg/ml)购自美国Sigma公司,SFFD培养液[包含DMEM培养基/F⁃12混合液(1∶1)]和N2无血清添加剂为美国Gibco公司产品,胎牛血清(FBS)由美国Hyclon公司提供,噻唑蓝(MTT)和二甲基亚砜(DMSO)购自美国Sigma公司。(2)仪器与设备:96孔培养板购自丹麦Nunc公司,倒置相差显微镜为日本Olympus公司产品,二氧化碳培养箱由德国Binder公司提供,Zoom 2000型解剖显微镜购自德国Leica公司,Allegra X⁃15R型离心机为美国Beckman公司产品。
二、实验方法
1.海马神经元原代培养参照文献[6⁃7]方法,于无菌条件下以体积分数75%乙醇溶液消毒处死新生Wistar大鼠,尖镊子剥离脑组织置于培养皿中,解剖显微镜下分离海马组织,完整去除血管和脑膜,以不含血清的SFFD培养液冲洗,充分剪碎。将含15%胎牛血清的SFFD培养液与剪碎的海马组织混合加入离心管中,移液管轻轻吹吸,细胞悬液在200目滤网上过滤,剩余组织在200目滤网上研磨后过滤,收集分散的单细胞悬液,调整细胞密度至1× 106个/ml,接种至预先涂有鼠尾胶原的96孔培养板中,置37℃、含5%二氧化碳的饱和湿度培养箱中培养。培养第2天全量更换含N2无血清添加剂的SFFD培养液,以后每3天半量更换含N2无血清添加剂的SFFD培养液,培养至第9天,可见海马神经元贴壁生长。共制备3张96孔培养板,其中2张用于糖皮质激素诱导海马神经元凋亡实验,1张用于神经生长因子干预糖皮质激素诱导海马神经元凋亡实验。
2.糖皮质激素诱导海马神经元凋亡(1)分组:将原代培养至第9天的2张96孔培养板中的海马神经元随机分为8组,每组各24孔细胞。①阴性对照组,弃原培养液,更换为新鲜含N2无血清添加剂的SFFD培养液,共培养48 h。②地塞米松Ⅰ~Ⅶ组,弃原培养液,更换为含有不同浓度地塞米松(10× 10⁃6、1×10⁃6、0.10×10⁃6、0.01×10⁃6、1×10⁃9、0.10×10⁃9和0.01×10⁃9mol/L)的含N2无血清添加剂的SFFD培养液,培养48 h。(2)MTT法检测海马神经元活性:每孔细胞加入5 g/L MTT溶液15 μl,培养4 h,于离心半径7 cm、转速1000 r/min离心3 min,弃上清液,加入DMSO溶液150 μl振荡溶解,采用酶联免疫吸附试验(ELISA)于590 nm波长处测定吸光度值(OD值),代表海马神经元活性。
3.神经生长因子干预糖皮质激素诱导海马神经元凋亡(1)分组:将原代培养至第9天的96孔培养板中的海马神经元随机分为4组,每组各24孔细胞。①阴性对照组,弃原培养液,更换为新鲜含N2无血清添加剂的SFFD培养液,培养48 h。②阳性对照组,弃原培养液,更换为含有0.10×10⁃6mol/L地塞米松的含N2无血清添加剂的SFFD培养液,培养48 h。③神经生长因子0.18 ng/ml组,弃原培养液,更换为含有0.10×10⁃6mol/L地塞米松的含N2无血清添加剂的SFFD培养液,同时加入0.10 ml神经生长因子0.18 ng/ml,共培养48 h。④神经生长因子18 ng/ml组,弃原培养液,更换为含0.10×10⁃6mol/L地塞米松的含N2无血清添加剂的SFFD培养液,同时加入0.10 ml神经生长因子18 ng/ml,培养48 h。(2)MTT法检测海马神经元活性:每孔培养细胞加入5 g/L MTT溶液15 μl,培养4 h,于离心半径7 cm、转速1000 r/min离心3 min,弃上清液,加入DMSO溶液150 μl振荡溶解,采用ELISA法于590 nm波长处测定OD值,代表海马神经元活性。
三、统计分析方法
采用SPSS 17.0统计软件进行数据处理与分析。采用Levene方差齐性检验,计量资料以均数±采用单因素方差分析,方差齐性者组间两两比较行LSD⁃t检验,方差不齐者组间两两比较采用Tamhane's T2法。以P≤0.05为差异具有统计学意义。
结果
一、糖皮质激素对大鼠海马神经元活性的影响
不同浓度地塞米松对大鼠海马神经元活性的影响差异有统计学意义(P=0.000),其中,地塞米松Ⅰ组(10×10⁃6mol/L)、Ⅱ组(1×10⁃6mol/L)和Ⅲ组(0.10×10⁃6mol/L)海马神经元活性均低于阴性对照组(P=0.000,0.000,0.000);而地塞米松Ⅳ~Ⅶ组海马神经元活性与阴性对照组差异无统计学意义(均P>0.05;表1,2),提示地塞米松0.10×10⁃6mol/L是诱导大鼠海马神经元凋亡的最低敏感剂量。
表1 不同浓度地塞米松组大鼠海马神经元活性的比较Table1.Comparisonofdifferentconcentrationsof dexamethasone on the activity of rat hippocampal neurons
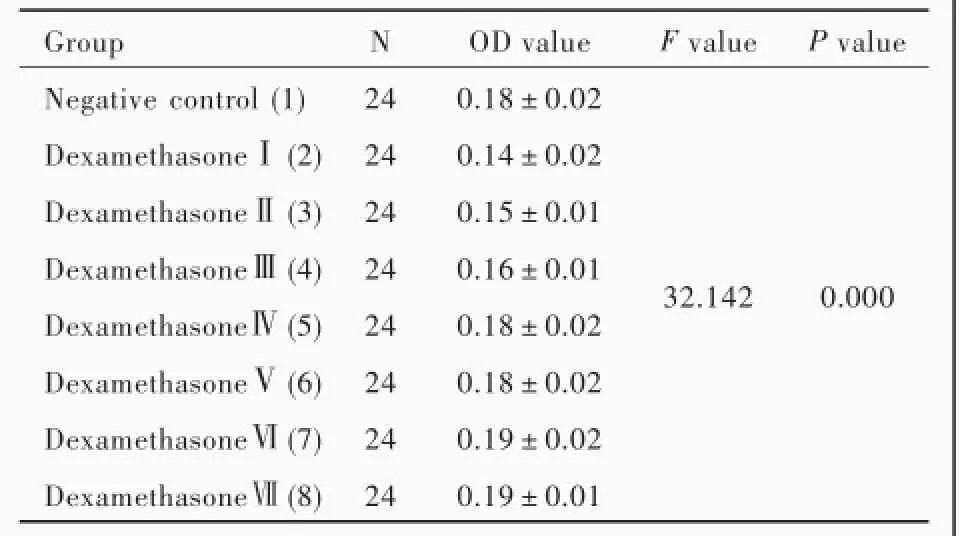
表1 不同浓度地塞米松组大鼠海马神经元活性的比较Table1.Comparisonofdifferentconcentrationsof dexamethasone on the activity of rat hippocampal neurons
?
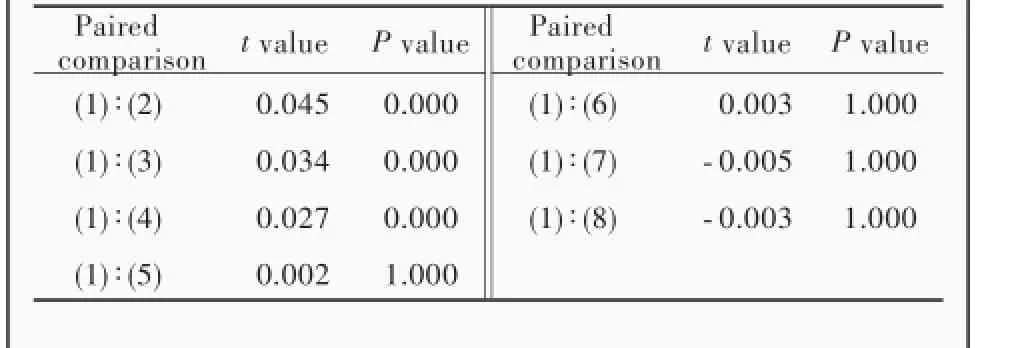
表2 不同浓度地塞米松组大鼠海马神经元活性的两两比较Table 2.Paired comparison of different concentrations of dexamethasone on the activity of rat hippocampal neurons
二、神经生长因子对糖皮质激素诱导海马神经元凋亡的保护作用
不同质量浓度神经生长因子对地塞米松0.10× 10⁃6mol/L诱导的大鼠海马神经元凋亡差异有统计学意义(P=0.000),其中,神经生长因子0.18 ng/ml组大鼠海马神经元活性低于阴性对照组(P=0.000)和阳性对照组(P=0.010);神经生长因子18 ng/ml组大鼠海马神经元活性仅高于阳性对照组(P= 0.000),而与阴性对照组差异无统计学意义(P>0.05);神经生长因子18 ng/ml组大鼠海马神经元活性高于神经生长因子0.18 ng/ml组(P=0.000;表3,4),表明神经生长因子可以拮抗糖皮质激素诱导的海马神经元凋亡,具有神经保护作用。
讨论
糖皮质激素在应激反应、水电解质平衡和机体生长发育等诸多方面扮演重要角色,但其临床应用一直饱受争议。近年相继有研究显示,机体处于应激状态时或予非生理水平糖皮质激素后,可持续刺激下丘脑⁃垂体⁃肾上腺轴,使靶组织对激素的敏感性改变,同时增强海马神经元对凋亡的敏感性[4,6]。本研究结果显示,海马神经元暴露于浓度>0.10× 10⁃6mol/L糖皮质激素后,可发生凋亡,与文献报道相一致[4,6]。机体处于慢性应激状态,可以刺激下丘脑⁃垂体⁃肾上腺轴,促进激素分泌增多、神经生长因子分泌减少,导致前额叶和海马萎缩,从而出现抑郁症状[4,8⁃10],最终导致向心性肥胖和代谢综合征以及空间学习能力和记忆障碍[1⁃2]。当今社会随着经济的快速发展和生活节奏的迅速增快,精神疾病发病率升高,国民普遍处于慢性应激状态,血清皮质醇水平升高,因此,积极探寻一种神经保护剂以拮抗糖皮质激素的负性作用、提高其有效性即显得十分必要。
表3 不同质量浓度神经生长因子组大鼠海马神经元活性的比较Table 3.Comparison of the activity of rat hippocampal neurons among different groups
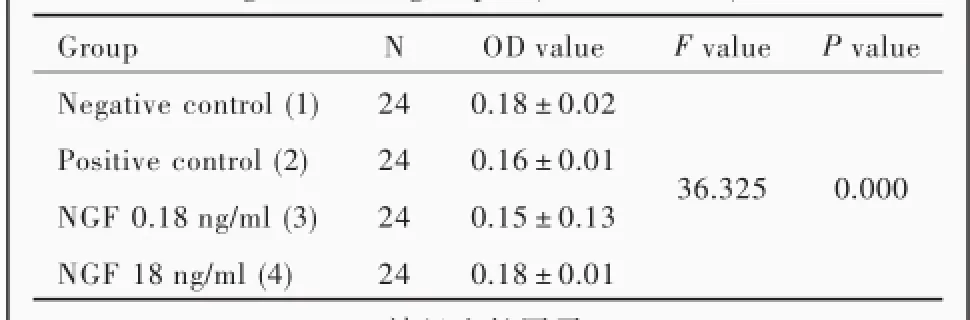
表3 不同质量浓度神经生长因子组大鼠海马神经元活性的比较Table 3.Comparison of the activity of rat hippocampal neurons among different groups
NGF,nerve growth factor,神经生长因子
?
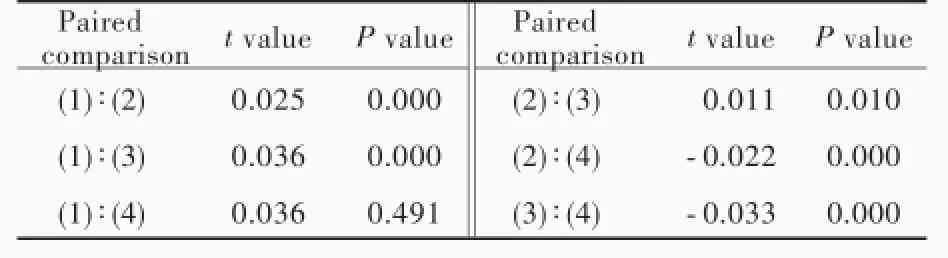
表4 不同质量浓度神经生长因子组大鼠海马神经元活性的两两比较Table4.Pairedcomparisonoftheactivityofrat hippocampal neurons among different groups
本研究结果显示,海马神经元活性降低与地塞米松呈剂量依赖性,一定浓度(10×10⁃6、1×10⁃6和0.10×10⁃6mol/L)糖皮质激素可以诱导体外培养的海马神经元凋亡,与文献报道相一致[11⁃12]。本研究采用MTT法检测海马神经元活性,其原理是:细胞线粒体内的琥珀酸脱氢酶(SDH)脱氢原子后,氢原子接收剂MTT可由黄色可溶性还原为蓝色不可溶性沉淀物,与神经元数目呈正相关,定量反映神经元活性和凋亡情况[13]。有文献报道,抑郁症模型动物予神经营养因子(如神经生长因子)后,可有效改善海马萎缩[8⁃9],为进一步寻找可以拮抗糖皮质激素诱导神经元凋亡的保护性措施提供理论依据。目前,临床应用较为广泛的是神经生长因子。神经生长因子是一种神经营养因子,可在脑卒中、神经损伤和阿尔茨海默病(AD)等神经变性病的治疗中发挥促神经细胞成熟分化、血管新生以及抗炎症反应、抗细胞凋亡和神经保护作用[14⁃15]。本研究采用的神经生长因子是临床常用的粉末状鼠神经生长因子,我们的预实验显示,神经生长因子1.80 ng/ml可以使神经元数目减少、脱落死亡,出现细胞毒性作用。研究显示,神经生长因子50 ng/ml可以拮抗地塞米松1×10⁃6mol/L诱导的嗜铬细胞瘤PC12细胞凋亡,究其原因是糖皮质激素受体激活[5]。本研究地塞米松0.10×10⁃6mol/L是诱导大鼠海马神经元凋亡的最低敏感剂量,因此推测发挥有效拮抗作用的神经生长因子>5 ng/ml,考虑到神经元较肿瘤细胞脆弱敏感,本研究采用含N2无血清添加剂的SFFD培养液稀释1000倍后以终质量浓度18 ng/ml模拟高水平神经生长因子组,稀释100 000倍后以终质量浓度0.18 ng/ml模拟低水平神经生长因子组,结果显示,神经生长因子可以拮抗糖皮质激素诱导的海马神经元凋亡,然而体内研究的神经生长因子起效剂量和作用方式尚待进一步的基础与临床研究。我们推测,在不同疾病模型和机体应激状态下,神经生长因子起效剂量不同[6,8],足剂量神经生长因子才会启动神经保护机制。
神经生长因子拮抗糖皮质激素诱导的神经元凋亡作用机制,可能与糖皮质激素受体有关。糖皮质激素诱导神经元凋亡可以分为3个阶段[16]:首先,是糖皮质激素受体介导的基因调节;其次,是促进与拮抗细胞凋亡因子平衡,对细胞凋亡的发生起决定性作用;最后,是内切核酸酶活性和Caspase蛋白是细胞凋亡的执行阶段[17]。基于上述理论基础,如果在神经元凋亡程序启动前,予以足够剂量的神经保护剂(如神经生长因子),即可发挥拮抗糖皮质激素、阻断神经元凋亡的作用。糖皮质激素与其受体结合,可以抑制蛋白激酶B(PKB)和细胞外信号调节激酶1/2(ERK1/2)激活和磷酸化,阻止神经生长因子与其受体——酪氨酸激酶受体1型的结合,从而抑制神经元轴突生长[5,15,18⁃19]。因此推测,补充足够剂量的神经生长因子后,神经生长因子与酪氨酸激酶受体1型充分结合,可能通过多种信号转导通路抑制凋亡相关基因表达,阻断凋亡级联反应,抑制神经元凋亡,发挥促血管新生、恢复下丘脑⁃垂体⁃肾上腺轴功能的作用。
综上所述,糖皮质激素可以诱导体外培养的大鼠海马神经元凋亡,其中地塞米松0.10×10⁃6mol/L是诱导大鼠海马神经元凋亡的最低敏感剂量;神经生长因子可以拮抗地塞米松诱导的大鼠海马神经元凋亡。因此,糖皮质激素联合神经生长因子既可以达到较好的神经保护作用,又可以降低药物剂量相关不良反应,为临床合理用药提供理论依据。鉴于体外研究的局限性,临床实践中糖皮质激素的用药时间和安全剂量、神经生长因子的用药时间和方式,以及如何达到理想的神经保护作用,尚待进一步深入研究。
[1]Chen X,Zhang B,Chai Y,Dong B,Lei P,Jiang R,Zhang J. Methylprednisolone exacerbates acute critical illness⁃related corticosteroid insufficiency associated with traumatic brain injury in rats.Brain Res,2011,1382:298⁃307.
[2]Han H,Dai ZP.Research progress in interactions of the circadian clock system and the hypothalamic⁃pituitary⁃adrenal axis.Yi Xue Zong Shu,2015,21:2123⁃2126[.韩鹤,戴泽平.生物钟系统与下丘脑⁃垂体⁃肾上腺轴相互作用的研究进展.医学综述,2015,21:2123⁃2126.]
[3]Espinosa⁃Oliva AM,de Pablos RM,Villarán RF,Argüelles S, Venero JL,Machado A,Cano J.Stress is critical for LPS⁃induced activation of microglia and damage in the rat hippocampus.Neurobiol Aging,2011,32:85⁃102.
[4]Finsterwald C,Steinmetz AB,Travaglia A,Alberini CM.From memory impairment to posttraumatic stress disorder⁃like phenotypes:the critical role of an unpredictable second traumatic experience.J Neurosci,2015,35:15903⁃15915.
[5]Terada K,Kojima Y,Watanabe T,Izumo N,Chiba K,Karube Y.Inhibition of nerve growth factor⁃induced neurite outgrowth from PC12 cells by dexamethasone:signaling pathways through the glucocorticoid receptor and phosphorylated Akt and ERK1/ 2.PLoS One,2014,9:E93223.
[6]Kurek A,Kucharczyk M,Detka J,Detka J,Slusarczyk J,Trojan E,Głombik K,Bojarski B,Ludwikowska A,LasońW, Budziszewska B.Pro⁃apoptotic action of corticosterone in hippocampal organotypic cultures.Neurotox Res,2016,30:225⁃238.
[7]Kaech S,Banker G.Culturing hippocampal neurons.Nat Protoc,2006,1:2406⁃2415.
[8]Filho CB,Jesse CR,Donato F,Giacomeli R,Del Fabbro L,da Silva Antunes M,de Gomes MG,Goes AT,Boeira SP,Prigol M, Souza LC.Chronic unpredictable mild stress decreases BDNF and NGF levels and Na(+),K(+)⁃ATPase activity in the hippocampus and prefrontal cortex of mice:antidepressant effect of chrysin.Neuroscience,2015,289:367⁃380.
[9]Della FP,Abelaira HM,Reus GZ,Santos MA,Tomaz DB, Antunes AR,Scaini G,Morais MO,Streck EL,Quevedo J. Treatment with tianeptine induces antidepressive⁃like effects and alters the neurotrophin levels,mitochondrial respiratory chain and cycle Krebs enzymes in the brain of maternally deprived adult rats.Metab Brain Dis,2013,28:93⁃105.
[10]Filho CB,Jesse CR,Donato F,Del Fabbro L,de Gomes MG, Goes AT,Souza LC,Giacomeli R,Antunes M,Luchese C, Roman SS,Boeira SP.Neurochemical factors associated with the antidepressant⁃like effect of flavonoid chrysin in chronically stressed mice.Eur J Pharmacol,2016,791:284⁃296.
[11]Haynes LE,Griffiths MR,Hyde RE,Barber DJ,Mitchell IJ. Dexamethasone induces limited apoptosis and extensive sublethal damage to specific subregions of the striatum and hippocampus:implications for mood disorders.Neuroscience, 2001,104:57⁃69.
[12]Lucassen PJ,Muller MB,Holsboer F,Bauer J,Holtrop A, Wouda J,Hoogendijk WJ,De Kloet ER,Swaab DF. Hippocampal apoptosis in major depression is a minor event and absent from subareas at risk for glucocorticoid overexposure.Am J Pathol,2001,158:453⁃468.
[13]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays.J Immunol Methods,1983,65:55⁃63.
[14]Taepavarapruk P,Song C.Reductions of acetylcholine release and nerve growth factor expression are correlated with memory impairment induced by interleukin⁃1beta administrations: effects of omega⁃3 fatty acid EPA treatment.J Neurochem, 2010,112:1054⁃1064.
[15]Wigerius M,Asghar N,Melik W,Johansson M.Scribble controls NGF⁃mediated neurite outgrowth in PC12 cells.Eur J Cell Biol,2013,92:213⁃221.
[16]Distelhorst CW.Recent insights into the mechanism of glucocorticosteroid⁃induced apoptosis.Cell Death Differ,2002, 9:6⁃19.
[17]Brossaud J,Roumes H,Moisan MP,Pallet V,Redonnet A, Corcuff JB.Retinoids and glucocorticoids target common genes in hippocampal HT22 cells.J Neurochem,2013,125:518⁃531.
[18]Arango⁃Lievano M,Lambert WM,Bath KG,Garabedian MJ, Chao MV,Jeanneteau F.Neurotrophic⁃priming of glucocorticoid receptor signaling is essential for neuronal plasticity to stress and antidepressant treatment.Proc Natl Acad Sci USA,2015, 112:15737⁃15742.
[19]Revest JM,Le Roux A,Roullot⁃Lacarriere V,Kaouane N, Vallée M,Kasanetz F,Rougé⁃Pont F,Tronche F,Desmedt A, Piazza PV.BDNF⁃Trk B signaling through Erk1/2 MAPK phosphorylation mediates the enhancement of fear memory induced by glucocorticoids.Mol Psychiatry,2014,19:1001⁃1009.
Protective effect of nerve growth factor on glucocorticoid⁃induced apoptosis of primary cultured rat hippocampal neurons
XIA Ying⁃hua1,KONG Xiao⁃dong1,LEI Ping1,ZHANG Shi⁃shuang1,ZHANG Ming⁃yi1,ZHAO Zi⁃long2,GE Xin⁃tong21Department of Geriatrics,Tianjin Medical University General Hospital;Tianjin Geriatrics Institute,Tianjin 300052,China
2Department of Neurosurgery,Tianjin Medical University General Hospital;Tianjin Neurological Institute; Tianjin Key Laboratory of Injury,Variation and Regeneration of Nervous System;Key Laboratory of Post⁃trauma Neuro⁃repair and Regeneration in Central Nervous System,Ministry of Education,Tianjin 300052, China
Corresponding author:KONG Xiao⁃dong(Email:xiaodongkong@163.com)
ObjectiveTo observe the protective effect of nerve growth factor(NGF)on apoptosis of primary cultured rat hippocampal neurons which were induced by glucocorticoids.MethodsThe neurons isolated from the hippocampus of 18 neonatal Wister rats were cultured in vitro.Methyl thiazolyl tetrazolium(MTT)analysis was used to detect the lowest concentration of dexamethasone⁃induced hippocampal neuronal apoptosis,so as to explore the protective effect of different concentrations of NGF on 0.10×10⁃6mol/L dexamethasone⁃induced hippocampal neuronal apoptosis.ResultsCompared with negative control group,the activity of rat hippocampal neurons was reduced significantly in dexamethasoneⅠ(10×10⁃6mol/L),Ⅱ(1×10⁃6mol/L)andⅢ(0.10×10⁃6mol/L)groups(P=0.000,0.000,0.000).After different concentrations of NGF were given,the activity of hippocampal neurons in NGF 0.18 ng/ml group was significantly lower than negative control group(P=0.000)and positive control group(P=0.010),while the activity of hippocampal neurons in NGF 18 ng/ml group was significantly higher than positive controlgroup(P=0.000)and NGF 0.18 ng/ml group(P=0.000).Conclusions Glucocorticoids can induce the apoptosis of in vitro cultured rat hippocampal neurons,and 0.10×10⁃6mol/L dexamethasone is the lowest sensitive dose.NGF plays a role of blocking dexamethasone⁃induced apoptosis.
Nerve growth factor;Glucocorticoids;Hippocampus;Apoptosis;Cells,cultured; Disease models,animal
2017⁃02⁃22)
10.3969/j.issn.1672⁃6731.2017.03.009
天津市应用基础与前沿技术研究计划项目(项目编号:15JCYBJC50500);天津市卫生局科技基金资助项目(项目编号:2015KZ118);天津医科大学总医院青年孵育基金资助项目(项目编号:ZYYFY2015034)
300052天津医科大学总医院保健医疗部天津市老年病学研究所(夏颖华,孔晓冬,雷平,张释双,张明义);300052天津医科大学总医院神经外科天津市神经病学研究所天津市神经损伤变异与再生重点实验室教育部中枢神经系统创伤修复与再生重点实验室(赵子龙,葛歆瞳)
孔晓冬(Email:xiaodongkong@163.com)
