平山病一例
2017-05-15周丽丽孟亚轲蒋珍珍王文昭
周丽丽 孟亚轲 蒋珍珍 王文昭
·病例报告·
平山病一例
周丽丽 孟亚轲 蒋珍珍 王文昭
上肢;肌萎缩;青少年;病例报告
患者男性,28岁,因渐进性右上肢远端无力伴肌萎缩5年,于2016年2月19日至我院门诊就诊。患者5年前无明显诱因出现右手手指无力,寒冷时加重,逐渐出现右手手指活动笨拙、不能并拢,穿针引线等精细活动明显受限,症状持续无明显缓解,伴右手肌萎缩,无明显肉跳感,其他肢体活动正常,无疼痛、麻木等感觉异常,无言语障碍、吞咽困难等。患者自发病以来,精神、睡眠、饮食尚可,大小便无明显异常,体重无明显改变。既往史、个人史及家族史均无特殊,自诉15~18岁身高生长显著(具体不详)。入院后体格检查:患者体温36.7℃,脉搏71次/min,呼吸16次/min,血压115/65 mm Hg(1 mm Hg=0.133 k Pa);神志清楚,语言流利,双侧瞳孔等大、等圆,直径约3 mm,神经系统查体未见明显异常;右手大小鱼际肌和骨间肌萎缩,左手未见明显肌萎缩,伸展双手可见手部肌肉震颤,右上肢远端肌力3+~4级、肌张力降低,右上肢近端和左侧肢体肌力5级、肌张力均正常,右上肢桡骨骨膜反射、肱二头肌反射和肱三头肌反射强阳性,左上肢阳性,双侧Hoffmann征和Babinski征阴性,共济运动和深浅感觉未见明显异常,脑膜刺激征阴性。实验室检查各项指标均于正常值范围。影像学检查:颈椎MRI(2016年2月24日)显示,C6~7水平脊髓轻度变细伴不规则异常信号,硬脊膜囊后壁向前移位,背侧硬脊膜外间隙增宽(图1)。头部MRI未见明显异常。电生理学检查:肌电图(2016年2月25日)显示,双上肢呈神经源性损害,以慢性损害为主,累及双侧C7~T1支配肌,尤以右侧显著,首先考虑脊髓前角细胞损害(图2)。临床诊断为平山病。予以维生素B1225 μg/d和维生素B15 mg/d口服营养神经,以及颈托制动,减少低头屈颈动作。门诊随访,治疗后6个月复诊,症状未见明显改善,肌萎缩无进展。
讨论
平山病(HD)亦称青年上肢远端肌萎缩症(JMADUE)、颈椎屈曲性脊髓病(CFM)和单肢肌萎缩症(MMA),是一种以单侧上肢远端肌萎缩为主要特征的自限性疾病,好发于青少年男性,起病隐匿,病程1~5年,于1959年由日本学者Hirayama首次报告[1]。平山病临床罕见,主要集中于日本、印度和中国等亚洲国家,多呈散发性,亦可见于意大利和瑞典等欧洲国家[2]。
目前关于平山病的发病机制尚不十分清楚,可能与以下学说有关。(1)生长发育学说:身高增长过快、颈椎曲度异常的特点可能与平山病的发病机制有关[3⁃4]。Toma和Shiozawa[3]比较7例平山病患者生长曲线与发病年龄的关系,发现平山病主要发生于身高与上肢生长速度最快的年龄段,生长高峰期结束后,病情逐渐停止并进入静止期,即身高快速增长期结束与平山病趋于平稳密切相关,他们认为,平山病通常发生于青春期,可能与青春期硬脊膜囊与脊柱不协调明显加重有关。有文献报道,男性生长曲线高于女性,男性身高每年最大生长值为10 cm,显著高于女性的8 cm,因此,生长速度较快和身高生长值较高的男性更易发病[1,3⁃4];此外,肌萎缩单侧多发可能与人体双上肢生长速度不一致有关[2]。(2)脊髓动力学说:脊髓前角细胞主要接受脊髓前动脉终末支沟动脉供血,易发生缺血性损伤,导致相应节段肌群萎缩。屈颈时为弥补脊柱后柱长度增加,下段颈椎硬脊膜囊后壁向前移位,将颈髓推挤至椎体后缘,引起下段颈髓不对称性受压变扁,导致下段颈椎脊髓前动脉供血微循环失调;此外,反复持续屈颈动作可以引起局部组织慢性循环障碍,导致脊髓前角细胞缺血性改变、继发性神经胶质增生、下段颈髓呈节段性萎缩和支配肌神经源性损害[1⁃3]。该学说与早期尸检结果相一致[1],且在颈椎屈曲位MRI中得到进一步证实,因此,平山病亦称颈椎屈曲性脊髓病。有学者认为,屈颈时受压变扁的硬脊膜囊直径减小程度与病程进展期呈负相关,即硬脊膜囊直径减小越明显、脊髓压迫越严重、病程越长[5]。(3)运动神经元病(MND)学说:平山病认为是局限于下段颈髓的特殊类型运动神经元病,肌电图显示病变肌肉呈神经源性损害,且脊髓前角细胞受累经组织病理学、影像学和电生理学已经证实,但该学说仍存较大争议[6]。(4)免疫机制学说:硬脊膜囊向前移位致下段颈髓受压,局部组织发生IgE介导的血小板聚集,诱发反复慢性循环障碍,导致脊髓前角细胞缺血性改变[2,7]。Kira和 Ochi[2]在5例合并特异性疾病家族史的平山病患者中发现4例存在呼吸道过敏性疾病,推测IgE介导的特异性反应机制参与平山病的发病。亦有研究显示,血浆置换疗法可以缓解部分患者肌无力症状[8],进一步证实免疫机制参与平山病的发病。(5)遗传因素学说:目前关于平山病的基因学研究尚处于初步探索阶段,有学者认为,平山病患者超氧化物歧化酶(SOD)基因突变,导致丙氨酸被天冬氨酸取代而致病,但该学说并未得到广泛证实[2]。综上所述,目前被国内外学者较认同的是生长发育学说和脊髓动力学说,但其确切发病机制尚待进一步研究。
平山病临床主要表现为:(1)起病隐匿,发病年龄通常<20岁,而≥20岁发病者并不少见。(2)呈良性病程,进展缓慢,多于15年进展期后进入静止期。亦有研究显示,约有7.50%的患者发病后5年仍继续进展,出现再次波动现象,病程10年,甚至达30年[9]。(3)单侧不对称性肌无力和肌萎缩,主要发生于C7~T1水平肌群,以肢体远端鱼际肌和前臂尺侧屈肌肌群为主,肱桡肌通常不受累,亦称斜形肌萎缩;双侧肌萎缩较严重,临床少见[4]。(4)不规则肌群颤抖,伸展时可出现姿势性震颤,多可见寒冷麻痹表现。(5)多不伴感觉异常、反射异常、脑神经病变、锥体束征和小脑功能障碍。
颈椎屈曲位MRI检查是诊断平山病的重要辅助方法,典型表现为[10]:(1)局限性下段颈髓(C4~7)变细、萎缩,尤以C6显著。(2)脊髓局限性受压变扁。(3)颈椎曲度减小、变直。(4)下段颈椎硬脊膜囊后壁与相应椎板缺少附着。(5)下段颈椎硬脊膜囊向前移位。(6)硬脊膜外间隙增宽,MRI增强扫描可见扩张的静脉丛。(7)非压迫性脊髓内信号改变。值得注意的是,颈椎MRI显示的髓内T2WI线样高信号(矢状位)和脊髓前角对称性T2WI高信号(横断面),即“蛇眼征”,提示脊髓前角细胞局限性、缺血性改变,系神经细胞缺血性坏死后形成的不可逆性囊性空洞病变[11]。
肌电图有助于平山病的诊断与鉴别诊断,通常表现为受累肌群神经源性损害,主要发生于C7~8肌节和T1肌节,而C5~6肌节(即三角肌、肱二头肌和肱桡肌)多不受累。约90%患者仅表现为单侧症状,但肌电图显示双上肢均呈神经源性损害[1,12]。平山病患者多为小鱼际肌受累,Jin等[13]研究显示,60.78%(62/102)的平山病患者尺神经复合肌肉动作电位(CMAP)波幅/正中神经复合肌肉动作电位波幅比例<0.60。F波主要用于评价运动传导通路近端完整性和脊髓前角细胞功能,运动障碍初期即可出现F波潜伏期延长、响应频率降低、波幅降低。平山病患者由于存在慢性失神经支配,F波潜伏期延长、响应频率降低、波幅降低,行神经移植术后波幅升高,有助于平山病诊断和发病机制研究[12]。
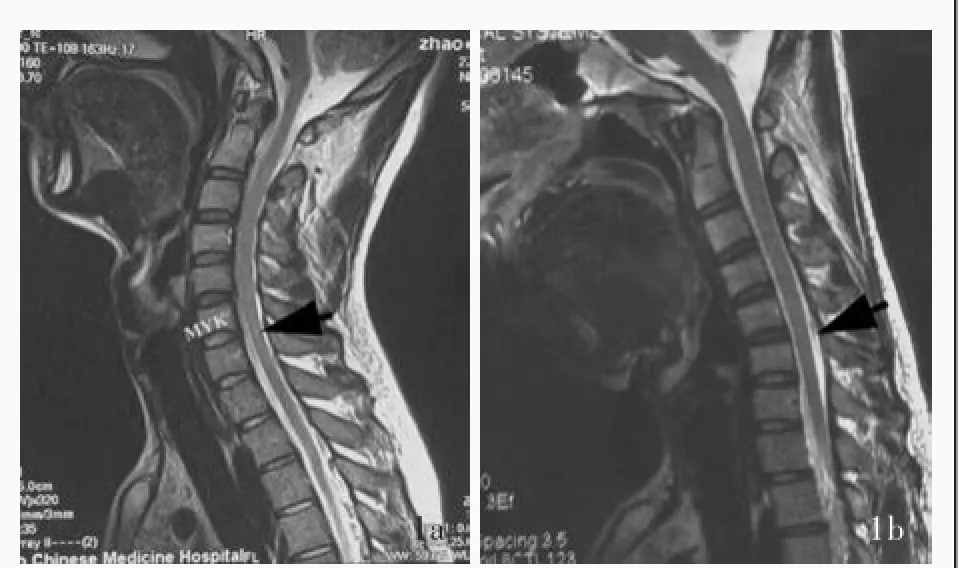
图1 颈椎MRI检查所见1a中立位矢状位T2WI显示,C6~7水平脊髓轻度变细伴不规则条状高信号(箭头所示)1b屈曲位矢状位T2WI显示,C6~7水平硬脊膜囊后壁向前移位,背侧硬脊膜外间隙增宽(箭头所示)Figure 1Cervical MRI findings Sagittal T2WI in neutral position showed slender spinal cord with irregularly striped high⁃intensity signal on the level of C6-7(arrow indicates, Panel 1a).Sagittal T2WI in flexion position showed the posterior wall of dural sac on the level of C6-7moved forward, resulting in widened dorsal epidural space(arrow indicates, Panel 1b).
应注意与肌萎缩侧索硬化症(ALS)、肌萎缩型颈椎病(CSA)等引起肌萎缩的疾病相鉴别。(1)肌萎缩侧索硬化症:好发于中老年男性,是一种以多发性或局限性进行性加重的肌萎缩失用为特点的恶性退行性变性运动神经元病,主要表现为肢体痉挛、腱反射亢进、局限性或多发性肌无力、肌萎缩和肌束震颤,多伴不同程度构音障碍、吞咽障碍、咀嚼障碍等脑神经损害表现。约40%肌萎缩侧索硬化症患者早期表现为上肢或下肢不对称性肌萎缩和肌无力[14]。通常同时累及上运动神经元和下运动神经元,恶性持续性进展,最终进展为四肢瘫痪、呼吸功能衰竭。二者主要鉴别诊断要点为平山病发病年龄较小、多见于青少年,而肌萎缩侧索硬化症多见于中年;受累肌群不同,平山病多局限于下段颈髓支配肌,而肌萎缩侧索硬化症可累及四肢肌和咽喉肌;随着病情进展,平山病受累部位仍局限,肌电图可见自发性电位逐渐减少甚至消失,呈慢性失神经电位,而肌萎缩侧索硬化症进行性加重,受累区域泛化,可见大量密集自发性电位,但也有研究显示,约9.64%的平山病患者肌电图可见广泛神经源性损害[13,15⁃16];平山病颈椎MRI多可见颈髓不同程度变细,而肌萎缩侧索硬化症多表现为脊髓信号强度改变[10]。(2)肌萎缩型颈椎病:以颈椎退行性变为基础,主要表现为上肢近端或远端肌萎缩,多发生于单侧,通常不伴感觉异常。研究显示,脊髓前角细胞损害可能是平山病(屈颈时硬脊膜囊异常移位和牵拉致下段颈椎脊髓前角细胞慢性微循环障碍)和肌萎缩型颈椎病(长期慢性机械性压迫致静脉梗死性改变)的共同发病机制,二者均可见“蛇眼征”[17],发病年龄和受累肌群为主要鉴别诊断要点,颈椎屈曲位和中立位MRI检查亦有助于鉴别诊断。目前,肌萎缩型颈椎病合并平山病仅见个案报道[18],仍需提高警惕,动态观察患者病情变化。

图2 肌电图检查所见2a右侧拇短展肌轻度收缩时可见宽大运动单位电位,重度收缩时可见募集呈病理干扰,峰值电压略增高2b神经传导速度显示右侧正中神经复合肌肉动作电位波幅降低2c神经传导速度显示右侧尺神经复合肌肉动作电位波幅降低Figure 2EMG findings Large motor unit potential(MUP)could be seen when right abductor pollicis brevis was lightly contracted,while some pathological interference phases could be seen when the muscle was heavily contracted,and the peak voltage was slightly increased(Panel 2a).Nerve conduction velocity(NCV)showed decreased amplitude of compound muscle action potential(CMAP)in right middle median nerve(Panel 2b)and ulnar nerve(Panel 2c).
平山病具有自限性,疾病早期予颈托制动可减少屈颈动作,防止肌无力进展、缩短病程,且已经肌电图检查证实[1],但颈托制动对疾病进展期无明显疗效。进展期肌电图显示,屈颈时F波潜伏期延长、响应频率降低,且经颅磁刺激(TMS)后运动诱发电位(MEP)潜伏期延长、波幅降低,可作为佩戴和(或)摘除颈托的参考指标[19]。平山病患者屈颈活动度增加,加重硬脊膜囊前移。Tokumaru和Hirayama[20]研究显示,颈托治疗组患者肌萎缩未进一步加重,其进展期[(1.8±1.2)年]明显小于对照组[(3.2± 2.3)年],表明颈托制动可使病程停止并进入静止期,改善病程短、肌萎缩轻的患者病情,因此,平山病应早期诊断、早期治疗。对于颈托制动无效、病情进行性加重、病程>5年的患者可考虑手术治疗,包括硬脊膜重建术、颈椎融合术、颈椎融合术联合硬脊膜重建术、肌腱转移重建术等。但手术疗效尤其是长期疗效和手术并发症,如颈椎融合术后颈椎相邻节段退行性变无疑给手术疗效造成窘境[1,21]。综上所述,颈托制动可取得较好疗效,由于平山病的自限性病程,较少患者采取外科手术治疗,因此,手术指征和手术疗效尚待进一步探索研究。
青少年男性出现单侧上肢无力、肌萎缩时,应考虑平山病的可能。平山病发病机制尚不十分清楚,生长发育学说和脊髓动力学说是目前主流学说,临床表现较具特征性,结合颈椎屈曲位MRI和肌电图检查,可资与其他引起肌萎缩的疾病相鉴别,颈托制动和营养神经治疗可以取得较好疗效,手术指征和手术疗效尚待进一步研究。
[1]Hassan KM,Sahni H.Nosology of juvenile muscular atrophy of distal upper extremity:from monomelic amyotrophy to Hirayama disease.Indian perspective.Biomed Res Int,2013:ID24063005.
[2]Kira J,Ochi H.Juvenile muscular atrophy of the distal upper limb(Hirayama disease)associated with atopy.J Neurol Neurosurg Psychiatry,2001,70:798⁃801.
[3]Toma S,Shiozawa Z.Amyotrophic cervical myelopathy in adolescence.J Neurol Neurosurg Psychiatry,1995,58:56⁃64.
[4]Ding Y,Rong DD,Wang XB,Li CJ.To evaluate the cervical spine curvature and growth rate for studying the pathogenesis of Hirayama disease in adolescents.Zhonghua Nei Ke Za Zhi, 2015,54:721⁃724[.丁岩,戎冬冬,王向波,李存江.从青少年颈椎曲度和生长速度探讨平山病的发病机制.中华内科杂志, 2015,54:721⁃724.]
[5]Dejobert M,Geffray A,Delpierre C,Chassande B,Larrieu E, Magni C.Hirayama disease:three cases.Diagn Interv Imaging, 2013,94:319⁃323.
[6]Lyu RK,Huang YC,Wu YR,Kuo HC,Ro LS,Chen CM, Chang HS.Electrophysiological features of Hirayama disease. Muscle Nerve,2011,44:185⁃190.
[7]Petrova M,Grigorova O,Penev L,Traykov L.Hirayama disease and immunoglobulin A deficiency:a coincidence or a syndrome. J Neurol Sci,2014,344:243⁃244.
[8]Hosokawa T,Fujieda M,Wakiguchi H,Oosaki Y.Pediatric Hirayama disease.Pediatr Neurol,2010,43:151⁃153.
[9]Shao M,Yin J,Lu F,Zheng C,Wang H,Jiang J.The quantitative assessment of imaging features for the study of Hirayama disease progression.Biomed Res Int,2015:ID803148.
[10]Chen TZ,Li Z,Tang JQ,Cheng XJ.MRI diagnosis of Hirayama diseases under the conventional position and flexion position. Shi Yong Fang She Xue Za Zhi,2014,30:1100⁃1102[.陈天忠,李治,唐建桥,程旭坚.平山病颈椎自然位及屈颈位的MRI诊断.实用放射学杂志,2014,30:1100⁃1102.]
[11]Abraham A,Gotkine M,Drory VE,Blumen SC.Effect of neck flexion on somatosensory and motor evoked potentials in Hirayama disease.J Neurol Sci,2013,334:102⁃105.
[12]Misra UK,Kalita J,Mishra VN,Phadke RV,Hadique A.Effect of neck flexion on F wave,somatosensory evoked potentials, and magnetic resonance imaging in Hirayama disease.J Neurol Neurosurg Psychiatry,2006,77:695⁃698.
[13]Jin X,Jiang JY,Lu FZ,Xia XL,Wang LX,Zheng CJ. Electrophysiological differences between Hirayama disease, amyotrophic lateral sclerosis and cervical spondylotic amyotrophy.BMC Musculoskelet Disord,2014,15:349.
[14]Taylor JP,Brown RH,Cleveland DW.Decoding ALS:from genes to mechanism.Nature,2016,539:197⁃206.
[15]Xu YS,Zheng JY,Zhang S,Zhang J,Kang DX,Fan DS.Study of electroneurophysiology of Hirayama disease.Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2008,8:314⁃317.[徐迎胜,郑菊阳,张朔,张俊,康德宣,樊东升.平山病的神经电生理学研究.中国现代神经疾病杂志,2008,8:314⁃317.]
[16]Shen DC,Fang J,Ding QY,Cui B,Li DW,Tai HF,Guan YZ, Cui LY.Electrophysiological differences between Hirayama disease patients with diffuse neurogenic damages on electromyography and patients with amyotrophic lateral sclerosis.Zhonghua Shen Jing Ke Za Zhi,2016,49:587⁃591[.沈东超,方佳,丁青云,崔博,李大伟,邰宏飞,管宇宙,崔丽英.肌电图呈广泛神经源性损害的平山病与肌萎缩侧索硬化患者电生理特点比较.中华神经科杂志,2016,49:587⁃591.]
[17]Zhang Z,Wang H.Is the"snake⁃eye"MRI sign correlated to anterior spinal artery occlusion on CT angiography in cervical spondylotic myelopathy and amyotrophy?Eur Spine J,2014,23: 1541⁃1547.
[18]Hashiguchi S,Ogasawara N,Watanabe A,Kawachi Y,Miki N. Cervical spondylotic amyotrophy associated with Hirayama's disease.Intern Med,1997,36:647⁃650.
[19]Chiba S,Yonekura K,Nonaka M,Imai T,Matumoto H,Wada T.Advanced Hirayama disease with successful improvement of activities of daily living by operative reconstruction.Intern Med, 2004,43:79⁃81.
[20]Tokumaru Y,Hirayama K.A cervical collar therapy for non⁃progressive juvenile spinal muscular atrophy of the distal upperlimb(Hirayama's disease).Rinsho Shinkeigaku,1992,32: 1102⁃1106.
[21]Paredes I,Esteban J,Ramos A,Gonzalez P,Rivas JJ.A severe case of Hirayama disease successfully treated by anterior cervical fusion.J Neurosurg Spine,2014,20:191⁃195.
Upper extremity;Muscular atrophy;Adolescent;Case reports
Hirayama's disease:one case report
ZHOU Li⁃li1,MENG Ya⁃ke2,JIANG Zhen⁃zhen3,WANG Wen⁃zhao1
1Department of Neurology,2Department of Spine Surgery,3Department of Electromyography,Changzheng Hospital,the Second Military Medical University of Chinese PLA,Shanghai 200003,China
WANG Wen⁃zhao(Email:wangwenzhao62@sina.com)
2017⁃02⁃22)
10.3969/j.issn.1672⁃6731.2017.04.012
200003上海,第二军医大学附属长征医院神经内科(周丽丽、王文昭),脊柱外科(孟亚轲),肌电图室(蒋珍珍)
王文昭(Email:wangwenzhao62@sina.com)
