不同来源沙门氏菌的毒力基因检测与耐药性分析
2017-05-12刘文化孙婷婷赵建梅李月华黄秀梅张林波王君玮
宋 雪,赵 格,刘文化,孙婷婷,王 娟,赵建梅,洪 军,李月华,黄秀梅,刘 娜,张林波,王君玮
(1. 吉林农业大学生命科学学院,吉林长春 130118;2. 中国动物卫生与流行病学中心,农业部畜禽产品质量安全风险评估实验室(青岛),山东青岛 266032;3. 山东省郯城县畜牧局,山东郯城 276100)
不同来源沙门氏菌的毒力基因检测与耐药性分析
宋 雪1,2,赵 格2,刘文化3,孙婷婷2,王 娟2,赵建梅2,洪 军2,李月华2,黄秀梅2,刘 娜2,张林波1,王君玮2
(1. 吉林农业大学生命科学学院,吉林长春 130118;2. 中国动物卫生与流行病学中心,农业部畜禽产品质量安全风险评估实验室(青岛),山东青岛 266032;3. 山东省郯城县畜牧局,山东郯城 276100)
[目的]了解不同畜禽中沙门氏菌的携带状况及其毒力和耐药性,为动物源沙门氏菌的流行病学分析和防控提供数据和依据。[方法]从山东、吉林、江西、新疆和云南等地区采集样本,用国标法分离鉴定沙门氏菌,用沙门氏菌血清型试剂盒检测血清型,用PCR方法检测毒力基因,最后用微量肉汤稀释法(MIC)对分离菌株进行耐药性分析。[结果]健康畜禽和发病畜禽样本中的沙门氏菌分离率分别为20.67%(141/682)、6.13%(45/734)。发现4种沙门氏菌优势血清型,分别为德尔卑(42.6%)、印第安纳(26.2%)、肠炎(17.7%)和汤普森(17%)。对分离菌株进行毒力基因分析,检测SPI-1~SPI-5上的5个核心蛋白基因和spvA、B、C、D和R毒力质粒基因,其中健康畜禽样本中沙门氏菌毒力岛上的基因携带率与发病畜禽样本中的携带率基本一致,但发病畜禽中的菌株毒力质粒基因携带率明显高于健康畜禽。耐药性检测结果表明,除多西环素和庆大霉素外,发病动物中的沙门氏菌对抗生素的耐药率均比健康动物中的高。猪源与鸡源沙门氏菌对庆大霉素、头孢噻呋、氧氟沙星、粘杆菌素的耐药率差异显著,对其他抗菌药物略有差异,但不显著。健康畜禽中的多数沙门氏菌株耐药1~2种,占分离菌株总数的55.32%;发病畜禽中耐药10种以上的沙门氏菌占分离株总数的44.44%。[结论]发病畜禽中的沙门氏菌分离率比健康畜禽中的低,但其毒力质粒基因的携带率较健康畜禽中的高,且耐药情况较严重,多重耐药率高。该分析结果可为沙门氏菌的危害评估和防控措施制定提供依据。
健康畜禽;发病畜禽;沙门氏菌;毒力;耐药性
沙门氏菌(Salmonella spp)是肠杆菌科的重要菌属,也是能够引发食物中毒的重要食源性病原菌[1]。沙门氏菌在自然界中分布广泛,血清型众多。在目前已发现的2 500多种血清型中,有20多种可以引起人兽共患病,其中危害较大的有鼠伤寒沙门菌、肠炎沙门菌、猪霍乱沙门菌等,而德尔卑沙门菌、汤卜逊沙门菌也可引起一些食源性疾病[2]。在我国,70%~80%的由致病菌引起的食物中毒事件是由沙门氏菌引起的[3]。全球每年约有9 380万胃肠炎病例为沙门氏菌感染所致[4]。可被沙门氏菌污染的食品种类比较广泛,其中肉类食品最为常见。沙门氏菌毒力的强弱与其携带的毒力基因有关,大量不同的毒力因子相互作用、相互影响可以产生毒性。沙门氏菌毒力因子包括菌毛、肠毒素、毒力岛、毒力质粒等[5]。相同毒力基因对不同来源沙门氏菌致病性的影响不同,不同血清型沙门氏菌携带的毒力基因也不相同,菌株耐药性增强也会导致其毒力增加[6]。
养殖过程中,沙门氏菌的原发感染或继发感染,均可引起畜禽发病。目前,关于养殖环节中的发病畜禽和进入屠宰环节的健康畜禽中的沙门氏菌分离率和病原性状相关性,尚未有报道。为探明两种不同来源的沙门氏菌流行状况,对不同来源沙门氏菌追本溯源,本研究选取养殖过程中的发病畜禽和屠宰过程中的健康畜禽为样本,研究了沙门氏菌的携带率、血清型、毒力基因和耐药性,并分析了其差异和相关性,补充了动物源性沙门氏菌的流行病学数据,同时也为不同来源沙门氏菌感染的有效防控和风险评估提供了理论依据。
1 材料与方法
1.1 材料
1.1.1 主要仪器。IIA2型生物安全柜(万心顺昌)、电热恒温培养箱(上海爱朗)、快速涡匀仪(深圳天南海北)、PCR仪(BIO-RAD)、电泳仪(北京六一仪器厂)、Gel Doc XR凝胶成像分析仪(BIO-RAD)、Luminex 200液相芯片分析仪(Luminex公司)。
1.1.2 主要试剂。缓冲蛋白胨水(BPW)、四硫磺酸盐煌绿增菌液(TTB)、亚晒酸盐胱氨酸增菌液(SC)、典液和0.1%煌绿溶液,均购于北京陆桥技术有限公司;沙门氏菌显色培养基,购于赛博生物技术股份有限公司;DNA Marker DL 2000、GoTaq®Green Master Mix,购于TaKaRa公司;沙门氏菌血清型快速分型试剂盒,购于美国Luminex公司;革兰阴性需氧菌药敏检测板,购自上海星佰生物技术有限公司。
1.2 方法
1.2.1 样品采集。2016年从山东、吉林、江西、新疆和云南等地区采集1 425份健康畜禽和发病畜禽样本(表1)。

表1 样本采集具体信息(单位:份)
1.2.2 沙门氏菌的分离鉴定。按照国家标准《食品微生物学检验》(GB4789.4—2010)进行分离鉴定。将样本接入BPW预增菌液中,置于37 ℃恒温培养箱中孵育12 h。然后,取200 μL预增菌液加入TTB和SC增菌液中,并分别置于42 ℃、37 ℃培养24 h。用接种环蘸取2种增菌液分别接种于沙门氏菌显色培养基中,37 ℃培养24 h。挑选紫色的可疑单菌落,再次接种于沙门氏菌显色培养基中进行纯化;挑选紫色的可疑单菌落,接种于大豆栋琼脂培养板上,用水煮法提取可疑菌落的DNA备用。设计沙门氏菌保守基因invA[7]引物序列,以可疑菌落DNA为模板,利用PCR方法,对筛选出的可疑菌落进行基因水平鉴定,检测菌株中是否含有目的基因片段。根据NCBI中已发表的沙门氏菌invA基因序列,设计引物:FinvA:5´-GTGAAATTATCGCCACGTTCGGGCAA-3´;RinvA:5´-TCTCGCACCGTCAAAGGAACC-3´。PCR反应体系为25 μL,30个循环,Go Taq®Greeen Master 12.5 μL;上下游引物各0.5 μL;DNA模板2 μL;Nuclease-Free Water 9.5 μL。PCR反应程序为95 ℃预变性5 min;94 ℃变性30 s;64 ℃退火30 s;72 ℃延伸30 s;72 ℃后延伸10 min。产物经琼脂糖凝胶电泳后,在284 bp位置有明显条带的细菌为沙门氏菌。
1.2.3 沙门氏菌血清型鉴定。利用沙门氏菌血清型快速分型试剂盒和Luminex 200液相芯片分析仪,对菌株进行血清型鉴定。PCR反应体系为25 μL,30个循环,Qiagen Hotstar Taq Master Mix 12.5 μL,灭菌去离子水8 μL,引物2.5 μL,模板2 μL。反应程序为:95 ℃预变性15 min,94 ℃变性30 s,48 ℃退火90 s,72 ℃延伸90 s,72 ℃延伸5 min,4 ℃保存。交联沙门氏菌各抗原基因微球稀释3.7倍,加入稀释后微球45 μL和PCR产物5 μL,在95 ℃下反应5 min,52 ℃反应30 min,52 ℃保存备用。在Luminex 200液相芯片分析仪中读取数据并分析结果。
1.2.4 沙门氏菌毒力基因检测。根据国内外对沙门氏菌毒力因子的研究结果,在GenBank中查找10对影响沙门氏菌毒力的基因,参照文献[8-11]设计引物(表2),对分离得到的沙门氏菌进行毒力基因检测。
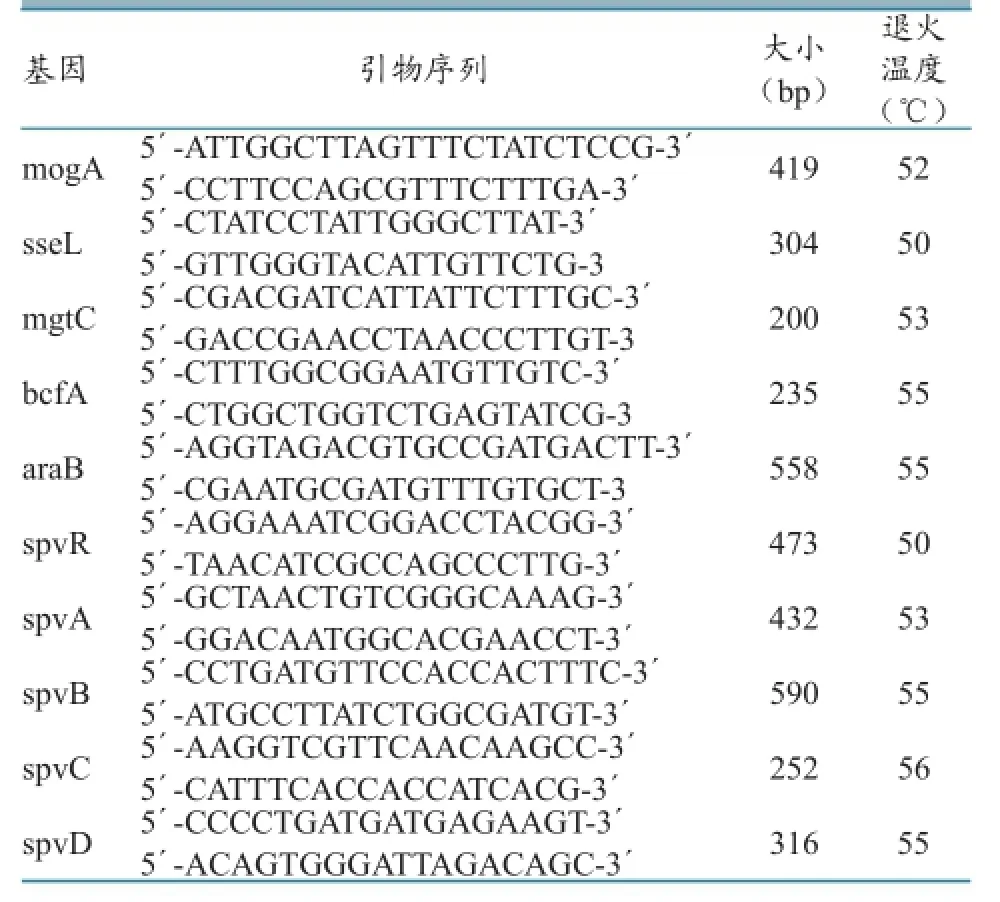
表2 PCR扩增引物
1.2.5 沙门氏菌耐药性检测。利用微量肉汤稀释法(MIC),测定沙门氏菌对13种抗感染药的敏感性。每块药敏板上,对每种抗生素设有一系列对倍稀释浓度的抗生素试剂,通过加入待检细菌与肉汤培养液稀释的菌悬液,经18~20 h孵育后,对药敏板条进行判读,经数据分析得到MIC值,并根据美国临床实验室标准化委员会(CLSI)的相应标准,获得相应的敏感、中度敏感和耐药结果。
1.2.6 数据分析。利用SPSS软件,分析血清型、毒力基因和耐药性检测结果。通过卡方检验,分析健康畜禽和发病畜禽样本中的沙门氏菌在优势血清型、毒力基因、耐药性和多重耐药性等方面的差异。
2 结果与分析
2.1 不同来源沙门氏菌的分离率
样品经沙门氏菌显色、培养基培养和PCR鉴定,发现阳性菌株在284 bp处有明显的目的条带。健康畜禽与发病畜禽中沙门氏菌的分离结果见表3,鉴定结果见图1。
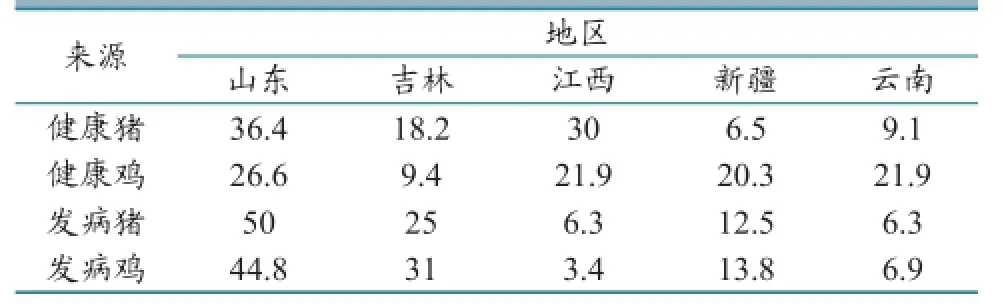
表3 沙门氏菌分离率(单位:%)

图1 部分沙门氏菌分离株invA基因PCR鉴定结果
2.2 沙门氏菌血清型分析
对不同来源沙门氏菌,经沙门氏菌血清型试剂盒分析后,共得到12种血清型(表4)。其中前4种优势血清型依次为德尔卑沙门氏菌(S.Derby)、印第安纳沙门氏菌(S.Indiana)、肠炎沙门氏菌(S.Enteritidis)和汤普森沙门氏菌(S.Thompson)。经SPSS软件计算,不同来源的沙门氏菌优势血清型差异不显著,P值均大于0.05(图2、图3)。

表4 沙门氏菌分离株血清型(单位:株)

图2 健康畜禽和发病畜禽中沙门氏菌4种优势血清型对比
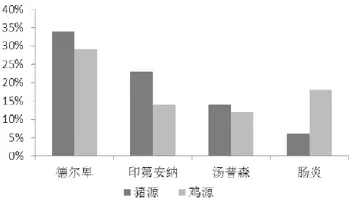
图3 猪源与鸡源沙门氏菌4种优势血清型对比
2.3 沙门氏菌毒力基因检测
对分离到的沙门氏菌进行毒力基因检测,发现健康畜禽中沙门氏菌毒力岛上的基因携带率与发病畜禽中的基因携带率基本一致,除SPI-2毒力岛上的sseL基因外,其他基因携带率均在90%以上。健康畜禽中沙门氏菌毒力质粒上的基因携带率均在40%以下,而发病畜禽中的基因携带率均在50%以上(表5、图4—图6)。
2.4 沙门氏菌耐药性分析健康畜禽和发病畜禽中的沙门氏菌耐药性检测结果见表6,对不同来源样本的分析结果见图7。对健康畜禽与发病畜禽中的沙门氏菌进行耐药性对比,发现除多西环素和庆大霉素外,发病动物中的沙门氏菌对抗生素的耐药率均比健康动物中的高。对不同宿主来源的沙门氏菌进行耐药性分析,结果见图8。经SPSS软件分析发现,猪源与鸡源沙门氏菌对庆大霉素、头孢噻呋、氧氟沙星、粘杆菌素的耐药率差异显著,对其他抗菌药物不显著。健康畜禽与发病畜禽中的沙门氏菌多重耐药结果见表7、图9。健康畜禽中分离的耐药1~2种的沙门氏菌数量最多,占分离菌株总数的55.32%。发病畜禽中分离的耐药10种以上的沙门氏菌数量最多,占分离株总数的44.44%。

表5 沙门氏菌分离株毒力基因的携带(单位:株)

图4 沙门氏菌分离株毒力基因的PCR扩增

图5 健康畜禽与发病畜禽沙门氏菌分离株毒力基因携带率对比
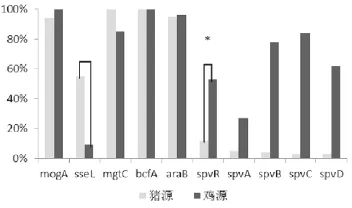
图6 猪源与鸡源沙门氏菌分离株毒力基因携带率对比

图7 健康畜禽与发病畜禽沙门氏菌分离株耐药率对比结果
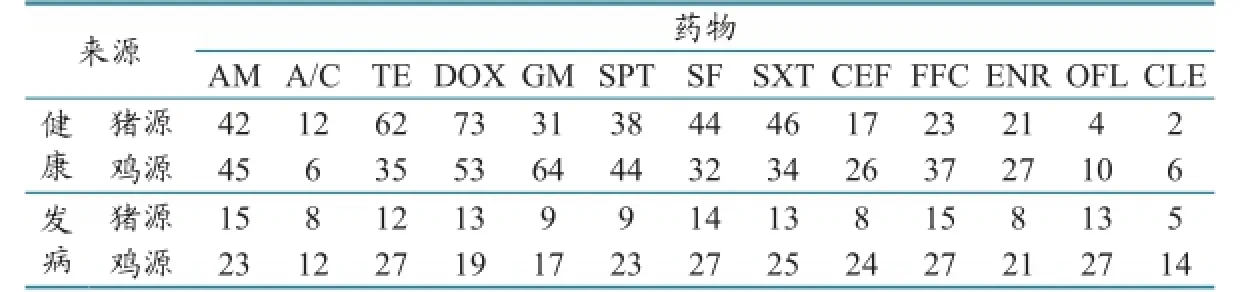
表6 沙门氏菌耐药性检出结果统计(单位:株)
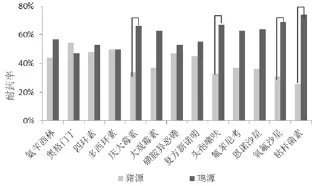
图8 猪源与鸡源沙门氏菌分离株耐药率对比结果

表7 耐药种数与耐药菌数(单位:株)

图9 沙门氏菌分离株多重耐药率对比结果
3 讨论
本研究对健康畜禽和发病畜禽中的沙门氏菌进行了分离鉴定以及血清型、毒力基因与耐药性检测。经综合考虑,在全国范围内,选取了5个地区,采集发病、健康2种来源以及猪源和鸡源2种宿主的样本。虽然样本量大体一致,但是从不同地区分离到的菌株数差异较大,不符合统计学意义上的正态分布规律,所以未对不同地区沙门氏菌的差异进行分析。实验结果表明,从不同样本来源角度分析,健康畜禽中沙门氏菌的分离率为20.67%,发病畜禽中的为6.13%。从不同宿主来源角度分析,猪源沙门氏菌分离率为12.86%,鸡源为13.42%,与刘鲜鲜等[12-13]对山东、南宁生猪屠宰加工环节沙门氏菌分离率(18.8%、32.67%)以及朱冬梅[14]对四川肉鸡屠宰加工环节沙门氏菌分离率(11.56%)相吻合。发病畜禽中的沙门氏菌分离率为6.13%,与王菊梅等对新疆部分地区病死鸡源沙门氏菌分离率(4.5%)较一致。
从不同样本来源角度分析,健康畜禽和发病畜禽中沙门氏菌的血清型差异性不显著,优势血清型一致,均是德尔卑沙门氏菌(S.Derby)、印第安沙门氏菌(S.Indiana)、肠炎沙门氏菌(S.Enteritidis)和汤普森沙门氏菌(S.Thompson)。从不同宿主来源角度分析,猪源鼠伤寒沙门氏菌分离率比鸡源高,而鸡源肠炎沙门氏菌分离率比猪源高。陈玲等[15]鉴定南方食品中污染的沙门氏菌血清型为德尔卑沙门氏菌和肠炎沙门氏菌。侯晓刚等[16]在四川部分地区猪肉产业链中检出11种沙门氏菌血清型,其中德尔卑(S.Derby)、鼠伤寒(S.Typhimurium)、波茨坦(S.Potsdam)、吉韦(S.Give)沙门氏菌为优势血清型。王嘉炜[17]对杨凌及周边城市鸡源沙门氏菌血清型进行检测,发现鼠伤寒沙门氏菌(S.Typhimurium)、汤普森沙门氏菌(S.Thompson)、埃森沙门氏菌(S.Essen)和婴儿沙门氏菌(S.Infant)等血清型比较常见。这都说明沙门氏菌血清型具有地域和宿主差异性,而发病与否并不是引发沙门氏菌血清型差异的主要因素。但也有一些血清型的感染与宿主相关,不同血清型沙门氏菌有不同的宿主范围。
对分离到的沙门氏菌进行毒力基因检测,从不同样本来源角度分析发现,健康畜禽、发病畜禽中的沙门氏菌对毒力岛上的基因携带率基本一致。除毒力岛SPI-2基因携带率较低外,其他毒力岛基因携带率均在90%以上。健康畜禽、发病畜禽中的沙门氏菌毒力质粒基因的携带率差异较大,发病畜禽中的沙门氏菌毒力质粒基因的携带率普遍偏高于健康畜禽中的,可见沙门氏菌更容易通过获得毒力质粒产生更强的毒性。从不同宿主来源角度分析,猪源SPI-2的sseL基因携带率比鸡源高,而鸡源毒力质粒基因携带率比猪源高。研究证明,不同的SPI-2碱基组成和基因分布可以驱动沙门氏菌的毒力变化,SPI-2中的基因突变可大大改变沙门氏菌对宿主的选择和在不同宿主中的毒性。
对分离到的细菌进行耐药性检测,从不同样本来源角度分析发现,除多西环素和庆大霉素外,发病动物中的沙门氏菌对抗生素的耐药率均高于健康动物中的。从不同宿主来源角度分析发现,猪源与鸡源沙门氏菌对庆大霉素、头孢噻呋、氧氟沙星、粘杆菌素的耐药率差异显著。这与沈海燕等[18]、乐其新等[19]、王晓泉等[20]分别对上海市、江苏省、合肥市畜禽产品中分离的沙门氏菌耐药性检测结果相吻合,说明对发病动物在其发病期间使用了大量抗生素,从而使沙门氏菌产生了较高耐药性。因此,在饲养、预防和临床治疗上,对猪源和鸡源沙门氏菌的用药要有一定的差异。
沙门氏菌感染目前仍然是全世界令人忧虑的公共健康问题。沙门氏菌株的遗传组成允许其在各种环境中存在,包括人、动物和非动物宿主,这增加了消除沙门氏菌污染的难度。本研究通过对不同样本来源、不同宿主来源的沙门氏菌进行分离鉴定及血清型、毒力基因和耐药性分析,揭示了沙门氏菌在不同样本来源、不同宿主之间的分布状况、流行病学特征,并对不同来源菌株进行了追本溯源,为预警和控制沙门氏菌病暴发提供了依据。
[1] FOLEY S L,ZHAO S H,WALKER R D. Comparison of molecular typing methods for the differentiation of Salmonella foodborne pathogens.[J]. Foodborne Pathogens and Disease,2007,43:.
[2] MØLBAK K. Human health consequences of antimicrobial drug-resistant Salmonella and other foodborne pathogens. [J]. Clinical infectious diseases:an official publication of the Infectious Diseases Society of America,2005,4111:
[3] MAJOWICZ S E,MUSTO J,SCALLAN E,et al. The global burden of nontyphoidal Salmonella gastroenteritis[J]. Clin Infect Dis,2010,50(6):882-889.
[4] 王军,郑增忍,王晶钰. 动物源性食品中沙门菌的风险评估[J]. 中国动物检疫,2007,24(4):23-25.
[5] 程琼,庞瑞亮,王若晨,等. 不同源沙门氏菌对小鼠致病力的比较与毒力基因检测[J]. 中国人兽共患病学报,2013(5):460-465.
[6] 程琼,庞瑞亮,王若晨,等. 不同来源沙门氏菌对小鼠致病力的比较研究及毒力基因的检测分析[C]//中国畜牧兽医学会动物传染病学分会.中国畜牧兽医学会动物传染病学分会第十二次人兽共患病学术研讨会暨第六届第十四次教学专业委员会论文集. 长春:中国畜牧兽医学会动物传染病学分会,2012:5.
[7] 吕世明,陈杖榴,陈建新,等. 应用PCR快速检测食品中沙门氏杆菌方法的研究[J]. 食品科学,2006,12:607-611.
[8] 王晶钰,董睿,王利勤,等. 市售鲜鸡蛋中沙门氏菌的分离鉴定及毒力岛基因检测[J]. 食品科学,2012,33(16):154-158.
[9] MADAJCZAK G,BINEK M. Influence of spv plasmid genes group in SalmonellaEnteritidis virulence for chickens I Occurrence of spv plasmidgenes group in Salmonella Enteritidis large virulence plasmid[J]. Med Dosw Mikrobiol,2005,57(2):163-174.
[10] LI K T,YE S Y,WALID Q A,et al. Antimicrobial susceptibility,virulence gene and pulsed-field gel electrophoresis profiles of Salmonella enterica serovar Typhimurium recovered from retail raw chickens,China[J]. Food Control,2017,72:36-42.
[11] 王德宁. 鸡源沙门氏菌耐药性、致病性与毒力基因相关性分析[D]. 哈尔滨:东北农业大学,2014.
[12] 刘鲜鲜,王君玮,王娟,等. 山东部分生猪屠宰场屠宰环节沙门氏菌污染状况分析[J]. 中国动物检疫,2015,32(5):82-86.
[13] 刘鲜鲜,王娟,赵建梅,等. 南宁地区生猪屠宰环节沙门菌分离株毒力基因检测与耐药性分析[J]. 畜牧与兽医,2016(9):103-107.
[14] 朱冬梅,彭珍,刘书亮,等. 肉鸡屠宰加工过程中沙门氏菌的污染情况及其耐药性分析[J]. 食品科学,2014,35(17):214-219.
[15] 陈玲,张菊梅,杨小鹃,等. 南方食品中沙门氏菌污染调查及分型[J]. 微生物学报,2013,12:1326-1333.
[16] 侯小刚,刘书亮,韩新锋,等. 四川部分地区猪肉产业链中沙门氏菌的分离及其鉴定[J]. 食品科学,2013,34(11):250-253.
[17] 王嘉炜,肖英平,杨华,等. 1鸡肉源沙门氏菌血清型、药敏性及部分耐药基因研究[J/OL]. 食品科学,2016:1-9[2017-02-22]. http://www.cnki.net/kcms/detail/11.2206. TS.20161116.1026.006.html.
[18] 沈海燕,郭慧霞,许学斌,等. 上海市零售禽肉制品和活禽中沙门氏菌血清型与耐药性研究[J]. 中国畜牧兽医,2014(11):263-266.
[19] 乐其新,李郁,张玮,等. 合肥市生猪肉沙门菌分离株耐药表型与耐药基因的相关性研究[J]. 中国卫生检验杂志,2008(12):2488-2490.
[20] 王晓泉,焦新安,刘晓文,等. 江苏部分地区食源性和人源沙门氏菌的多重耐药性研究[J]. 微生物学报,2007(2):221-227.
(责任编辑:朱迪国)
Comparative Analysis of Virulent Genes and Drug Resistance of Salmonella Isolated from Different Sources
Song Xue1,2,Zhao Ge2,Liu Wenhua3,Sun Tingting2,Wang Juan2,Zhao Jianmei2,Hong Jun2,Li Yuehua2,Huang Xiumei2,Liu Na2,Zhang Linbo1,Wang Junwei2
(1. College of Life Science,Jilin Agricultural University,Chanchun,Jilin 130118;2. Laboratory of Quality and Safety Risk Assessment for Livestock and Poultry products(Qingdao)of Ministry of Agriculture,China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;3. Tancheng Animal Husbandry Bureau,Tancheng,Shandong 276100)
[Objective] In order to recognize the carrying situation ofSalmonellain different livestock and poultry and analyze the virulence and drug resistance,so as to provide data and basis for its epidemiological analysis and prevention and control. [Methods] Samples collected from Shandong,Jilin,Jiangxi,Xinjiang,Yunnan were conductedSalmonellaisolation and identification by the national method. Then these isolated strains were detectedserotypes and virulent genes using related kits and PCR method respectively. Finally,drug resistance analysis was made through broth microdilution method(MIC). [Results] The isolation rate ofSalmonellafrom healthy animals was 21.63%(141/652),while that in diseased animals was 13.64%(45/330). There were 4 dominant serotypes consisting ofS.derby(42.6%),S.indian(26.2%),S.enteritidis(17.7%),andS.thompson(17%). Virulent gene analysis was conducted by detecting the 5 core protein genes of SPI-1~SPI-5,as well as the virulent plasmid genes of spvA、B、C、D and R. Results showed the carrying of virulent genes existing inSalmonellapathogenicity island was basically identical between the healthy and diseased animals,while the virulent genes carried by plasmids were signifi cantly higher in diseased animals. According to the drug resistance test,a higher resistance rate was observed in diseased animals than in the healthy animals,except against Doxycycline and Gentamicin. Beside,Salmonellastrains isolated from chicken and swine showed obviously differences in drug resistance against Gentamicin,Cefurofen,Ofl oxacin and Colchicine. As for other antimicrobial agents,little difference was got. Most of the strains isolated from healthy livestock and poultry were resistant to 1~2 antibiotics,accounting for 55.32% of the total strains. On the other side,Salmonellastrains derived from diseased animals which revealed resistance to more than 10 antibiotics took up a proportion of 44.44%. [Conclusion] The isolation rate ofSalmonellain diseased animals was lower than that in healthy ones,however the virulent genes carried by plasmids in diseased animals was higher,showing severe and multiple drug resistance. This study would offer a basis forSalmonellarisk assessment and the establishment of corresponding prevention and control measures.
diseased animal;healthy animal;Salmonella;virulence;drug resistance
S852.61
:A
:1005-944X(2017)05-0040-07
10.3969/j.issn.1005-944X.2017.05.011
农业部国家农产品质量安全风险评估重大专项(GJFP2016007);留学人员科技活动择优资助项目
王君玮、张林波
