益生菌增加IPEC-J2细胞表面半乳糖在抑制RV感染中的作用
2017-05-11魏萍张睿张宏宇
魏萍,张睿,张宏宇
(东北农业大学动物医学学院,哈尔滨150030)
益生菌增加IPEC-J2细胞表面半乳糖在抑制RV感染中的作用
魏萍,张睿,张宏宇
(东北农业大学动物医学学院,哈尔滨150030)
轮状病毒通过识别细胞表面糖链附着于肠上皮细胞,一些肠道内常驻菌群可以修改细胞表面糖链。以3种益生菌上清孵育猪小肠上皮细胞IPEC-J2,猪轮状病毒(PRV)感染细胞。采用凝集素荧光技术测定各处理组IPEC-J2细胞表面半乳糖,检测对应轮状病毒滴度和RV含量变化。结果表明,对照组PRV TCID50·0.1mL-1为10-7.15±0.14,干酪乳杆菌组TCID50·0.1mL-1为10-3.875±0.125,食淀粉乳杆菌PRV TCID50·0.1mL-1为10-4.125±0.138,枯草芽孢杆菌PRV TCID50·0.1mL-1为10-4.16±0.144。3组益生菌上清组在RV感染48 h内,RV量显著低于未处理组。凝集素荧光标记表明,3株益生菌上清均可改变细胞表面半乳糖含量。干酪乳杆菌、食淀粉乳杆菌和枯草芽孢杆菌上清可增加IPEC-J2细胞表面半乳糖含量,提高细胞抗RV感染能力,阻断RV黏附,保护肠道上皮细胞。
益生菌;轮状病毒;凝集素;半乳糖
魏萍,张睿,张宏宇.益生菌增加IPEC-J2细胞表面半乳糖在抑制RV感染中的作用[J].东北农业大学学报,2017,48(4):36-44.
WeiPing,Zhang Rui,Zhang Hongyu.Effectof probiotic increase IPEC-J2 cellsurface galactose on the inhibition o f RV infection[J].Journalo fNortheastAgricultura lUniversity,2017,48(4):36-44.(in Chinese w ith English abstract)
轮状病毒属于呼肠弧病毒家族,可造成幼龄动物、婴幼儿病毒性腹泻。轮状病毒感染首先针对肠道细胞,需附着于细胞膜上特异聚糖[1]。轮状病毒分为唾液酸敏感型和非唾液酸敏感型,大多数轮状病毒需要识别特异性唾液酸[2-3],涉及半乳糖等多种糖类[4]。
肠道微生物群落功能主要涉及吸收能量和营养物质代谢、保护宿主免于外源微生物侵入、营养肠上皮细胞和调节免疫结构功能等[5]。某些益生菌产生可溶性因子可修改或修饰细胞表面糖基,抑制轮状病毒感染。肠道中多形拟杆菌具有聚糖修饰活性,修饰肠道细胞表面[6],编码200多种聚糖修饰酶[7]。肠上皮细胞表面覆盖密集的糖分子,在机体发育及抵御疾病中发挥关键作用。Freitas等研究表明益生菌代谢产物可修改细胞表面糖基表达,增加半乳糖表达[8]。益生菌抗病毒研究方面,如乳酸杆菌、肠球菌及双歧杆菌的有益作用已取得一定进展,包括肠道常驻菌群建立与肠道屏障功能维持、抑制病原体粘附肠粘膜、增强先天免疫和适应性免疫系统成熟[9-10]。Guandalini等表明益生菌可缩短病毒性腹泻持续时间[11]。益生菌代谢产物抑制轮状病毒侵染[12-14]。
本研究以具有抗轮状病毒能力的干酪乳杆菌、枯草芽孢杆菌、食淀粉乳杆菌培养上清液为原料,探究其对IPEC-J2细胞膜表面半乳糖表达影响及糖基改变对轮状病毒感染猪IPEC-J2细胞干扰作用,为阐述3种益生菌对轮状病毒影响机制提供参考。
1 材料与方法
1.1 材料及试剂
干酪乳杆菌(Lactobacillus casei)、食淀粉乳杆菌(Lactobacillusamylovorus)和枯草芽孢杆菌(Bacil⁃lusSubtilis)由东北农业大学动物医学学院传染病实验室分离保存,MA-104细胞及IPEC-J2细胞由河南农业大学牧医工程学院惠赠,猪轮状病毒OSU株引自ATCC。
DMEM细胞培养基购自Hyclone(美国);胎牛血清购自Gibco(美国);MRS液体培养基;D-Hanks溶液;ITSG胰岛素-转铁蛋白-亚硒酸钠混合液;RCA-120;正置荧光显微镜;猪β-半乳糖苷酶定量检测试剂盒购自北京诚林生物科技有限公司;猪RV-Ag定量检测试剂盒购自北京诚林生物科技有限公司。
1.2 试验方法
1.2.1 益生菌处理
枯草芽孢杆菌、干酪乳杆菌及食淀粉乳杆菌置于厌氧罐在37℃培养箱中培养过夜,活化3次后,细菌增殖对数期收获菌液,于4℃离心机,7 000 r·min-1获得各菌株上清,氢氧化钠调至pH 7.3,0.2mm Durapore滤器过滤后4℃留存。37℃条件下孵育1 d,若MRS离心液中无细菌生长,则验证上清液中无细菌,可作为试验上清液备用。
1.2.2 益生菌上清最大无毒剂量测定
将IPEC-J2细胞在含10%胎牛血清DMEM培养基中培养,待细胞80%融合时用0.25%胰酶-EDTA消化,稀释细胞悬液至2.5×104a.i.·L-1,以每孔200μL接种到96孔细胞培养板中(每孔5 000个细胞),边缘孔用无菌PBS充填。37℃、5%CO2细胞培养箱中培养24 h备用。
将3种益生菌培养上清倍比稀释,得到终浓度为原液浓度1/2、1/4、1/8、1/16、1/32、1/64、1/128的代谢产物稀释液,加入长成单层96孔细胞培养板中,置于37℃、5%CO2温箱中培养,每个孔设5个重复,同时设病毒和正常细胞对照组及调零孔。观察细胞病变情况,当病毒对照组细胞病变达80%时,移液器吸去各孔液体,每孔加入20μL MTT(贮存浓度)及180μL未加血清DMEM培养液,培养4 h,终止培养,小心吸去孔内培养液。37℃温箱孵育10min或摇床低速振荡10min后每孔加入150μL的DMSO测定OD490nm值(A值),确定代谢产物最大无毒剂量。
细胞活力=(药物组A值-调零孔A值)/(对照孔A值-调零孔A值)×100%。
1.2.3 细胞处理
细胞培养的基础培养基为DMEM,使用前添加10%胎牛血清(FBS),1%胰岛素-转铁蛋白-硒补充剂。细胞在37℃,5%CO2培养箱中培养,每1 d更换1次培养基,一般2 d形成单层细胞。正常组:将IPEC-J2细胞用含10%FBS的DMEM完全培养液作常规培养,待细胞生长融合至60%后继续培养48 h。半乳糖组:以5 nmola.i.·L-1半乳糖取代葡萄糖培养基培养15 d,诱导得到IPEC-J2细胞分化型细胞IPEC-Gal[15-17]。
1.2.4 凝集素荧光检测
PBS洗涤细胞6次后,用2%新鲜制备的多聚甲醛(P FA)固定20min。以含50mmol·L-1NH4Cl的PBS室温下浸泡10min后,将益生菌处理的细胞与FITC处理的RCA在黑暗中封闭45min,正常细胞与FITC(异硫氰酸荧光素)处理的RCA在黑暗中封闭45min。外源凝集素RCA工作浓度为20mg a.i.· L-1。PBS洗涤细胞6次后。荧光正置显微镜观测细胞荧光强度,以DMEM作空白校正。
1.2.5 RV感染细胞的半乳糖苷酶定量检测
将3种益生菌上清处理组(食淀粉乳杆菌处理组简称s组、干酪乳杆菌处理组简称g组、枯草芽孢杆菌组简称k组),半乳糖组(简称gal组)和细胞对照组接种于96孔板,用100倍半数组织感染量(TCID50),RV病毒分别感染12、24、36、48、72 h,收集细胞及上清液。未感染5种细胞作对照组。将收集好细胞及细胞液以6 000 r·min-1离心15min,收集上清。试剂盒检测,操作步骤如下:
①标准品稀释与加样:酶标板设标准孔10孔,在第一、二孔中分别加标准品100μL,标准品稀释液50μL,混匀;从第一、二孔中各取100μL分别加至第三、四孔,分别加标准品稀释液50μL,混匀;第三、四孔中先各取50μL弃掉,各取50μL分别加入第五、六孔中,分别加标准品稀释液50μL;在第五、六孔中各取50μL分别加入第七、八孔中,分别加标准品稀释液50μL,混匀后从第七、八孔中各取50μL分别加入第九、十孔中,混匀后各取50μL弃掉(稀释后各孔加样量均为50 μL,浓度分别为15、10、5、2.5、1.25 ng a.i.·L-1)。
②加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步骤操作相同)、待测样品孔。在酶标板上待测样品孔中先加样品稀释液40μL,再加样品液10μL(原细胞上清液稀释5倍)。将样品加于酶标板孔底部。
③温育:封板膜封板后置于37℃温育30min。
④配液:30倍浓缩洗涤液用蒸馏水稀释30倍后备用。
⑤洗涤:小心揭掉封板膜,弃掉液体,甩干后每孔加满洗涤液,静置30 s后弃掉,重复5次后拍干。
⑥加酶:每孔加入酶标试剂50μL,空白孔除外。
⑦温育:同步骤3。
⑧洗涤:同步骤5。
⑨显色:每孔加入显色剂A 50μL,再加入显色剂B 50μL,轻轻震荡混匀,37℃避光显色15min。
⑩终止:每孔加终止液50μL,终止反应。
⑪测定:以空白孔调零,450 nm波长测量各孔吸光度。加终止液后15min内测定。
1.2.6 RV的半数组织感染量检测
RV病毒在MA104细胞上传代增殖。将s、k、g、gal、细胞对照组以5×104·mL-1密度铺入96孔板,待长满单层后,将RV用DMEM培养基作10-1~10-8倍连续倍比稀释,分别接种铺满细胞96孔板,每孔接种病毒量为100μL,每个稀释度设置5个平行孔,同时设未加病毒细胞为对照,对照孔细胞只加维持液,置于37℃,5%CO2培养箱静置培养4 d。持续观察细胞CPE情况,采用Reed-Muench方法计算病毒TCID50。
logTCID50=高于50%病毒稀释度的对数+距离比例×稀释系数对数。
1.2.7 RV感染中病毒定量检测
将s、k、g、gal、正常细胞接种于96孔板,100倍TCID50的RV病毒分别感染12、24、36、48、72 h,收集细胞及上清液。将收集好细胞及细胞液,以6 000 r·min-1离心15min,收集上清。试剂盒检测,按说明书操作。
1.2.8 数据处理
试验数据经Excel初步整理后,采用SPSS 19.0统计学软件作单因素方差分析,结果用平均值±标准差表示。
2 结果与分析
2.1 3种益生菌上清最大无毒剂量
细胞活力>80%的上清浓度为本试验最大无毒剂量。1/8为3种益生菌上清最大无毒剂量(见表1)。
2.2 3种益生菌上清及半乳糖对IPEC-J2细胞表面半乳糖影响
在荧光显微镜下,可观察到所有组别细胞表面均存在半乳糖。由图1可知,半乳糖诱导后,细胞表面半乳糖增多,细胞荧光亮度最大(gal组),3种益生菌上清处理后细胞(s、k、g组)荧光亮度均大于正常组细胞(c组)。对照组细胞(c组)荧光亮度最弱。3种益生菌上清均改变IPEC-J2细胞表面半乳糖含量,细胞表面半乳糖增多。
2.3 3种益生菌上清及半乳糖对IPEC-J2细胞表面半乳糖苷酶影响
样品浓度与OD值标准曲线(见图2)。RV感染12~72 h时细胞中半乳糖苷酶时间趋势如图3所示。可知,RV感染IPEC细胞后24 h内,细胞内半乳糖苷酶含量无明显变化,24~48 h半乳糖苷酶含量下降,48~72 h半乳糖苷酶含量上升。
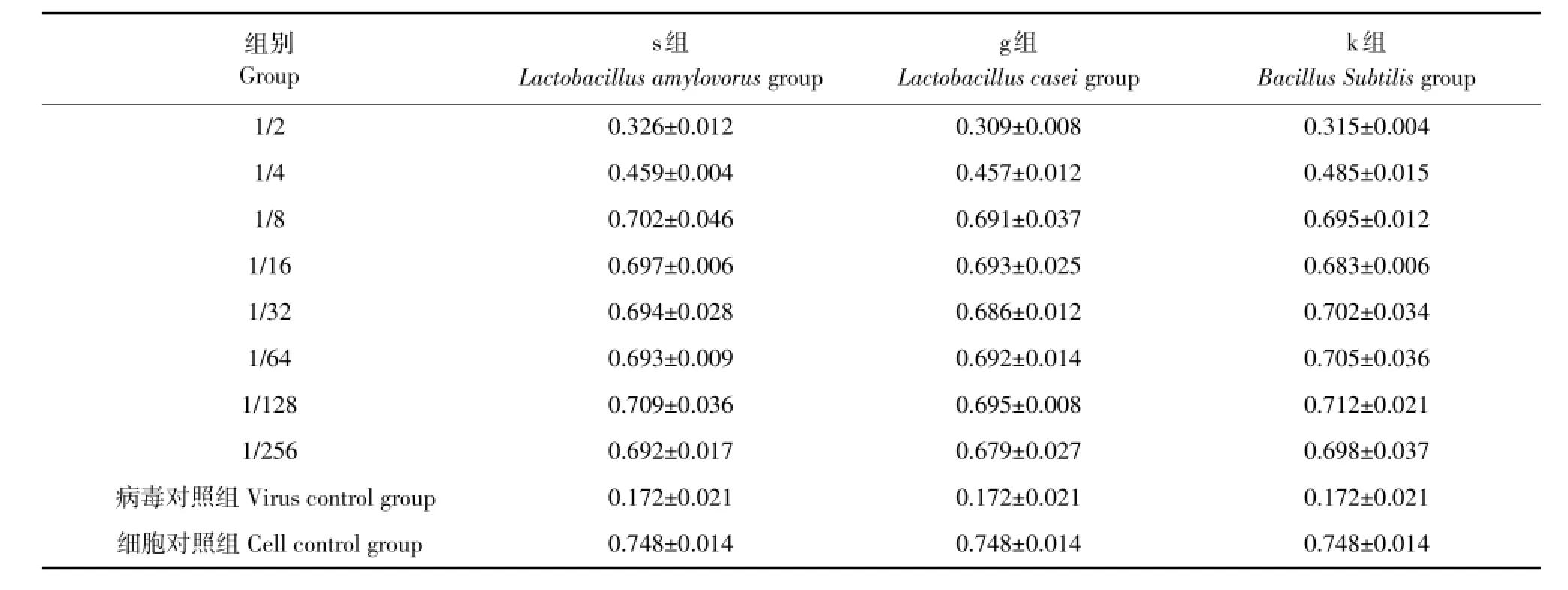
表1 益生菌上清最大无毒剂量Table 1 M axim um nontoxic dose of probiotics supernatant

图1 食淀粉乳杆菌组、枯草芽孢杆菌组、干酪乳杆菌组、半乳糖组与对照组的FITC-RCA染色(100×)Fig.1 FITC-RCA stain of Lactobacillusamylovorus group,Bacillussubtilis group, Lactobacillus L.casei group,Controlgroup,Galactosegroup(100×)
RV感染中各组半乳糖苷酶浓度时间变化如图4所示。未感染时,g、k、s、gal组半乳糖苷酶含量均低于细胞对照组(P<0.05);感染12和24 h时细胞对照组和g组半乳糖苷酶含量高于k、s、gal组(P<0.05),正常细胞与g组无差异(P≥0.05);感染48 h时,g和s组半乳糖苷酶显著高于细胞对照组(P<0.05)、k和gal组,g和s组间差异不显著(P≥0.05);感染72 h时,gal组显著低于其他组(P<0.05)。
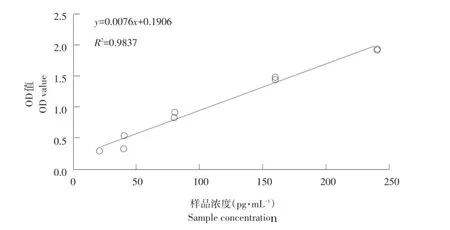
图2 半乳糖苷酶样品浓度与OD值标准曲线Fig.2 Standard curveof concentration and OD valueof galactosidase
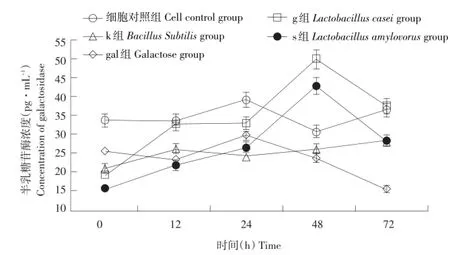
图3 RV感染后12~72h半乳糖苷酶含量变化Fig.3 Time trend ofgalactosidase content changes from 12 h to 72 h after in fection

图4 RV感染中各组半乳糖苷酶浓度的时间变化(n=3)Fig.4 Tem poral changesofgalactosidase concentration in each group(n=3)
2.4 TCID50检测结果
轮状病毒对各组细胞半数组织感染量测定结果如图5所示(标识不同字母代表差异显著):对照组IPEC-J2细胞组PRV TCID50·0.1·mL-1为10-7.15±0.14,IPEC-J2细胞抗轮状病毒感染能力显著低于gal组TCID50·0.1·m L-1为10-4.875±0.115及其他益生菌组(P<0.05);g组TCID50·0.1mL-1为10-3.875±0.125,s组PRV TCID50·0.1 mL-1为10-4.125±0.138,k组PRV TCID50·0.1m L-1为10-4.16±0.144,3个益生菌处理组的抗轮状病毒感染能力显著高于正常组及半乳糖组(P<0.05),各益生菌处理组之间抗轮状病毒感染能力差异不显著(P>0.05)。
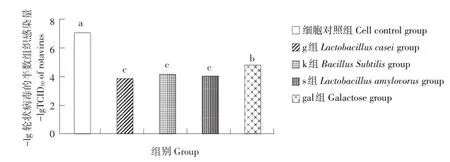
图5 轮状病毒侵袭Fig.5 Resultsof Rotavirus Invasion

图6 样品浓度与OD值标准曲线Fig.6 Standard curveofsamp le concentration and OD value
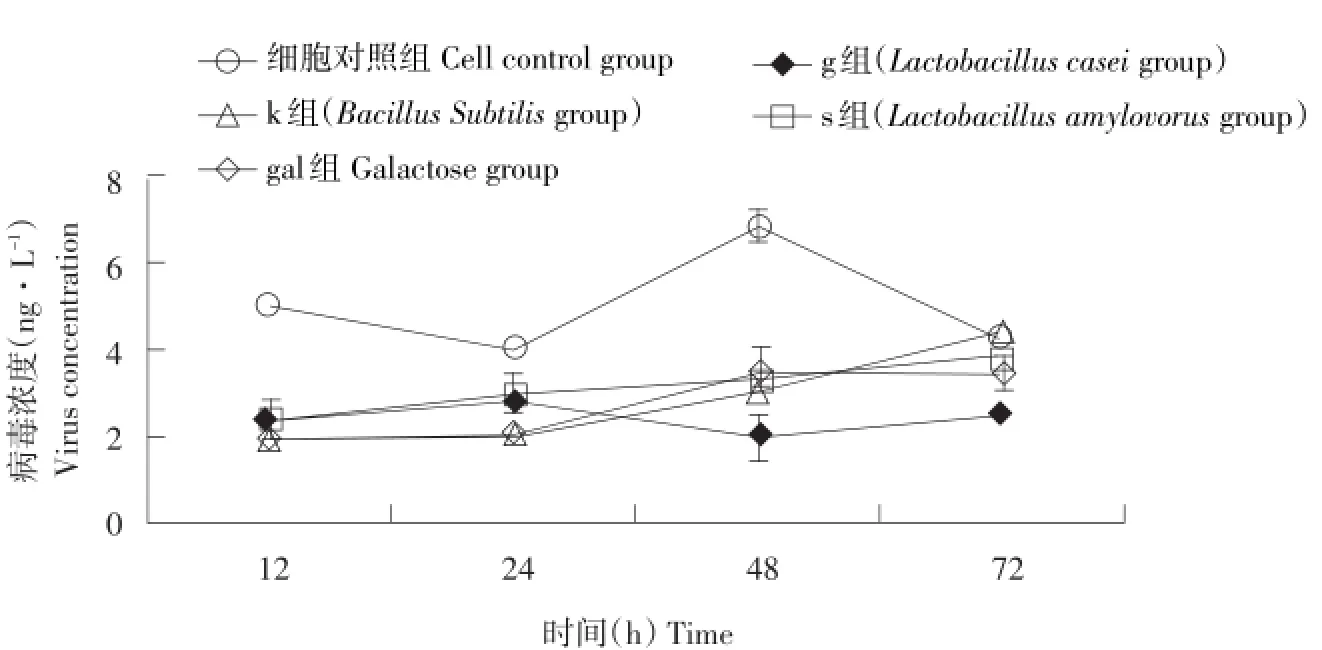
图7 感染12~72h RV含量的变化Fig.7 Changes in RV content from 12 h to72 h after infection
2.5 RV感染中病毒量检测结果
RV含量与OD值标准曲线如图6所示。根据标准曲线获得RV感染的病毒量随时间变化如图7所示。由图7可知,RV感染IPEC-J2细胞的前24 h内细胞增值缓慢,24~48 h病毒迅速增殖,病毒量达到峰值,48~72 h病毒数量有所下降。各组细胞在RV感染后第12~72 hRV含量及同一时间各组细胞间差异见图8。
RV感染后12 h,正常细胞RV量显著高于g、k、s、gal组。g、k、s、gal组间差异不显著;RV感染后第24 h,正常细胞RV量显著高于g、k、s、gal组(P<0.05);g、k、s及gal组无显著差异(P≥0.05);感染第48 h,正常细胞中RV量显著高于其他组(P<0.05),g、k、s及gal组无显著差异(P≥0.05);感染第72 h,k、正常、s和gal组RV量无显著差异(P≥0.05),gal组RV量高于g组(P<0.05)。

图8 RV感染细胞的病毒含量随时间变化(n=3)Fig.8 RV infection of cellsw ith the changes in theamountof time(n=3)
3 讨论
糖生物学涉及结构、生物合成研究,生物和自然界中蛋白质识别[18],猪小肠上皮细胞中优势糖基为岩藻糖、N-乙酰基-D-半乳糖胺、甘露糖、N-乙酰基葡萄糖胺和半乳糖及多种糖基。猪小肠各段岩藻糖和甘露糖为优势糖基,肠道不同部位糖基组成比例不同。肠上皮细胞表面糖基存在多样性,高速准确检测其表面糖基,确定和RV结合受体所含糖基种类至关重要。凝集素是一类可与糖专一共价可逆结合蛋白,具有高度专一性,为糖检测常用物质。本研究将经过荧光标记的蓖麻凝集素(FITC-RCA)与活细胞孵育,充分结合,除去未与半乳糖基结合多余荧光标记的蓖麻凝集素,再检测细胞表面荧光强度,以细胞表面平均荧光强度代表细胞表面半乳糖基含量。快速准确地反映细胞表面半乳糖基化水平改变情况。
Freitas等证明多形拟杆菌分泌的可溶性因子可增加半乳糖基转移酶,但不改变唾液酸酶活性,调节翻译后活动[8]。Haselhorst等发现轮状病毒黏附细胞大多数通过半乳糖识别[19]。益生菌可缩短病毒性腹泻持续时间[11],且可通过分泌可溶性物质促进细胞自动调节、刺激免疫系统而降低病毒感染,减少病毒对机体侵染。
半乳糖苷酶定量检测显示未感染时,g、k、s、gal组半乳糖苷酶含量均低于细胞对照组。RV感染12~72 h细胞中半乳糖苷酶时间趋势如图3。由图可知在RV感染IPEC细胞后24 h内,细胞内半乳糖苷酶含量呈上升趋势,24~48 h内半乳糖苷酶含量下降。这可能由于在感染24 h内,RV黏附在细胞上未大量进入宿主细胞[20],病毒粒子细胞刺激半乳糖苷酶增多,细胞表面半乳糖减少,暴露更多RV亲和糖基,有利于RV黏附、入侵。24~48 h RV大量入侵细胞进入复制状态,半乳糖苷酶可能代偿性降低。s和g组半乳糖苷酶变化趋势基本一致,具有相似抗感染机制。
本文推测,3种益生菌均可修饰细胞表面半乳糖,在细胞感染初期阻止细胞粘附和入侵,对半乳糖苷酶影响机制表现为多方面。因为半乳糖含量不仅与半乳糖苷酶有关,还受其他种类酶调控。益生菌上清的修饰作用除影响半乳糖相关酶类之外不排除存在一过性。即经3种益生菌上清处理后细胞中半乳糖苷酶量减少。干酪乳杆菌和食淀粉乳杆菌可显著减少细胞内半乳糖苷酶,半乳糖苷酶可切掉细胞膜表面糖链末端半乳糖残基,细胞表面半乳糖含量降低,半乳糖苷酶含量减少,细胞表面半乳糖增多。干酪乳杆菌、食淀粉乳杆菌可显著减低细胞内的半乳糖苷酶,细胞表面半乳糖含量增多,岩藻糖、甘露糖或唾液酸等糖基减少,产生占位或掩蔽效应。
病毒测定结果显示,3组益生菌组相对于正常组均显著增强肠上皮细胞抗轮状病毒感染能力(P<0.05);gal组相对于正常组显著增强抗轮状病毒感染能力(P<0.05);凝集素荧光结果显示,3组益生菌组及gal组相对于正常组均显著上调半乳糖含量。RV定量检测结果表明IPEC-J2细胞在感染后12~24 h RV增殖缓慢,24~48 h病毒迅速增殖,病毒量达峰值,48~72 h病毒数量下降。gal组在RV感染后24 h内,RV量显著低于任意组细胞,提示病毒复制期前半乳糖抗病毒作用最明显,推测半乳糖可能影响病毒复制期前感染过程,即半乳糖主要抑制RV病毒对细胞粘附作用。3组益生菌上清组在RV感染48 h内,RV量显著低于未处理组RV含量,12 h内3组间RV含量差异不显著。说明这3种益生菌上清在RV感染包括黏附和增殖等过程具有持续抑制作用。益生菌可减少病毒对细胞受体黏附。Vollenbroich等证明干酪乳杆菌和多形拟杆菌可在体外改变细胞表面糖链,改变RV感染的细胞受体构象,阻止RV感染[21]。本研究证明3种益生菌均可使细胞表面半乳糖增多,通过半乳糖拟诱导细胞并结合RV感染试验证得知,细胞表面半乳糖增多可抵抗轮状病毒感染。RV感染试验证明益生菌上清可通过增加细胞对RV抵抗能力降低轮状病毒感染程度,显著降低RV感染细胞病毒量。因而推测干酪乳杆菌、枯草芽孢杆菌和食淀粉乳杆菌上清通过上调细胞表面半乳糖表达改变细胞表面糖基化,导致唾液酸掩蔽,抑制轮状病毒进入细胞及感染。
4 结论
综上所述,细胞表面半乳糖增多可抑制RV黏附,干酪乳杆菌,枯草芽孢杆菌和食淀粉乳杆菌上清均可上调IPEC-J2细胞表面半乳糖含量,阻止RV黏附,抑制轮状病毒感染;3组益生菌上清还可提高细胞的抗RV能力。
[1]BomselM,Alfsen A.Entry of viruses through the epithelial bar⁃rier:Pathogenic trickery[J].Nature Reviews Molecular Cell Biolo⁃gy,2003,4(1):57-68.
[2]Beisner B,KoolD,Marich A,etal.Characterisation ofG serotype dependent non-antibody inhibitors of rotavirus in normalmouse serum[J].Archives of Virology,1998,143(7):1277-1294.
[3]Morris A P,EstesM K.Microbes andmicrobial toxins:Paradigms formicrobial-mucosal interactions.Ⅷ.Pathological consequenc⁃es of rotavirus infection and its enterotoxin[J].Ajp Gastrointesti⁃nal&Liver Physiology,2001,281(2):303-310.
[4]Jolly C L,BeisnerBM,Holmes IH.Rotavirusinfection ofMA104 cells is inhibited by ricinus,lectin and separately expressed sin⁃glebinding domains[J].Virology,2000,275(1):89-97.
[5]Guarner F.Enteric flora in health and disease[J].Digestion,2006, 73:5-12.
[6]FreitasM,Axelsson L,Cayuela C,etal.Indigenousmicrobesand their soluble factors differentially modulate intestinal glycosyl⁃ation steps in vivo[J].Histochemistry and Cell Biology,2005,124 (5):423-433.
[7]MartensEC,Chiang HC,Gordon JI.Mucosalglycan foraging en⁃hances fitness and transmission of a saccharolytic human gut bacterial symbiont[J].Cell Host&Microbe,2008,4(5):447-457.
[8]Freitas M,Cayuela C,Antoine JM,et al.A heat labile soluble factor from Bacteroides thetaiotaomicron VPI-5482 specifically increases the galactosylation pattern of HT29-MTX cells[J].Cel⁃lularMicrobiology,2001,3(5):289-300.
[9]Kotzampassi K,Giamarellos-Bourboulis E J.Probiotics for infec⁃tious diseases:More drugs,less dietary supplementation[J].Inter⁃national Journalof AntimicrobialAgents,2012,40(4):288-296.
[10]Rautava S.Potentialuses of probiotics in the neonate[J].Seminars in Fetal&NeonatalMedicine,2007,12(1):45-53.
[11]Guandalini S,Pensabene L,Zikri M A,et al.Lactobacillus GG administered in oral rehydration solution to children with acute diarrhea:A multicenter European trial[J].Journal of Pediatric Gastroenterology&Nutrition,2000,30(1):54-60.
[12]Petrof EO,Claud EC,Sun J,etal.Bacteria-free solution derived from Lactobacillus plantarum inhibitsmultiple NF-kappaB path⁃ways and inhibits proteasome function[J].Inflammatory BowelDis⁃eases,2009,15(10):1537-1547.
[13]Petrof EO,Kojima K,RopeleskiM J,etal.Probiotics inhibitnu⁃clear factor-κB and induce heatshock proteins in colonic epithe⁃lial cells through proteasome inhibition[J].Gastroenterology, 2004,127(5):1474-1487.
[14]Tao Y,Drabik K A,Waypa TS,etal.Soluble factors from Lacto⁃bacillus GG activate MAPKs and induce cytoprotective heat shock proteins in intestinalepithelial cells[J].Ajp Cell Physiology, 2006,290(4):1018-1030.
[15]Mack DR,Hollingsworth M A.Alteration in expression ofMUC2 and MUC3 mRNA levels in HT29 colonic carcinoma Cells[J]. Biochemical&BiophysicalResearch Communications,1994,199 (2):1012-1018.
[16]Gout S,Marie C,LainéM,et al.Early enterocytic differentiation of HT-29 cells:Biochemical changes and strength increases of adherens junctions[J].Experimental Cell Research,2004,299(2): 498-510.
[17]Pan Q,Tian Y,Li X,et al.Enhanced membrane-tethered mucin 3(MUC3)expression by a tetrameric branched peptide with a conserved TFLK motif inhibits bacteria adherence[J].Journal of BiologicalChemistry,2013,288(8):5407-5416.
[18]张树政.糖生物学与糖生物工程[M].北京:清华大学出版社, 2002.
[19]Haselhorst T,Fleming F E,Dyason JC,et al.Sialic acid depen⁃dence in rotavirus host cell invasion[J].Nature Chemical Biology, 2009,5(2):91-93.
[20]Maragkoudakis PA,ChingwaruW,Gradisnik L,etal.Lactic acid bacteria efficiently protecthuman and animal intestinalepithelial and immune cells from enteric virus infection[J].International Journalof Food Microbiology,2010,141(4):91-97.
[21]Vollenbroich D,OzelM,Vater J,etal.Mechanism of inactivation of enveloped viruses by the biosurfactant surfactin from Bacillus subtilis[J].1997,25(3):289-297.
Effect of p robiotic increase IPEC-J2 cell surface galactose on the inhibition of RV infection
WEIPing,ZHANG Rui,ZHANG Hongyu
(School of Veterinary Medicines,NortheastAgriculturalUniversity,Harbin 150030,China)
Rotaviruses attached to intestinal cells requires glycan recognition.Some bacteria from the gutm icroflora have been shown to m odify cell-surface glycans.In this study,IPEC-J2 cultured cells were incubated w ith supernatants of probiotics and then infected w ith rotavirus.The porcine sm all intestina l epithe lia l ce ll line IPEC-J2 was incubated w ith three p robiotic supernatants and then in fected w ith porcine rotavirus(PRV).The surface galactose of IPEC-J2 cells was measured through lectin fluorescence technique,and the virulence of rotavirus was detected in each treatment group.The results showed that the PRV TCID50·0.1 m L-1of controlgroup,Lactobacillus casei goup,Lactobacillus amylovorus group and Bacillus Subtilis group were 10-7.15±0.14,10-3.875±0.125,10-4.125±0.138and 10-4.16±0.144.The RV content of the three probiotics group was significantly lower than that of the untreated group w ithin 48 h o f RV in fection.Lectin fluorescence labe ling indicated that the three p robiotics supernatants cou ld change the contento f ga lactose on the surface o f the ce lls.Lactobacillus casei supernatant,Lactobacillus amylovorus supernatant and Bacillus subtilis supernatant could increase the content ofgalactose on the surface of IPEC-J2 cells,im prove the ability of anti-RV infection,inhibit the adhesion of the virus,and thus p lay a role in the protection of intestinalepithelialcells.
probiotics;rotavirus;lectin;galactose
S855.3;S858.28
A
1005-9369(2017)04-0036-09
时间2017-4-24 6:19:59[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170424.0619.012.html
2017-03-28
黑龙江省教育厅重点项目(12521z001);哈尔滨市科技局项目(2014RFXGJ096)
魏萍(1961-),男,教授,博士,博士生导师,研究方向为兽医传染病学与流行病学。E-mail:weiiping@163.com
