新疆百合鳞片离体培养研究
2017-05-11王雅楠薛莉雷家军
王雅楠,薛莉,雷家军
(沈阳农业大学园艺学院,沈阳110866)
新疆百合鳞片离体培养研究
王雅楠,薛莉,雷家军*
(沈阳农业大学园艺学院,沈阳110866)
以新疆百合鳞片为外植体,建立新疆百合鳞片组织培养再生体系。结果表明,新疆百合鳞片最佳消毒方法为70%酒精处理30 s后0.1%HgCl2浸泡15m in;最适诱导培养基为MS+1mg·L-16-BA+1mg·L-1NAA;不同部位鳞片诱导率为内层>中层>外层、中部>下部>上部。最适增殖培养基为MS+0.5mg·L-16-BA+0.05mg·L-1NAA,增殖系数达3.46;最适生根培养基为1/2MS+0.2mg·L-1NAA+0.2mg·L-1IBA,生根率达100%。
新疆百合;组织培养;鳞片
王雅楠,薛莉,雷家军.新疆百合鳞片离体培养研究[J].东北农业大学学报,2017,48(4):30-35.
Wang Yanan,Xue Li,LeiJiajun.Study on cu lture in vitro of sca les in Lilium martagon var.pilosiuscu lum[J].JournalofNortheastAgricu lturalUniversity,2017,48(4):30-35.(in Chinese w ith Eng lish abstract)
新疆百合(Lilium martagon var.pilosiusculum Freyn)为百合科百合属多年生草本植物,是中国境内除藏百合(L.paradoxum)、青岛百合(L.tsing⁃tauense)和东北百合(L.distichum)外的4种轮叶百合之一。新疆百合花朵下垂,花瓣呈紫红色,有斑点,花梗先端弯曲,观赏性状良好,具有珍贵食用和药用价值。但新疆百合分布范围狭窄,主要在新疆阿尔泰山及萨吾尔山地区[1],生长于海拔200~2 500m山坡或林下灌木丛中[2]。
植物组织培养技术在百合种球快速繁殖中应用广泛。Hussey等开展百合离体培养研究[3]。罗凤霞等研究表明新铁炮百合不同外植体诱导再生能力依次为种子>鳞片>花丝>花瓣>叶片[4]。柳玉晶等以东方百合品种‘Bernini’的花柱、花丝、花瓣外植体通过愈伤组织途经成功诱导植株[5]。王刚等研究认为MS+0.7~1.0mg·L-16-BA+0.07~0.2mg·L-1NAA条件下有利兰州百合(L.davidii var.unicolor Salisb.)鳞片诱导成苗[6]。雷家军等以鳞片作外植体,分别对垂花百合(L.cernum Kom.)和东北百合(L.distichum Nakai)作大量增殖扩繁[7-8]。孙旭才等试验表明细叶百合(L.pumilum DC.)在1/2MS+0.5 mg·L-1IBA条件下生根培养中生根最快,生根率达100%[9]。目前新疆百合研究多集中在药用价值[1]和核型分析[10]等方面,离体再生研究未见报道。本研究以新疆百合鳞片为外植体作诱导、扩繁及生根试验,建立有效新疆百合离体再生体系,为加快新疆百合的繁殖利用及进一步诱变育种、杂交育种及分子育种奠定组培基础。
1 材料与方法
1.1 材料
新疆百合(Lilium martagon var.pilosiusculum Freyn)引自新疆阿尔泰山,栽植保存于沈阳农业大学国家百合种质资源库。
1.2 方法
1.2.1 种球处理及培养条件
取饱满无病、无机械损伤,生长健壮新疆百合鳞片,洗衣粉浸泡15min,流水冲洗2 h,置于超净工作台,无菌滤纸吸干多余水分待用。
试验用培养基为MS培养基,添加30 g·L-1蔗糖,3.5 g·L-1琼脂粉,pH调至5.8。培养条件为23~25℃,光照强度为2 000 lx,每天光照16 h。
1.2.2 鳞片消毒
将新疆百合鳞片用70%酒精处理30 s后,HgCl2消毒处理,消毒时间分别为5、10、15、20min。再用无菌水冲洗3~4次,晾干后接种在培养基中,每处理20个完整鳞片,3次重复,10 d后统计污染率和死亡率。
污染率(%)=(污染外植体数/接种外植体总数)×100%
死亡率(%)=(死亡外植体数/接种外植体总数)×100%
1.2.3 鳞片不同部位诱导不定芽
将种球鳞茎剥开,分为外、中、内3层,分别用70%酒精处理30 s、HgCl2消毒15min,消毒后将不同层鳞片切成上、中、下3部分,将鳞片分成9个不同部位(外层上部、中部、下部;中层上部、中部、下部;内层上部、中部、下部),分别接种于MS基本培养基中,每处理20个,3次重复。连续观察鳞片诱导情况,培养10 d后统计污染率,60 d后统计诱导率。
1.2.4 不同激素浓度配比诱导不定芽
将百合鳞片接种在不同浓度6-BA(0.5、1、2 mg·L-1)和NAA(0.5、1mg·L-1)的MS培养基中,以不添加6-BA和NAA的MS基本培养基为对照。每处理25个完整鳞片,3次重复,观察鳞片诱导情况,60 d后统计诱导率。
诱导率(%)=(诱导不定芽外植体数/接种外植体数)×100%
1.2.5 不同激素浓度配比诱导增殖不定芽
将诱导出高2~3 cm不定芽接种到不同浓度6-BA(0.5、1、1.5mg·L-1)和NAA(0.05、0.1mg· L-1)MS培养基中。每处理接种80个不定芽,60 d后观察增殖生长情况,统计增殖系数。
增殖系数=增殖不定芽数/接种不定芽数
1.2.6 不同激素及浓度配比诱导试管苗生根
将增殖培养基中长至5 cm以上、尚未生根的健壮苗转入添加不同浓度NAA及IBA的1/2MS培养基中。每处理接种20株,3次重复。30 d后观察统计生根情况。
生根率(%)=(生根株数/接种株数)×100%平均单株生根数=生根总数/株数
2 结果与分析
2.1 不同消毒时间对新疆百合鳞片消毒效果影响
由表1可知,不同消毒时间的污染率和死亡率存在显著差异,随着消毒时间延长,污染率下降,死亡率上升。0.1%HgCl2消毒20min时,外植体污染率(7.22%)显著低于其他处理;其次为15min处理(10.55%);20min处理死亡率(25.55%)显著高于其他3个处理,15min处理(17.77%)和10min处理(14.99%)死亡率差异不显著。可知,选用0.1%HgCl2消毒15min为宜。
2.2 新疆百合鳞片不同部位对不定芽诱导影响
由表2可知,不同层及不同鳞片部位诱导不定芽能力差异较大。内层中部诱导率(48.08%)最高,显著高于其他处理,污染率(30.55%)较低。外层鳞片污染率最高,诱导率低于其他层。总体呈现规律为:同一层鳞片诱导能力为中部>下部>上部,同一部位鳞片诱导能力为内层>中层>外层。
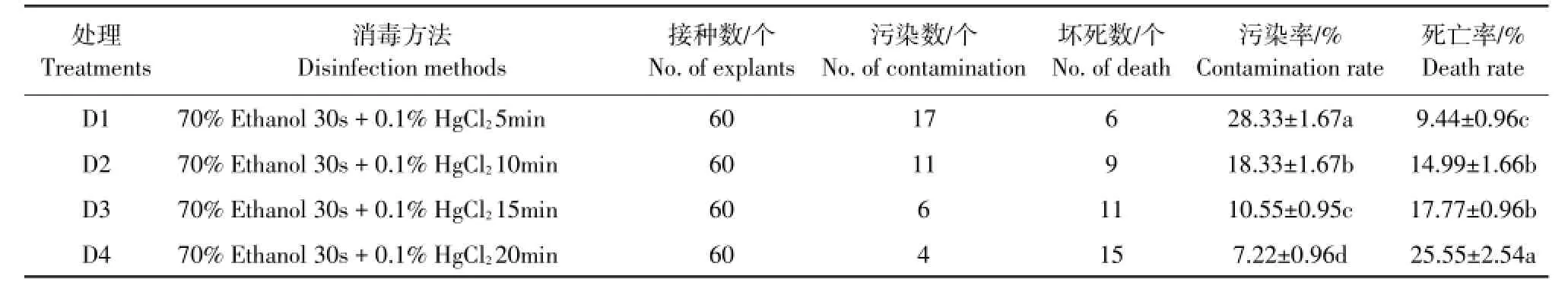
表1 不同消毒时间对新疆百合鳞片消毒效果影响Table1 Effectof different timeon disin fection of bu lb scales in Lilium martagon var.pilosiusculum
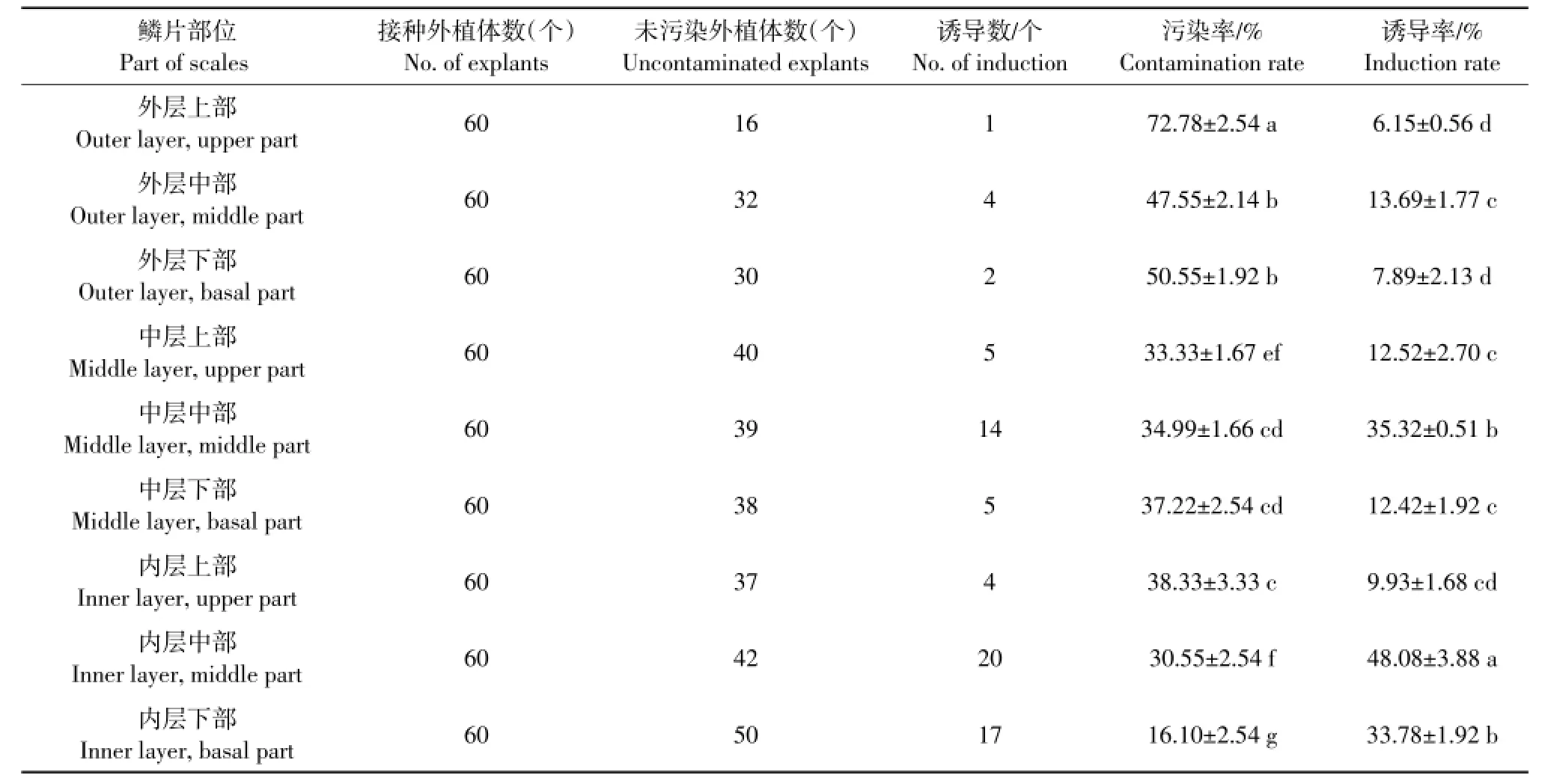
表2 新疆百合鳞片不同部位对不定芽诱导影响Table2 Effectof different positionsof bulb scaleson induction in Lilium martagon var.pilosiuscu lum
2.3 不同激素浓度配比对新疆百合鳞片诱导影响
将鳞片接种于培养基中(图1A),1周内开始膨大增厚,鳞片由黄白色变为绿色,部分切口边缘出现红褐色,2周内鳞片基部或边缘形成1个或几个白色小突起,30 d后白色小突起开始分化形成不定芽(图1B),60 d不定芽增殖成丛(图1C)。
不同激素配比对新疆百合鳞片诱导率影响见表3。由表3可知,各处理间差异较大,I4处理(MS+ 1mg·L-16-BA+1mg·L-1NAA)诱导率(78.66%)显著高于其他处理,其次为未添加NAA和6-BA对照组,而I1、I2、I3处理间差异不显著,分别为44.44%、39.99%和43.99%。I5处理诱导率(23.11%)显著低于其他处理。因此,新疆百合鳞片最适诱导培养基为MS+1mg·L-16-BA+1mg·L-1NAA。
2.4 不同激素浓度配比对新疆百合鳞片不定芽增殖影响
将不定芽接种至增殖培养基中,30 d长成高5~6 cm大苗(图1D)。
由表4可知,不同激素浓度配比对新疆百合试管苗增殖影响较大,其中G1处理(MS+0.5mg·L-16-BA+0.05mg·L-1NAA)增殖系数为3.46,显著高于其他处理,不定芽成簇生长,且苗生长健壮(图2A)。G2、G4和G6处理间差异不显著,增殖系数分别为2.51、2.25、2.59,长势一般(图2B、D、F)。G3和G5处理增殖系数较低,长势较弱,叶片较细(图2C、E)。
因此,新疆百合最适增殖培养基为MS+0.5 mg·L-16-BA+0.05mg·L-1NAA。
2.5 不同激素及浓度对新疆百合试管苗生根影响
将扩繁后获得的未生根试管苗转入不同激素及浓度生根培养基中,20 d根部出现白色突起。随后突起逐渐伸长,形成不定根,30 d左右不定根增长、变粗(图1E)。由表5可知,H7处理(1/2MS+ 0.2 mg·L-1NAA+0.2mg·L-1IBA)生根率(100%)显著高于其他处理,且植株健壮,平均生根数为17.0条;H8生根率为93.49%,长势良好,根多细长,平均生根数为16.6条;H2、H3、H4、H6处理间差异不显著,生根率在80%左右,长势一般,根较细。综上,最适生根培养基为1/2MS+0.2 mg·L-1NAA+0.2mg·L-1IBA(图3)。

图1 新疆百合鳞片离体培养过程Fig.1 Bu lb scales in vitro culture of L.martagon var.pilosiuscu lum
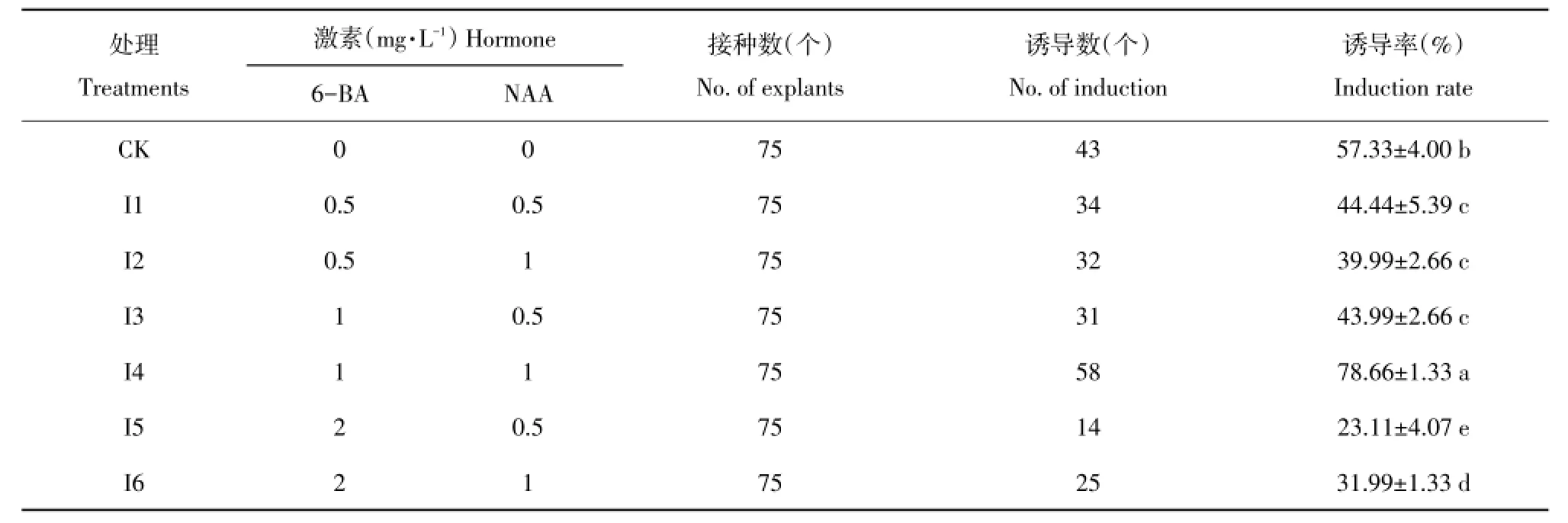
表3 不同激素浓度配比对新疆百合鳞片诱导影响Table 3 Effect of different hormone concentrationson scales induction of L.martagon var.pilosiusculum
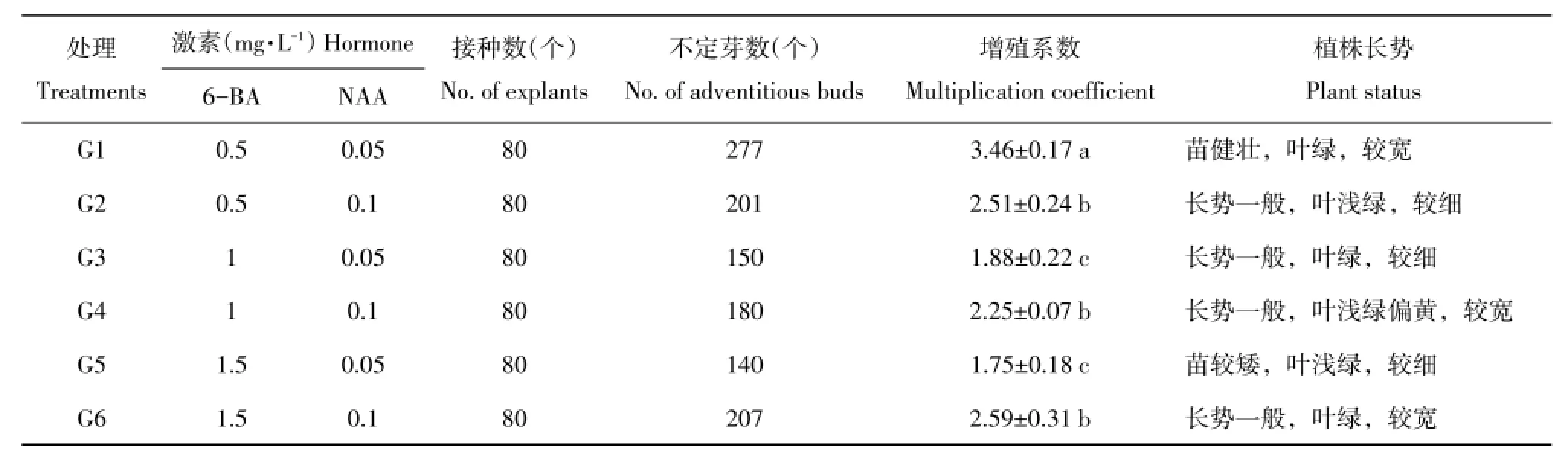
表4 不同激素浓度配比对新疆百合不定芽诱导增殖影响Table4 Effectsofdifferenthormone concentrationson the proliferation of bulb letsof L.martagon var.pilosiusculum

图2 不同培养基对新疆百合不定芽诱导增殖影响Fig.2 Effectsof different cu lturemedia on shoots regeneration of L.martagon var.pilosiusculum
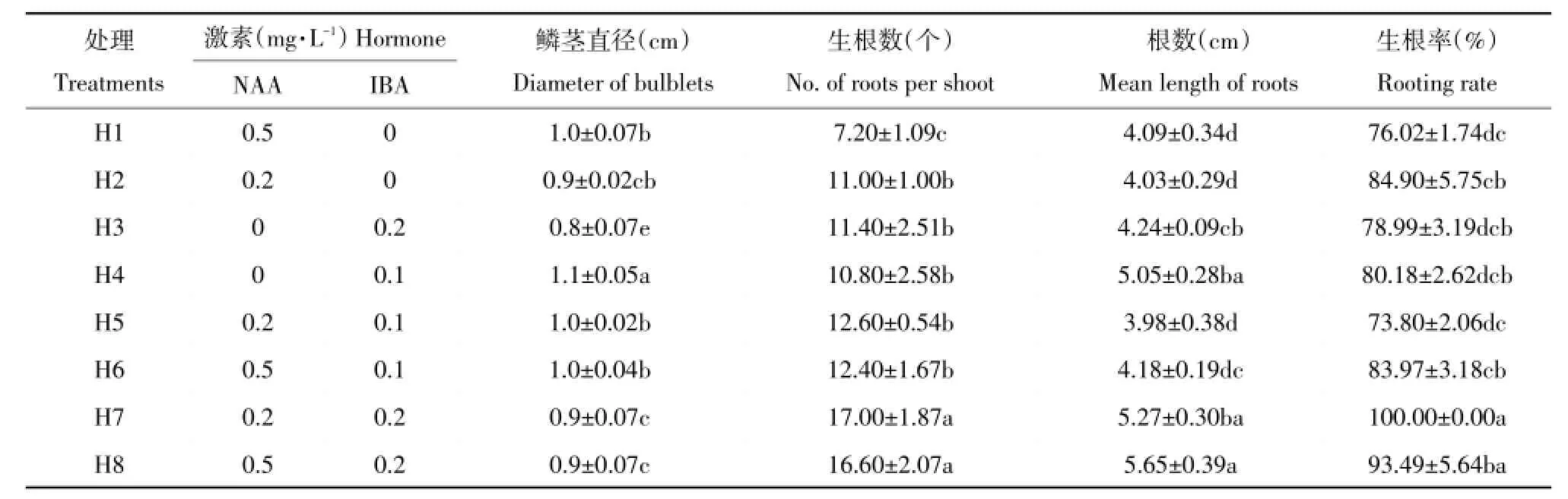
表5 不同激素及浓度配比对新疆百合试管苗生根影响Tab le 5 Effectsof different concentration of hormone on rooting of L.martagon var.pilosiuscu lum

图3 不同培养基对新疆百合试管苗生根影响Fig.3 Effectsofdifferent cu lturemedia on rooting of L.martagon var.pilosiusculum
3 讨论与结论
我国是百合属植物自然分布中心之一,有毛百合(Lilium dauricum)、台湾百合(L.formosanum)及新疆百合(L.martagon var.pilosiusculum)[11]等。野生百合原种是改良现代百合品种花色、香味、株型、抗性重要亲本。我国对野生百合资源利用较少,大量野生百合资源生境遭到严重破坏,濒临灭绝。组织培养技术具有快速繁殖特点,可应用于种质资源保存和利用[12-13]。新疆百合生长在高海拔、高纬度高山地区抗寒抗逆性强,为轮叶百合之一,花色艳丽,观赏及药用价值较高。因此,建立新疆百合高效离体繁殖技术具有重要意义。
目前,国内外学者已从激素浓度、外植体选择等方面对不同百合离体培养作系统研究,如麝香百合(L.longiflorum)[14]、青岛百合(L.tsingtauense)[15]、细叶百合(L.pumilum)[16]、兰州百合(L.davidii var. unicdor)[17]等。本试验以新疆百合鳞片为外植体,发现最适诱导培养基为MS+1mg·L-16-BA+1mg· L-1NAA,最适增殖培养基为MS+0.5mg·L-16-BA+0.05mg·L-1NAA,与垂花百合鳞片外植体最佳诱导培养基结果一致[7]。王冬梅等认为IBA具有较强生根作用,促生根多且细长,而NAA促生根少且粗[18]。本试验中,在1/2 MS培养基上添加0.2 mg·L-1IBA和0.2mg·L-1NAA生根率可达100%,且根数量多、质量好、驯化移栽成活率较高。储成才等试验表明朱顶红内层鳞片具有较高形态发生能力,由内向外逐渐降低[19]。本研究还发现新疆百合同一层鳞片不同部位诱导不定芽能力依次为中部>下部>上部,与Pan等在卷丹百合同层鳞片不同部位诱导能力依次为下部>中部>上部的试验结果不完全一致,可能与百合品种有关[20]。本研究建立新疆百合鳞片离体再生和快繁体系,可为其利用、保护奠定基础。
[1]帕里罕,马忠杰.新疆党参、新疆野百合、西北百合的质量考察[J].新疆中医药,2007,25(5):76-78.
[2]中国科学院植物志编辑委员会.中国植物志(第14卷)[M].北京:科学出版社,1980.
[3]Hussey G.Totipotency in tissue explants and callus of somemem⁃ bers of the Liliaceae,Iridaceae,and Amaryllidaceae[J].Journal of Experimental Botany,1975,26(2):253-262.
[4]罗凤霞,徐桂华,金丽丽,等.新铁炮百合微繁的研究[J].沈阳农业大学学报,2000,31(3):254-257.
[5]柳玉晶,龚束芳,樊金萍,等.百合愈伤组织的诱导及植株再生[J].东北农业大学学报,2007,38(3):352-355.
[6]王刚,杜捷,李桂英,等.兰州百合和野百合组织培养及快速繁殖研究[J].西北师范大学学报:自然科学版,2002,38(1):69-71.
[7]雷家军,徐莹.垂花百合离体培养研究[J].东北农业大学学报, 2013,44(1):96-100.
[8]雷家军,潘玲立.东北百合鳞片离体培养研究[J].沈阳农业大学学报,2009,40(5):532-535.
[9]孙旭才,冯春光,黄春燕,等.细叶百合组培继代培养与生根移栽的研究[J].河北林果研究,2008,23(2):211-213.
[10]王中轩,魏迟,廉玉芹,等.中国原产4种野生百合的核型分析[J].园艺学报,2013,40(11):2207-2212.
[11]龙雅宜,张金政,张兰年.百合—球根花卉之王[M].北京:金盾出版社,1999.
[12]Villalobos VM,Engelmann F.Ex situ conservation of p lantgerm⁃plasm using biotechnology[J].World Journal of Microbiology and Biotechnology,1995,11(4):375-382.
[13]傅伊倩.几种野生百合离体保存技术的研究[D].北京:北京林业大学,2012.
[14]Arzate-Fernandez A M,Nakazaki T,Okumoto Y,et al.Efficient callus induction and plant regeneration from filamentswith anther in lily(Lilium longiflorum Thunb.)[J].Plant Cell Reports,1997, 16(12):836-840.
[15]齐春敏,王奎玲,刘庆超,等.青岛百合组织培养研究[J].中国农学通报,2008,24(4):85-88.
[16]葛蓓孛.细叶百合组织培养及多倍体诱导研究[D].哈尔滨:东北林业大学,2010.
[17]段超.几种百合组织培养及多倍体育种技术的研究[D].北京:北京林业大学,2009.
[18]王冬梅,黄学林.细胞分裂素类物质在植物组织培养中的作用机制[J].植物生理学通讯,1996,32(5):373-377.
[19]储成才,李大卫.不同培养条件对朱顶红形态发生的影响[J].信阳师范学院学报:自然科学学版,1991,4(1):85-89.
[20]Pan Y Z,Zhao JP,Zeng X M,etal.Study on tissue culture and rapid propagation of wild Lilium lancifolium[J].Medicinal Plant, 2011,2(7):69-71.
Study on culture in vitro of scales in Lilium m artagon var.pilosiusculum/
WANG Yanan,XUE Li,LEIJiajun
(School of Horticulture,Shenyang Agricu ltural University,Shenyang 110866,China)
To deve lop a suitable app roach for the rapid propagation o f Lilium martagon var. pilosiusculum by tissue culture,scales were tried as the exp lants in this paper.The results showed that the bestdisinfectionmethod to the bulb scale exp lants was 70%ethanol for 30 s,followed by 0.1%HgCl2for 15 m in.The suitablemedium for induction was MS+1mg·L-16-BA+1mg·L-1NAA.The induction rate scale was ranked with the orders of inner layer>m iddle layer>outer layer andm iddle part>basalpart>upperpart.MS+ 0.5 mg·L-16-BA+0.05 mg·L-1NAA was the optimal subculture medium w ith 3.46 multip lication coefficient. The suitab le rootingmedium was 1/2 MS+0.2m g·L-1NAA+0.2mg·L-1IBAw ith a rooting rate o f100%.
Lilium martagon var.pilosiusculum;tissue culture;scale
S682.2+9
A
1005-9369(2017)04-0030-06
时间2017-4-24 6:19:44[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170424.0619.006.html
2017-01-03
辽宁省教育厅基金项目(202053092)
王雅楠(1992-),女,硕士研究生,研究方向为观赏植物遗传育种。E-mail:yanansunnyy@163.com
*通讯作者:雷家军,教授,博士生导师,研究方向为观赏植物遗传育种。E-mail:jiajunleisy@163.com
