表观扩散系数在非小细胞肺癌酪氨酸激酶抑制剂治疗效果评价中的应用
2017-05-11郑雪萍
郑雪萍
马明平2 MA Mingping
黄劲柏1 HUANG Jinbai
俞 顺2 YU Shun
表观扩散系数在非小细胞肺癌酪氨酸激酶抑制剂治疗效果评价中的应用
郑雪萍1ZHENG Xueping
马明平2MA Mingping
黄劲柏1HUANG Jinbai
俞 顺2YU Shun
非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的75%~80%,患者就诊时多为晚期或已发生转移。既往研究证明,单独应用靶向药在提高治疗效果以及无疾病进展生存期(progression-free survival,PFS)方面有显著疗效[1-2],厄洛替尼或克唑替尼等已获得FDA批准用于治疗高级别或有转移的NSCLC[3]。尽管表皮生长因子受体(epidermal growth factor receptor,EGFR)或间变淋巴瘤激酶(anaplastic lymphoma kinase,ALK)突变阳性被认为是酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)治疗预后的有效判断标准[4-5],但是部分患者因为耐药性的出现,病情会不同程度地进展或复发[6-7]。另外,临床普遍认为,提高生存期(如PFS)是作为临床试验是否获益的“金标准”,但是作为一个需要长期观察的最终结果,它不适用于早期判断治疗方案是否有效。此外,由于肿瘤的异质性,并非所有特定类型的肿瘤均适用于推荐的治疗方案[8]。这就迫切需要一个可靠、准确而又能早期评估和预测肿瘤治疗效果的方法,为临床制订个体化治疗方案奠定基础。本研究探索DWI技术中ADC值在NSCLC靶向治疗效果评估中的价值。
1 资料与方法
1.1 研究对象 收集福建省立医院2014年5月-2015年12月经病理证实并接受TKI治疗的IIIB期或IV期NSCLC患者进行前瞻性研究。所有患者在靶向治疗前1周内、治疗后1周、治疗后4周时各进行1次MRI检查及CT平扫检查。共纳入19例患者,年龄46~69岁,平均(57.7±1.7)岁,男11例,女8例;其中15例患者为腺癌,3例为鳞癌,1例为大细胞癌;临床分期:IIIB期7例,IV期12例;EGFR基因19号外显子缺失7例,21号外显子L858基因突变9例,3例为EML4-ALK融合基因突变;发病部位:右肺上叶3例、中叶2例、下叶3例,左肺上叶8例、下叶3例。1例患者完成2次MRI检查,于治疗后第3周死亡,与脑转移瘤破裂出血、破入脑室系统、合并蛛网膜下腔出血有关;余18例患者完成了3次MRI及CT检查。本研究通过伦理委员会审核,所有患者知情同意。
1.2 纳入及排除标准 ①CT或PET/CT扫描示肺内病变最长横截面直径≥2 cm;②治疗前经穿刺活检或支气管镜证实为NSCLC并通过基因检测分析适合TKI靶向治疗的患者;③检查前均未接受放疗、化疗、射频、靶向药物治疗及外科手术治疗;④预期寿命≥4周并能够接受分子靶向治疗和随访;⑤能配合完成MRI检查,能均匀、规律呼吸并较好地屏气,且单次憋气时间≥16 s。排除标准:①单次耐受屏气时间<16 s而致图像伪影严重者;②体内有金属或植入物或患有幽闭恐惧症等MRI检查禁忌证患者;③各种原因导致的MRI扫描图像质量差,严重影响图像分析及诊断的患者。
1.3 靶向治疗方案 依据基因检测结果,本组患者均一线使用TKI,包括:EGFR-TKI,其中采用盐酸埃克替尼患者2例,每次125 mg口服,每天3次;采用盐酸厄洛替尼患者6例,每次150 mg口服,每天1次;采用吉非替尼患者8例,每次250 mg口服,每天1次;另一类为针对ALK基因突变的克唑替尼,服用克唑替尼的NSCLC患者3例,每次250 mg口服,每天2次。所有患者均为初次接受靶向治疗,持续用药至病程进展或出现不能耐受的不良反应。患者于治疗期间定期复查血常规、肝、肾功能及心电图。
1.4 仪器与方法 采用Siemens 1.5T超导型MR仪及64层螺旋CT机(Somatom sensation,Siemen,Germany)进行扫描。为减少呼吸运动伪影,于检查前半小时训练患者均匀一致的呼吸,并使屏气时间达到16 s。检查时患者取仰卧位,头先进,双手平放于身体两侧。MRI扫描参数:T2WI 冠状位扫描:TR 1400 ms,TE 92 ms,层厚6.0 mm,层间距1.2 mm,视野380 mm×380 mm,激励次数1,矩阵256×256,扫描时间39 s;T1WI 横断位扫描:TR 172 ms,TE 4.86 ms,层厚6 mm,层间距1.2 mm,视野 380 mm×296 mm,激励次数1,矩阵320×224,扫描时间34 s;T2WI横断位扫描:TR 2000 ms,TE 100 ms,层厚6.0 mm,层间距1.2 mm,视野380 mm×296 mm,激励次数 1,矩阵448×314,扫描时间2 min 55 s;DWI 横断位扫描采用EPI序列,采用呼吸导航回波技术进行DWI 序列图像扫描,b值取50、1000 s/mm2。DWI:TR 5800 ms,TE 57 ms,层厚6.0 mm,层间距 1.2 mm,激励次数1,视野380 mm× 296 mm,矩阵166×132,扫描时间3 min 6 s。
CT扫描:患者取仰卧位,双手交叉置于头顶,扫描范围从肺尖到肺底,吸气末屏气开始扫描,管电压120 kV,管电流150 mAs,螺距1.0,视野320 mm×320 mm,矩阵512×512,层厚10 mm,肺窗经高密度骨算法重建层厚为1 mm、层间距1 mm的图像。
1.5 图像分析 记录者于每个时间点观察测量肿瘤,内容包括:于CT图像上观察肿瘤的部位、数目、解剖学特点,以及轴位最大直径;直径变化率=(治疗前最大径-治疗后最大径)/治疗前最大径×100%。由2名主治医师采用双盲法测量,结合常规T2WI轴位图像及DWI图像,选择病变最大横截面,在ADC图上选取2~3个感兴趣区(ROI),置于病变的实性部位且信号较均匀处,尽量避开囊变、坏死及钙化、血管区域,每个ROI面积约为0.3~0.5 cm2,计算其ADC平均值作为最终测量值。ADCmap的伪彩图中蓝色表示ADC值较低的区域,红色表示ADC值较高的区域,色阶范围由红向黄、绿、蓝色逐渐过渡来反映ADC值由高到低的分布情况。以相同方法测量同层面双侧背阔肌的信号特点及ADC值,取两者的平均值作为当次ADC值。平均ADC值变化率=(治疗前测量平均值-治疗后测量平均值)/治疗前测量平均值×100%。
1.6 疗效评价及分组方法 以靶向治疗4周后CT图像横轴位上的最大径变化率为标准,最大径变化率=(治疗前最大长径-治疗后最大长径)/治疗前最大长径×100%。参照RECIST[9]标准,疗效分为:①完全缓解:病灶完全消失;②部分缓解:病灶最长径与靶向治疗前相比,至少减少30%;③疾病稳定:介于部分缓解和疾病进展之间;④疾病进展:病灶最大径增加20%或出现1个或多个新病灶。其中疾病进展为无效组,其余均为有效组。
1.7 统计学方法 采用SPSS 18.0软件。靶向治疗前后肿瘤平均ADC值和肿瘤最大径比较采用配对样本t检验,各时期肿瘤平均ADC值与肿瘤最大径、最大径变化率的相关性采用Pearson相关分析,各个时间点所测得ADC值的组内和组间比较采用重复测量方差分析,2名操作者ADC值测量的一致性采用Bland-Altman分析,P<0.05表示差异有统计学意义。
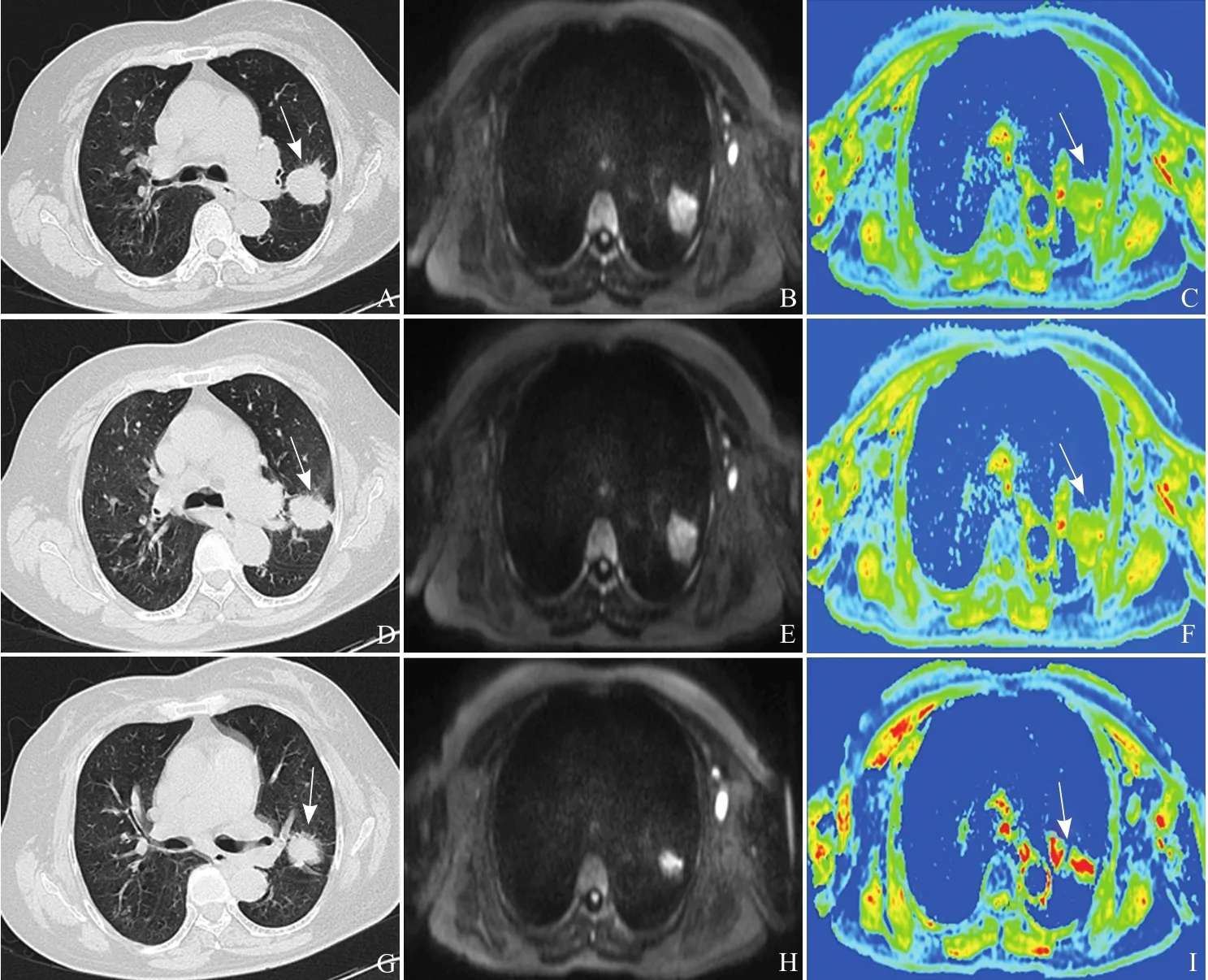
图1 女,64岁,左肺上叶腺癌,IV期,EGFR基因21号外显子L858R突变,盐酸厄洛替尼(特罗凯)治疗有效(RECIST标准)。A~C为治疗前的CT、DWI及ADC图,D~F为治疗1周后的对应图像,G~I为治疗4周后的对应图像。CT图像(A、D、G)显示左肺上叶的肿块(箭)最大径缩小,DWI图像(B、E、H)显示肿块呈高信号,ADC图上绿色为主(箭,C)的病灶中逐渐出现黄色(箭,F)或红色区域(箭,I)
2 结果
2.1 靶向治疗前后图像变化 治疗前,肿瘤在CT图像上表现为团块状密度增高影,有分叶征及长短毛刺征,在DWI图像上均为高信号,在ADC图像上多以绿色、蓝色图像为主。有效组病例(图1)在治疗1周后CT图像上肿瘤最大径无明显变化,在DWI图像上仍呈高信号,在ADC图像上出现黄色或偏红色区域,表明该区域ADC值升高。在治疗4周后肿瘤直径减小,DWI图像显示缩小的病灶仍呈高信号,ADC图像上肿瘤部分区域出现明显红色。无效组病例(图2)CT图像上病灶最大径始终无明显变化,ADC图像上病灶始终以绿色和蓝色为主,变化不明显。同层面双侧胸背部肌肉以黄、红色为主。
2.2 各时期肿瘤最大径与肿瘤ADC值、ADC值变化率之间的关系
2.2.1 NSCLC靶向治疗前后ADC值及最大径的比较表1为各个时间点所测肿瘤及双侧背阔肌ADC值、肿瘤最大径以及相应变化率。结果显示治疗1周后ADC值较治疗前显著增加(t=-6.329,P<0.05)。治疗1周后肿瘤最大径较治疗前无显著变化(t=1.281,P>0.05)。治疗4周后与治疗前相比,ADC值显著升高(t=-4.878,P<0.05)。治疗4周后肿瘤最大径较治疗前显著减小(t=7.054,P<0.05)。18例患者各个时间点肿瘤同层面的双侧背阔肌ADC值比较,差异无统计学意义(P>0.05)。
2.2.2 ADC值及ADC值变化率与肿瘤最大径变化率的相关性 除肿瘤各个时间点的最大径外,其余变量均符合正态分布。靶向治疗前肿瘤ADC值与治疗4周后最大径变化率呈负相关(r2=-0.474,P<0.05),见图3。而其余变量间均无显著相关性。
2.2.3 各时间点两组ADC值组内和组间比较 有效组或无效组内各时间点的ADC值差异见图4。有效组内,靶向治疗前与治疗后1周相比,ADC值显著增加(P<0.05),治疗4周后有效组ADC值与无效组相比,差异有统计学意义(P<0.05)。
2.2.4 一致性评价 2名操作者所测肿瘤ADC值差值的均值为0.0048×10-3mm2/s,标准差为0.0295×10-3mm2/s,接近0。由图5可见,有5.4%(6/110)的点在95%一致性界限之外,一致性界限内差值的绝对值最大为0.06×10-3mm2/s,2名操作者测得ADC的均值为1.379×10-3mm2/s,这种相差的幅度在临床上可以接受,说明2名操作者间一致性好。
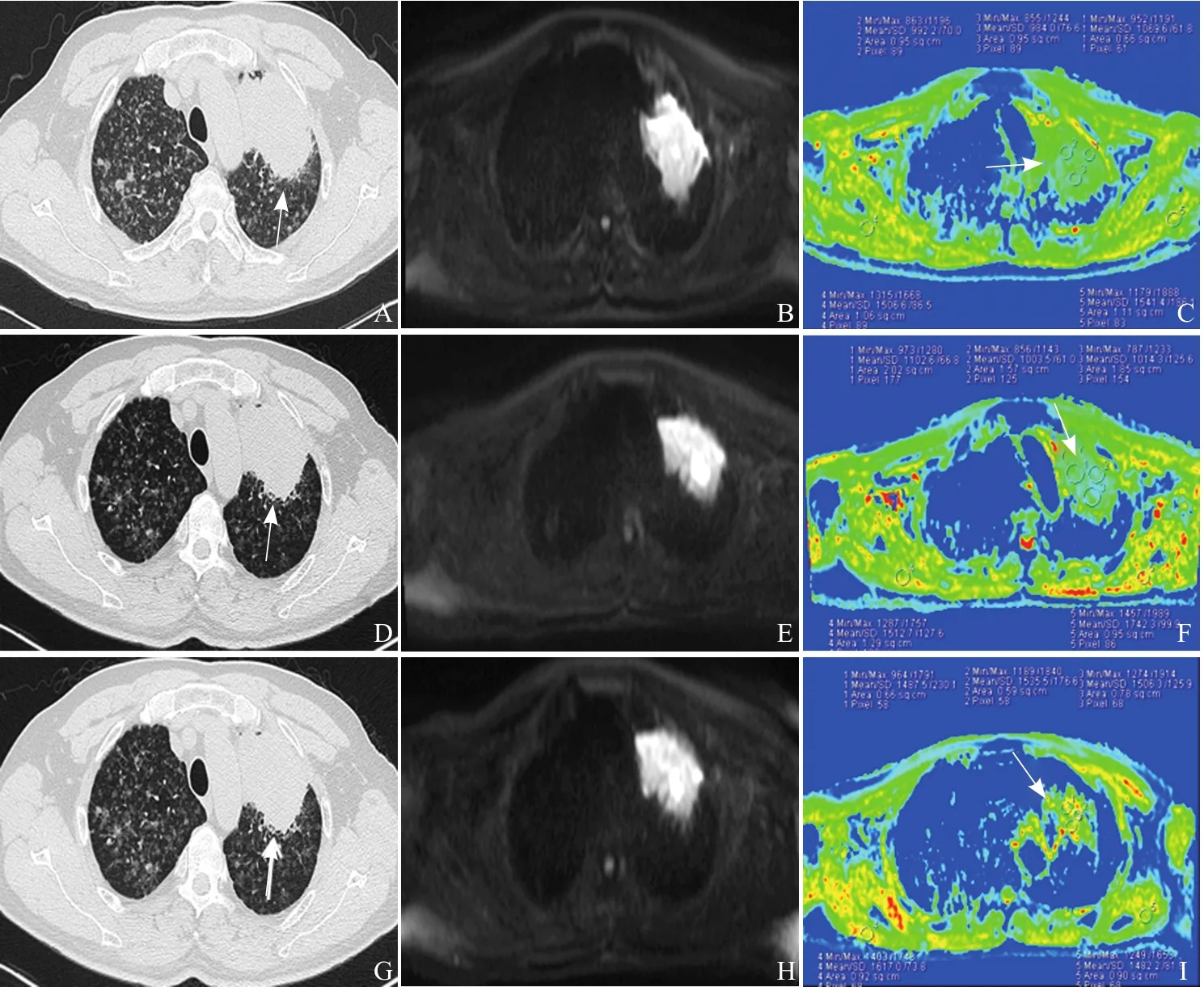
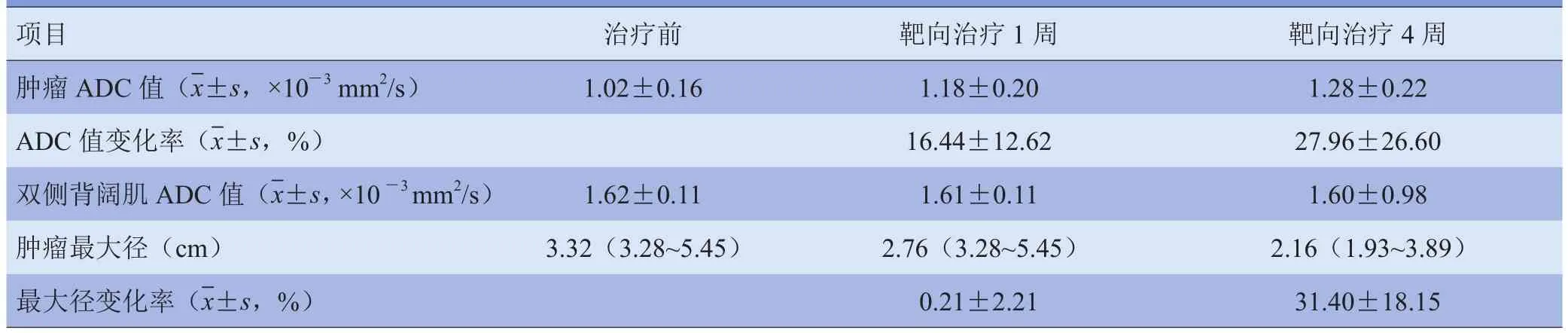
表1 各个时间点所测肿瘤及双侧背阔肌ADC值、肿瘤最大径、变化率比较
3 讨论
传统的肿瘤治疗效果的评价基于治疗过程中形态学的改变,存在许多局限性,如医师测量之间的差异、肿瘤形态改变的不规则性均难以测量,且肿瘤的形态改变均显著滞后于其分子生物学改变[10-11]。DWI以及DCE-MRI能够同时检测肿瘤病理生理及形态学改变,能够反映肿瘤内部微环境和组织细胞结构或者灌注等的改变,具有评估及预测肿瘤治疗效果的巨大潜力。
本研究收集18例晚期接受TKI治疗的NSCLC患者,研究其治疗前后ADC值的改变。治疗1周后ADC值较治疗前显著增加(P<0.05),而治疗1周后肿瘤最大径与治疗前最大径差异无统计学意义(P>0.05)。将18例患者按照RECIST标准分为有效组及无效组后,有效组内ADC值在靶向治疗1周后可见显著增加,而最大径无显著变化,表明ADC值的改变早于形态学改变,反映了形态学变化的滞后性,同时也表明RECIST标准的局限性。其原因为,肿瘤细胞坏死凋亡细胞密度减小,细胞外体积增加,并且肿瘤新生血管形成减少,坏死组织吸收,上述改变导致细胞外水分子运动加剧以及ADC值升高。然而,上述改变并不足以引起显著的形态学减小,甚至有增大的可能[12]。这些结果与既往研究结果相符[13-16]。患者可以在ADC值的监测下观察肿瘤的治疗反应。在靶向治疗前和治疗1周后,有效组及无效组间的ADC值无显著差异,而在靶向治疗4周后两组间ADC值有显著差异,表明两组NSCLC患者对TKI治疗的敏感性不同,可能因为有效组内肿瘤产生坏死囊变较无效组更多、更彻底[12],表明ADC值能够在细胞水平反映靶向治疗有效时肿瘤内部的变化,ADC值的改变能够区分两组NSCLC应用TKI时的敏感性。
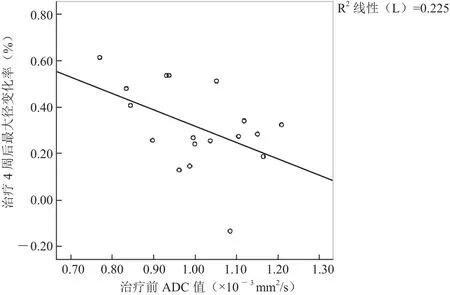
图3 治疗前肿瘤ADC值与治疗4周后最大径变化率的相关性
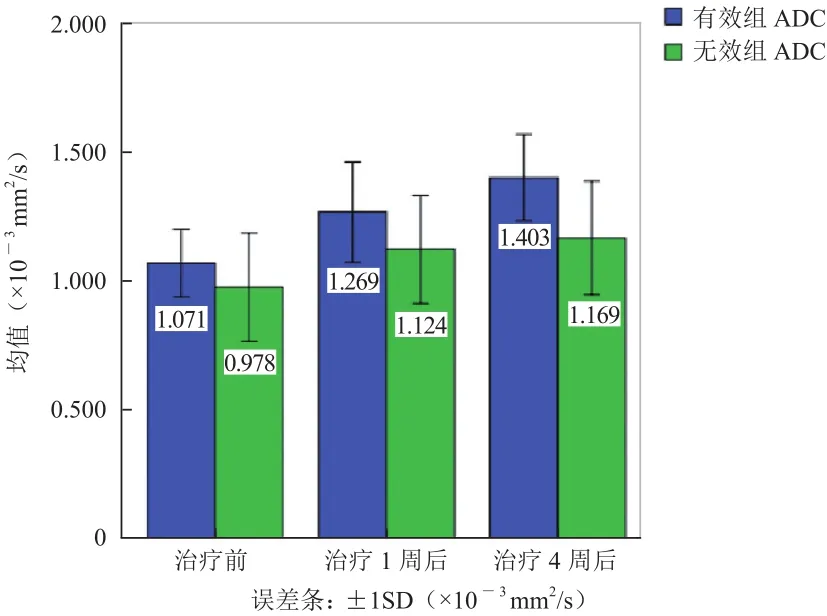
图4 有效组及无效组各时间点ADC值的比较,方框内数值为均值
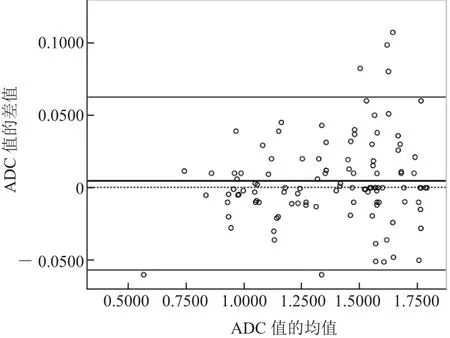
图5 2名操作者所测ADC值一致性的Bland-Altman分析。图中虚线表示中位数0,较粗的Y轴参考线表示均数,另2条Y轴参考线表示95%一致性界限的上下限
另一方面,治疗前ADC值与靶向治疗4周后最大径变化率呈显著负相关,ADC值越高,形态学改变越小,说明ADC值具有预测应用TKI治疗NSCLC疗效的潜在价值。本研究结果与直肠癌等其他的体部肿瘤[17]的研究结果相似,可能因为ADC值越高囊变坏死程度越重,血供较少,阻断了靶向药物的到达。靶向治疗1周后的ADC值与治疗4周后的最大径变化率无相关性,与Yabuuchi等[16]的研究结果相左。Yabuuchi等[16]研究发现,化疗1周的ADC变化率与化疗2个周期后(约6~8周后)的最大径变化率显著相关,其原因可能与本研究病例量较少,且选择的治疗方案不同有关。
目前,对于观察疗效时间点的选择尚无统一标准。Sunaga等[18]于吉非替尼治疗NSCLC患者2 d后观察到18F-氟脱氧葡萄糖摄取值减少,表明吉非替尼治疗后早在2 d内即可发生分子生物学等方面的变化。结合患者临床配合程度,本研究认为最早选择治疗前1周内、治疗1周后以及治疗4周后观察ADC值的变化具有合理性。Bland-Altman法测得各个时间点的ADC差值均非常小,接近0,表明2名操作者之间的一致性较好,变异率较小,可重复性高,提示ADC值是有效的并可以重复测量的评估肿瘤治疗效果的影像学标记,Monguzzi等[19]、Kwee等[20]分别在研究直肠癌、食管癌的过程中得出相似结论,有力支撑本研究结果。
DWI技术应用于肺部,采用EPI技术结合呼吸触发、相位导航及并行成像技术,在自由呼吸状态下扫描,具有较高的图像质量,相对清晰的解剖学特征,能够减少呼吸运动伪影及部分容积效应,ADC值更准确。然而心跳伪影始终不能忽视,本研究采用回顾性心电门控技术控制心跳搏动的伪影,效果较好。
本研究的局限性:①本研究病例数较少,选择观察疗效的时间点较少,观察时间较短,未对患者生存期等指标进行随访和相关性分析,可能对结果有一定的影响,因此还需要扩大样本量、延长观察随访时间进行深入分析和研究。②本研究尚未对肺鳞癌、腺癌和腺泡癌作进一步分析,对于靶向药没有统一选择,单独应用同一种药物的病例数过少,无法单独分析某一种药物对某一确定病理类型的疗效。③各研究机构的成像参数和序列的后处理系统的差异以及测量时的误差,使ADC值测量的重复性存在一定差异性,因而还需制订一个统一准确的ADC值参考值。
今后将通过更大样本的研究,在尽量小选择偏倚的基础上,进一步对某一病理类型,确定使用某一种靶向药进行分析;并结合伪彩图,尽量减小ADC值的测量误差,提高测量值的可重复性。
[1]Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med, 2010, 362(25): 2380-2388.
[2]Mok TS, Wu YL, Thongprasert S, et al. Ge fi tinib or carboplatinpaclitaxel in pulmonary adenocarcinoma. N Engl J Med, 2009, 361(10): 947-957.
[3]Thomas A, Rajan A, Giaccone G. Tyrosine kinase inhibitors in lung cancer. Hematol Oncol Clin North Am, 2012, 26(3): 589-605.
[4]Martínez-Navarro EM, Rebollo J, González-Manzano R, et al. Epidermal growth factor receptor (EGFR) mutations in a series of non-small-cell lung cancer (NSCLC) patients and response rate to EGFR-speci fi c tyrosine kinase inhibitors (TKIs). Clin Transl Oncol, 2011, 13(11): 812-818.
[5]Blackhall FH, Peters S, Bubendorf L, et al. Prevalence and clinical outcomes for patients with ALK-positive resected stage I to III adenocarcinoma: results from the european thoracic oncology platform lungscape project. J Clin Oncol, 2014, 32(25): 2780-2787.
[6]Chang A. Chemotherapy, chemoresistance and the changing treatment landscape for NSCLC. Lung Cancer, 2011, 71(1): 3-10.
[7]Jackman DM, Yeap BY, Lindeman Neal-I, et al. Phase II clinical trial of chemotherapy-naive patients>or=70 years of age treated with erlotinib for advanced non-small-cell lung cancer. J Clin Oncol, 2007, 25(7): 760-766.
[8]Harry VN, Semple SI, Parkin DE, et al. Use of new imaging techniques to predict tumour response to therapy. Lancet Oncol, 2010, 11(1): 92-102.
[9]Barbaro B, Vitale R, Valentini V, et al. Diffusion-weighted magnetic resonance imaging in monitoring rectal cancer response to neoadjuvant chemoradiotherapy. Int J Radiat Oncol Biol Phys, 2012, 83(2): 594-599.
[10]Mileshkin L, Hicks RJ, Hughes BG, et al. Changes in 18F-fluorodeoxyglucose and18F-fluorodeoxythymidine positron emission tomography imaging in patients with nonsmall cell lung cancer treated with erlotinib. Clin Cancer Res, 2011, 17(10): 3304-3315.
[11]Tang L, Zhang XP, Sun YS, et al. Gastrointestinal stromal tumors treated with imatinib mesylate: apparent diffusion coefficient in the evaluation of therapy response in patients. Radiology, 2011, 258(3): 729-738.
[12]Padhani AR, Liu G, Koh DM, et al. Diffusion-weighted magnetic resonance imaging as a cancer biomarker: consensus and recommendations. Neoplasia, 2009, 11(2): 102-125.
[13]巴照贵, 杨涛, 张玉敏, 等. 表观扩散系数对非小细胞肺癌早期放化疗疗效的评估. 实用放射学杂志, 2012, 28(8): 1200-1203, 1210.
[14]蒋洁智, 李鹍, 李卓琳, 等. 磁共振扩散加权成像早期预测肺癌化疗疗效的价值. 放射学实践, 2014, 29(8): 929-932.
[15]Zhou R, Yu T, Feng C, et al. Diffusion-weighted imaging for assessment of lung cancer response to chemotherapy. Zhongguo Fei Ai Za Zhi, 2011, 14(3): 256-260.
[16]Yabuuchi H, Hatakenaka M, Takayama K, et al. Non-small cell lung cancer: detection of early response to chemotherapy by using contrast-enhanced dynamic and diffusion-weighted MR imaging. Radiology, 2011, 261(2): 598-604.
[17]Sun YS, Zhang XP, Tang L, et al. Locally advanced rectal carcinoma treated with preoperative chemotherapy and radiation therapy: preliminary analysis of diffusion-weighted MR imaging for early detection of tumor histopathologic downstaging. Radiology, 2010, 254(1): 170-178.
[18]Sunaga N, Oriuchi N, Kaira K, et al. Usefulness of FDG-PET for early prediction of the response to gefitinib in non-small cell lung cancer. Lung Cancer, 2008, 59(2): 203-210.
[19]Monguzzi L, Ippolito D, Bernasconi DP, et al. Locally advanced rectal cancer: value of ADC mapping in prediction of tumor response to radiochemotherapy. Eur J Radiol, 2013, 82(2): 234-240.
[20]Kwee RM, Dik AK, Sosef MN, et al. Interobserver reproducibility of diffusion-weighted MRI in monitoring tumor response to neoadjuvant therapy in esophageal cancer. PLoS One, 2014, 9(4): e92211.
(本文编辑 张晓舟)
Apparent Diffusion Coef fi cient in Assessing Early Response to Tyrosine Kinase Inhibitors in Non-small Cell Lung Cancer
目的研究扩散加权成像(DWI)技术中表观扩散系数(ADC)值在非小细胞肺癌(NSCLC)应用酪氨酸激酶抑制剂(TKI)治疗效果评估中的价值。资料与方法前瞻性收集2014年5月-2015年12月经病理证实的19例拟接受TKI的晚期NSCLC患者,于靶向治疗前、治疗1周后以及治疗4周后进行3次CT及MRI扫描,比较不同时间点肿瘤长径、平均ADC值的变化;分析不同时间点肿瘤平均ADC值与肿瘤最大径及最大径变化率的相关性;比较有效组及无效组各个时间点ADC值组内及组间差异。用Bland-Altman分析法分析操作的可重复性。结果治疗1周后ADC值较治疗前显著增加(t=-6.329,P<0.05),而治疗1周后肿瘤最大径与治疗前差异无统计学意义(P>0.05)。与治疗前相比,治疗4周后ADC值明显升高(t=-4.878,P<0.05),肿瘤最大径与治疗前差异有统计学意义(t=7.054,P<0.05)。靶向治疗前肿瘤ADC值与治疗4周后的最大径变化率呈负相关(r2=-0.474,P<0.05)。有效组内靶向治疗前与治疗1周后ADC值差异有统计学意义(P<0.05),治疗4周后有效组与无效组间ADC值差异有统计学意义(P<0.05)。Bland-Altman分析显示操作者间可重复性好。结论靶向治疗1周后的ADC值能较肿瘤最大径更敏感地反映肿瘤治疗后的改变,并且治疗前的ADC值在预测靶向治疗4周后的最大径变化趋势方面有一定的价值,具有可重复性。
癌,非小细胞肺;磁共振成像;扩散加权成像;表观扩散系数;体层摄影术,螺旋计算机;蛋白酪氨酸激酶类;蛋白激酶抑制剂;治疗结果
PurposeTo investigate the value of apparent diffusion coef fi cient (ADC) of diffusion weighted imaging (DWI) in the evaluation of the ef fi cacy of treatment of nonsmall cell lung cancer (NSCLC) with tyrosine kinase inhibitor (TKI).Materials and MethodsNineteen patients with advanced NSCLC who treated with TKIs from May 2014 to December 2015 were recruited prospectively. All patients underwent CT and MRI scans three times before targeted therapy, after 1 week and 4 weeks of treatment. The tumor maximal diameter and mean ADC value at different time points were compared. The correlations between mean ADC value and tumor maximal diameter and maximum diameter change rate at different time points were analyzed. Bland-Altman analysis was performed to con fi rm the reproducibility of measurements.ResultsThe ADC value after 1 week of treatment was signi fi cantly increased compared with that before treatment (t=-6.329,P<0.05), but the change of tumor maximal diameter was not signi fi cant (P>0.05). The ADC value was signi fi cantly increased after 4 weeks of treatment compared with that before treatment (t=-4.878,P<0.05), and the change of tumor maximal diameter was also signi fi cant (t=7.054,P<0.05). The negative correlation was detected between the ADC before treatment and the maximal diameter change ratio after 4 weeks of treatment (r2=-0.474,P<0.05). In the group of responders, there was signi fi cant difference between the ADC value before treatment and 1 week after treatment (P<0.05). There was signi fi cant difference in ADC value between the groups of responders and non-responders after 4 weeks of treatment (P<0.05). The Bland-Altman analysis showed good reproducibility among the operators.ConclusionThe ADC value after 1 week of targeted therapy is more sensitive to the change of tumor than the maximal diameter, and the ADC value before treatment has a certain value in predicting the maximum diameters of the target after 4 weeks of targeted therapy with repeatability.
Carcinoma, non-small-cell lung; Magnetic resonance imaging; Diffusion weighted imaging; Apparent diffusion coef fi cient; Tomography, spiral computed; Proteintyrosine kinases; Protein kinase inhibitors; Treatment outcome
10.3969/j.issn.1005-5185.2017.04.006
1. 荆州市第一人民医院放射科 湖北荆州434400
2.福建省立医院放射科 福建福州 350001
马明平
Department of Radiology, Fujian Provincal Hospital, Fuzhou 350001, China
Address Correspondence to:MA Mingping
E-mail: 15859043670@163.com
福建省中青年骨干人才培养项目(2013-ZQN-JC-5)。
R445.2;R734
2016-12-25
修回日期: 2017-02-08
中国医学影像学杂志
2017年 第25卷 第4期:264-269
Chinese Journal of Medical Imaging
2017 Volume 25 (4): 264-269
