栝楼种子萌发期总黄酮含量变化研究
2017-05-10霍立群张文霞辛杰张永清李佳刘红燕
霍立群,张文霞,辛杰,张永清,李佳,刘红燕
(山东中医药大学,山东 济南 250355)
【中药与天然活性产物】
栝楼种子萌发期总黄酮含量变化研究
霍立群,张文霞,辛杰,张永清,李佳*,刘红燕
(山东中医药大学,山东 济南 250355)
采用超声辅助提取的方法,研究栝楼种子吸胀前期、吸胀期、萌动期、胚根伸长期、萌芽期及幼苗期6个时期的总黄酮含量及变化规律。各萌发阶段的栝楼种子经石油醚脱脂后,以体积分数70%乙醇溶液为溶剂,采用超声辅助提取法提取总黄酮,以芦丁为标准品,采用比色法测定各萌发阶段栝楼种子总黄酮含量。结果表明,栝楼种子中总黄酮含量较低,约为1 mg/g,整个萌发阶段总黄酮含量呈现先下降后上升的趋势,至幼苗期总黄酮含量已达2.7 mg/g。本研究为进一步认识及开发利用栝楼种子提供了参考,为人工调控栝楼种子中总黄酮含量提供了理论依据。
栝楼种子;萌发过程;总黄酮
瓜蒌子为葫芦科植物栝楼(TrichosantheskirilowiiMaxim.)或双边栝楼(TrichosanthesrosthorniiHarms)的干燥成熟种子,具有润肺化痰、滑肠通便的功效,主要用于治疗燥咳痰黏、肠燥便秘[1]。瓜蒌子中富含油脂、甾醇、三萜及其苷、蛋白质、多种氨基酸、维生素,以及钙、铁、锌、硒等16种无机元素[2]。目前关于瓜蒌子油脂、皂苷、氨基酸等成分研究的较多,而对黄酮的研究报道较少。
黄酮类化合物广泛存在于自然界植物体内,属于植物次生代谢产物。对植物而言,黄酮类化合物具有多种生物学功能,如调节植物生长、保护植物免受紫外线的损伤以及作为植物抗毒素(phytoalexin)和活性氧清除剂等,对入侵的病原物有直接的毒杀作用;其作为植物花和果实的色素,既是引诱剂,又是驱避剂,是植物体内重要的防御性次生代谢产物[3-4]。对于人类而言,黄酮类化合物大多与糖类结合为苷存在,可清除自由基,具抗氧化、抑菌、抗病毒、抗癌和抗肿瘤作用,对防治心血管疾病、肝病均有一定的疗效。而且,黄酮类化合物对畜禽生产也有良好的促进功能[5]。本文对栝楼干种子及种子萌发期间黄酮含量的变化情况进行研究,以期为进一步了解栝楼种子生长及人工调控栝楼黄酮含量提供参考。
1 仪器与材料
1.1 仪器
LHR-250-GS型人工气候箱(广东省医疗器械厂);SW-CJ-1G型单人净化工作台(苏州净化设备有限公司);HH-1型电热恒温水浴锅(常州博远实验分析仪器厂);LE204E/02型万分之一电子天平(梅特勒-托利多仪器(上海)有限公司);GFL-230型电热鼓风干燥箱(天津市莱博特瑞仪器有限公司);KQ-500DE型超声波清洗器(昆山市超声仪器有限公司);SHZ-D(Ⅲ)型循环水多用真空泵(巩义市英峪高科仪器厂);UV 5100B型紫外可见分光光度计(上海元析仪器有限公司)。
1.2 试剂
芦丁标准品(上海源叶生物科技有限公司,质量分数大于98%);浓硫酸(质量分数大于98%);体积分数70%乙醇溶液(AR);石油醚(沸程60~90 ℃);质量分数10%硝酸铝溶液(AR);质量分数5%亚硝酸钠溶液(AR);质量分数4%氢氧化钠溶液(AR);实验用水为蒸馏水。
1.3 材料
栝楼果实于2015年11月采收自山东中医药大学药圃,采摘后悬挂在室内通风处,至果实晾干,取出种子,放在阴凉干燥处备用。经张永清教授鉴定,为葫芦科栝楼属植物栝楼(TrichosantheskirilowiiMaxim.)的干燥成熟种子。
2 方法与结果
2.1 发芽实验方法
2.1.1 种子培养
参考许桂芳等[6-7]的方法对栝楼种子进行培养。选取籽粒饱满、大小相近的栝楼种子1 000粒,浓硫酸浸泡10 min,蒸馏水洗去种子表面因酸蚀而形成的附着物后,在40 ℃温水浸泡6 h,再转冷水中浸泡24 h,取出用滤纸吸干表层水分,均匀放入铺有3层滤纸的培养皿中,每皿30粒,放入30 ℃培养箱中进行萌发培养。及时补充培养皿中水分以保持培养条件湿润;不正常种子、死种子及严重霉烂的种子需随时拣出。
2.1.2 记录
从种子培养的当天开始观察,以种子吸水完全为吸胀期,以胚根突破种皮1~3 mm视为萌动期,胚根伸长至胚芽伸出前为伸长期,长出第一片真叶前为萌芽期,长至两叶一心时为幼苗期,记录种子生长至每个时期的日期。将第一粒种子胚根突破种皮之日作为萌发的开始,以后每天定时记录萌发种子数,当连续几天不再有种子萌发时作为萌发结束期。不正常种子、死种子及严重霉烂的种子及时拣出并记录。计算发芽势、发芽率。
具体指标计算方法如下:
发芽势 = ( 萌发高峰期种子发芽数/供试种子数)× 100% ,
(1)
发芽率 = ( 种子发芽数/供试种子数)× 100% 。
(2)
2.1.3 实验结果
种子培养第0天为吸胀前期,前3天无萌发现象,为吸水阶段;第3天为吸胀期;自第4天开始出现萌发的种子,进入萌动期;第9~11天为胚根伸长期;第12~14天为萌芽期;第16~18天为幼苗期。所有培养的种子在第7天达萌发高峰期,整个发芽现象持续23 天,23 天以后没有新的种子萌发。最终计算得发芽势为85%,发芽率为93%。
2.2 总黄酮测定
2.2.1 样品前处理
分别取6个萌发阶段的栝楼种子于60 ℃烘箱中烘干,研钵研碎后滤纸包好,用石油醚回流2.0 h,除去色素和脂溶性成分,60 ℃烘干备用。
2.2.2 对照品溶液的制备
精密称取干燥至恒重的芦丁标准品9.8 mg于50 mL容量瓶中,用70%乙醇溶液溶解并定容至刻度,得0.196 mg/mL的芦丁标准品溶液。
2.2.3 标准曲线绘制
精密吸取标准品溶液0、1.0、2.0、3.0、4.0、5.0 mL,分别置于10 mL容量瓶中,加入5%亚硝酸钠溶液0.3 mL,摇匀,静置6 min;加10% 硝酸铝溶液0.3 mL,摇匀,再静置6 min;加4% 氢氧化钠4 mL,再加入70%乙醇定容至刻度,摇匀,静置15 min后,在510 nm处测其吸光度[8]。以吸光度为纵坐标,标准品质量浓度为横坐标绘制标准曲线,得标准曲线为:y= 11.184x- 0.012 67,R2= 0.999 53。x为标准品质量浓度(mg/mL),y为吸光度值,结果如图1所示。

图1 标准曲线Fig.1 Standard curve
2.2.4 供试品溶液制备
分别称取各时期样品1.000 g置于100 mL具塞锥形瓶中,按液料比1∶40加入40 mL 70%乙醇溶液,70 ℃超声提取1 h,提取1次,提取液冷却并过滤于50 mL的容量瓶内,用70%乙醇溶液定容至刻度,即得供试品溶液,备用。
2.3 方法学考察
2.3.1 精密度实验
精密吸取吸胀前的供试品溶液5 mL,置于10 mL容量瓶中,按照2.2.3 项下方法操作,于510 nm处测定吸光度,连续测定6次,计算相对标准偏差为0.67%,精密度良好,结果见表1。
表1 精密度实验结果
2.3.2 重复性实验
精密称取吸胀前样品1 g,按照2.2.4项下方法制备供试品溶液,按照2.2.3项下方法操作,于510 nm处测定吸光度,平行操作6次,计算相对标准偏差为1.57%。表明样品测定符合技术要求,重现性良好,结果见表2。
表2 重复性实验结果
2.3.3 稳定性实验
精密吸取吸胀前的供试品溶液5 mL,按照2.2.3项下方法于510 nm处测定在反应5 、10、15、20、30 min时的吸光度,计算相对标准偏差为1.65%。表明 30 min 内样品稳定性良好,结果见表3。

表3 稳定性实验结果
2.3.4 加样回收率实验
采用标准加入法,精密称取已测知总黄酮含量的吸胀前的样品1 g,精密加入芦丁标准品约1 mg,按照2.2.4项下方法制备供试品溶液,按照2.2.3项下方法于510 nm处测定吸光度,平行操作6份,计算平均回收率为99.07%,相对标准偏差为0.89%,结果见表4。
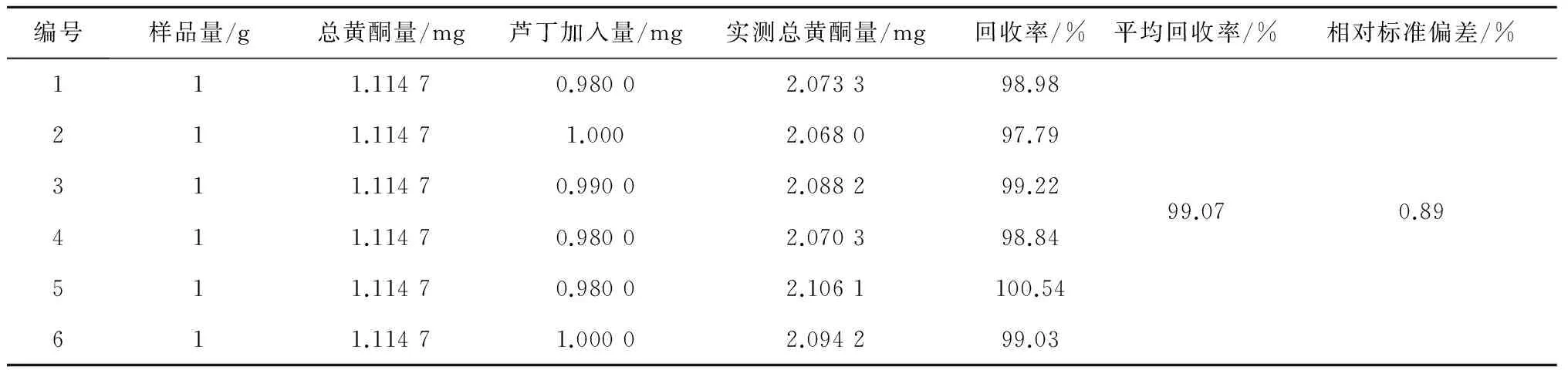
表4 加样回收实验结果
2.4 样品测定
分别精密吸取各时期供试品溶液5 mL,按照2.2.3项下方法,于510 nm处测定吸光度值,重复6次,代入回归方程计算出各时期供试品溶液稀释后的总黄酮浓度,并计算各萌发阶段种子中总黄酮含量,表5为各时期总黄酮浓度及含量结果,图2为总黄酮含量变化趋势。

表5 栝楼种子萌发期间总黄酮含量测定结果(n=6)

图2 栝楼种子萌发过程中总黄酮含量变化趋势Fig.2 Trend of the change of total flavonoids content during germination process of Trichosanthes kirilowii Maxim. seeds
由测定结果可以看出,栝楼种子中总黄酮含量较低,在1 mg/g上下波动。从图2变化趋势可看出,干种子中总黄酮含量大于吸胀期的种子,种子吸水进入萌动阶段后,总黄酮含量随种子继续生长而逐渐增加,进入幼苗期时总黄酮含量增长迅速,总体呈现先下降后上升的趋势。
3 分析与讨论
研究表明[6-7,9-10],栝楼种子存在休眠现象,萌发困难,出苗率低且不齐。针对栝楼破休眠及促萌的研究也有很多,本实验采用文献[6-7]的处理方法,虽然发芽势为85%,发芽率达到93%,但同批处理的种子培养20 d以后仍有刚萌发者,即发芽不齐现象依然存在,尚待解决。
许多文献表明[11-13],成熟干种子自吸水至胚根突破种皮之前的阶段,种子内部开始进行复杂的生理变化:干燥种子的鲜重急剧增加,一些酶也因为得到自由水而恢复代谢,细胞代谢空前旺盛,此时氧气大量进入,呼吸速率显著加快,此阶段种子内多数物质开始被分解,含量降低;然而胚根突破种皮继续生长至幼苗期的阶段,种子会重吸收外界中的小分子代谢物,供细胞分裂和营养物质合成,从而使一部分成分积累增加。本实验中栝楼种子萌发阶段黄酮含量变化趋势亦符合此变化规律:干种子(1.114 7 mg/g)到种子萌动前期(0.906 3 mg/g)总黄酮含量有所降低;胚根突破种皮后至萌芽期,总黄酮含量缓慢上升;至幼苗期,总黄酮含量迅速积累达2.715 3 mg/g。
总黄酮的合成还受多方面影响,基因表达[3]、酶活性变化(PAL酶)[14]、内源激素水平变化[15]及外界环境(光照、温度等)[14]等均有可能影响总黄酮含量。植物内源激素中的生长素、乙烯和脱落酸有助于植物中黄酮类成分的合成与积累,而赤霉素则不利于黄酮类成分的合成,茉莉酸、茉莉酸甲酯和水杨酸也被证明可以诱导植物黄酮类成分的合成和积累[15]。矿质营养可以通过调控植物的碳、氮代谢过程以及植物体内内源激素代谢和关键酶活性等方面,从而影响黄酮类成分的合成代谢过程[14-15]。
4 结论
若想调控种子及植株生长,必须首先了解植株生长过程中内部成分的变化。本实验对种子萌发过程中总黄酮积累规律进行研究,以期为调控植株生长提供参考。研究表明,栝楼种子萌发过程中总黄酮含量呈现先下降后上升的变化趋势,基因表达、酶活性变化、内源激素水平等也是影响种子萌发的因素,可从这几方面进行全面、系统地研究,找出栝楼种子萌发过程中影响总黄酮含量变化的关键点和关键物质,从而采取措施对黄酮类物质的合成及积累进行人工调控,如施以合理的矿质营养供应,促使其关键酶表达、活性和内源激素的变化朝着生产需要的方向发展等,进而更好地实现对栝楼的认识、开发和利用。
[1]国家药典委员会.中华人民共和国药典2010年版一部[M].北京:中国医药科技出版社,2010:82-84.
[2] 林树花,李高阳,韩晓磊.栝楼籽的化学成分研究进展[J].农产品加工(创新版),2012(8): 73-76.
[3]康亚兰,裴瑾,蔡文龙,等.药用植物黄酮类化合物代谢合成途径及相关功能基因的研究进展[J].中草药,2014,45(9):1336-1341.
[4] TANAKA Y,SASAKI N,OHMIYA A.Biosynthesis of plant pigments:Anthocyanins, betalains and carotenoids[J].Plant Journal,2008,54(4):733-749.
[5]文开新,王成章,严学兵,等.黄酮类化合物生物学活性研究进展[J].草业科学,2010, 27 (6):115-122.
[6] 许桂芳,王鸿升,孟丽.瓜蒌种子休眠原因与破除休眠研究[J].氨基酸和生物资源,2010, 32(1): 28-30.
[7] 徐礼英,张小平.不同处理对栝楼种子萌发的影响[J].芜湖职业技术学院学报,2008,10(4):74-77.
[8] 刘金娜,温春秀,杨太新,等.瓜蒌子黄酮提取方法和参数优化的研究[J].时珍国医国药,2013,24(9):2088-2090.
[9] 孙婷,刘鹏,徐根娣.栝楼种子休眠特性分析[J].中国农业科学,2008,41(12):4273-4280.
[10] 孙婷.栝楼(TrichosantheskirilowliiMaxim.)种子的休眠特性及促萌措施研究[D].金华:浙江师范大学,2010.
[11] NONOGAKI H, BASSEL G W, BEWLEY J D.Germination-still a mystery[J]. Plant Sci,2010,179(6):574-581.
[12] BEWLEY J D, BLACK M. Seeds:Physiology of development and germination[M]. New York: Plenum Press, 1994.
[13] 吴香玉.绿豆萌发的动态代谢组学研究[D].武汉:中国科学院研究生院(武汉物理与数学研究所),2014.
[14]刘金福,李晓雁,孟蕊.苦荞发芽过程中促进黄酮合成的因素初探[J].食品工业科技,2006, 27(10):106-108.
[15]刘大会,郭兰萍,黄璐琦, 等.矿质营养对药用植物黄酮类成分合成的影响[J].中国中药杂志,2010,35(18):2367-2371.
Research on the change of total flavonoids content ofTrichosantheskirilowiiseeds during germination period
HUO Li-qun,ZHANG Wen-xia,XIN Jie,ZHANG Yong-qing,LI Jia*,LIU Hong-yan
(Shandong University of Traditional Chinese Medicine, Jinan 250355, China)
∶With the method of ultrasonic-assisted extraction, the content and its change rule of total flavonoids inTrichosantheskirilowiiseeds during six stages of prophase imbibition, imbibition, germination, radicle elongation, bud breaking and seedling were studied. After degreased by petroleum ether, total flavonoids ofTrichosantheskirilowiiseeds at different germination stage were extracted with 70% ethanol as solvent by ultrasonic-assisted extraction, and determined using rutin as the standard by colorimetry method. The results showed that total flavonoids content in the seeds ofTrichosantheskirilowiiwas low, about 1 mg/g, and it showed tendency to descend firstly and then ascend during the whole germination process, rising to 2.7 mg/g at seeding stage. This study provides references for further understanding and utilization ofTrichosantheskirilowiiseeds, and provides theoretical basis for artificial regulation of total flavonoids content inTrichosantheskirilowiiseeds.
∶Trichosantheskirilowiiseeds;germination process;total flavonoids
10.3976/j.issn.1002-4026.2017.02.001
2016-08-08
国家中医药行业科研专项(201407002);山东省高校科研发展计划(J14LM06)
霍立群(1991—),女,硕士研究生,研究方向为中药质量与资源。
*通信作者,李佳。E-mail:ljytl7172@163.com
R284.1
A
1002-4026(2017)02-0001-06
