HPLC法测定鲜天麻中多指标成分的含量
2017-05-10李云王志伟刘大会周洪雷王晓
李云,王志伟,刘大会,周洪雷,王晓*
(1. 山东省中药质量控制技术重点实验室, 山东省分析测试中心,山东 济南 250014;2.山东中医药大学药学院,山东 济南 250014;3. 云南省农业科学院药用植物研究所,云南 昆明 650231)
【中药与天然活性产物】
HPLC法测定鲜天麻中多指标成分的含量
李云1, 2,王志伟1,刘大会3,周洪雷2,王晓1, 2*
(1. 山东省中药质量控制技术重点实验室, 山东省分析测试中心,山东 济南 250014;2.山东中医药大学药学院,山东 济南 250014;3. 云南省农业科学院药用植物研究所,云南 昆明 650231)
建立了高效液相色谱测定鲜天麻中天麻素、对羟基苯甲醇、对羟基苯甲醛、腺苷、巴利森苷A、4, 4′-二羟基二苄基醚6种成分含量的方法。采用Agilent 1120高效液相系统,YMC-PEAK ODS-A column (250 mm × 4.6 mm,5 μm)色谱柱,流动相为0.1%甲酸水溶液(A)-甲醇溶液(B),梯度洗脱:0~5 min,5% B;5~65 min,5%~40% B;65~80 min,40%~100% B;分析时间80 mins;流速1 mL/min;柱温25 ℃;进样量50 μL。其中天麻素、对羟基苯甲醇、对羟基苯甲醛、腺苷、巴利森苷A、4, 4′-二羟基二苄基醚6种成分在线性范围内均具有良好的线性关系(R≥0.999 2);平均回收率在94.20%~99.68%,相对标准偏差小于1.96%。在不同品种的鲜天麻中,6种成分的量存在差异,红天麻各成分含量稍高于乌天麻。同一品种天麻中,巴利森苷类成分含量较高,腺苷和4, 4′-二羟基二苄基醚含量均较低,且鲜天麻中提取的天麻素等6种成分在8 h内稳定。该方法分离效果与重复性好、快速、简便,能够为客观、全面地研究天麻药材提供参考。
天麻;天麻素;对羟基苯甲醇;巴利森苷A;含量测定
天麻(GastrodiaelataBlume)为兰科天麻属多年生草本植物,主产于云南、内蒙古、四川、湖南、贵州及台湾等地,是我国的贵重中药材,药用部位为天麻的干燥块茎。我国著名天麻专家、中科院昆明植物所周铉先生将我国天麻分为如下5个变型[1]:原变型-红天麻、绿天麻、乌天麻、松天麻和黄天麻。天麻性甘、平,归肝经,有息风止痉、平抑肝阳和祛风通络的功效,用于小儿惊风、癫痫抽搐、破伤风、头痛眩晕、手足不遂、肢体麻木以及风湿痹痛等[2]症的治疗。现代药理及临床研究表明,天麻对于失眠、高血压、偏头痛、糖尿病神经病变及心脑血管疾病等有较好的治疗效果[3-6]。天麻的化学成分主要包括酚类、有机酸类、多糖类及甾体类等[7],近年来,对天麻化学成分的研究主要是针对天麻蒸制处理后的干天麻,而专门针对鲜天麻化学成分的研究较少。因此,本文对红天麻和乌天麻鲜品中的6种成分进行含量测定,以期为客观、全面地研究天麻药材提供参考。
1 仪器与材料
Agilent 1120型高效液相色谱仪(安捷伦科技有限公司);MS205DU型电子分析天平(梅特勒-托利多仪器上海有限公司),精确到0.01 mg;SB-3200DT超声波清洗机(宁波新芝生物科技股份有限公司); BUCHI旋转蒸发仪(瑞士BUCHI公司)。
天麻素、腺苷、对羟基苯甲醇、对羟基苯甲醛、巴利森苷A、4,4′-二羟基二苄基醚均为本实验室自制纯品,上述对照品经HPLC法检测,质量分数均大于 98.0%。
乙腈(色谱纯,美国Fisher Scientific);甲醇(色谱纯,山东禹王实业有限公司化工分公司);甲酸(色谱纯,天津市科密欧化学试剂有限公司);实验用水为娃哈哈纯净水;其余试剂均为分析纯。
本实验所用天麻均来自于云南省邵通市彝良县小草坝天麻种植基地,2016年3月份采收,收集两个品种的鲜天麻块茎,每个品种3份(编号为 S1~S6),其中S1~S3为乌天麻,S4~S6为红天麻,经云南省农业科学院药用植物研究所刘大会副研究员鉴定为兰科天麻属植物天麻 (GastrodiaelataBl.)的新鲜块茎。
2 方法与结果
2.1 含水量的测定
取乌天麻和红天麻鲜品,洗净,切薄片(1~2 mm),采用烘干法[2]测定含水量,结果见表1。
2.2 色谱条件
色谱柱为YMC-PEAK ODS-A column(250 mm×4.6 mm,5 μm);流动相为0.2%甲酸水溶液(A)-甲醇溶液(B);梯度洗脱(0~5 min,5% B;5~65 min,5%~40% B;65~80 min,40%~100% B);分析时间80 min;体积流量1 mL/min;进样量50 μL;柱温25 ℃。
在上述色谱条件下,天麻素等6种成分理论塔板数均不低于1万,分离度与拖尾因子均符合含量测定要求。对照品和天麻样品(S1)色谱图见图1。

表1 乌天麻与红天麻含水量的测定

时间/min 1 天麻素; 2 腺苷;化合物3 对羟基苯甲醇; 4 对羟基苯甲醛;5 巴利森苷A ; 6 4,4′-二羟基二苄基醚。图1 对照品及样品的HPLC图Fig.1 HPLC chromatograms of reference substances and samples
2.3 溶液的制备
2.3.1 对照品溶液的制备
分别精密称取天麻素等6种对照品适量,置同一1 mL容量瓶中,加10%乙腈适量使溶解并稀释至刻度,摇匀,得质量浓度分别为300、30、150、30、600、30 μg/mL的混合对照品溶液。
2.3.2 供试品溶液的制备
取供试品均按干燥品约为2 g称重,依含水量换算成鲜品质量,乌天麻约为7 g,红天麻约为10 g,精密称定,加入一定量80%乙醇,用流体机械设备粉碎,转移置具塞锥形瓶中,再加入80%乙醇至50 mL,称定质量,超声提取(功率180 W,频率40 kHz)30 min,放冷,再称定,用80%乙醇补足减失的质量,抽滤,精密量取续滤液20 mL,浓缩至近干无醇味,残渣加乙腈-水(1∶9,V/V)混合溶液溶解,转移至10 mL量瓶中,用乙腈-水(1∶9,V∶V)混合溶液稀释至刻度,摇匀,过0.45 μm有机滤膜,即得。
2.4 方法学考察
2.4.1 线性关系
将混合对照品溶液梯度稀释,得到一系列不同浓度的混合对照品溶液,按2.2项下色谱条件进行分析,分别进样50 μL,每个浓度平行进3针,测定峰面积平均值。以峰面积Y对质量浓度ρ(μg/mL)绘制标准曲线,得天麻素等6种成分的回归方程,结果见表2。从表2可以看出,各标准曲线的相关系数良好,方法灵敏度较高,可以满足天麻提取物中各活性成分的含量测定。

表2 天麻素等6种成分的回归方程
2.4.2 精密度实验
取混合对照品溶液,按上述色谱条件进样50 μL,连续进样6次,记录各自峰面积,计算天麻素等6种成分峰面积的相对标准偏差分别为1.58%、1.65%、1.02%、1.40%、1.53%、2.31%,表明本方法精密度良好。
2.4.3 重复性实验
称取编号为 S1 的鲜天麻约7 g,精密称定,按2.3.2项下方法平行制备6份供试品溶液,测定并计算其中6种成分的平均含量和 相对标准偏差。结果表明,天麻素等6种成分的平均含量分别为0.802 1、0.120 3、1.201 3、0.040 9、4.710 5、0.140 3 mg/g,相对标准偏差分别为1.65%、1.42%、2.06%、1.70%、1.53%、2.37%,表明本方法重现性良好。
2.4.4 稳定性实验
取编号为S1的鲜天麻制备的供试品溶液,室温下放置,分别于0、2、4、6、8 h进样50 μL进行液相分析,记录各自峰面积并计算相对标准偏差,结果,天麻素等6种成分峰面积的相对标准偏差分别为4.83%、2.48%、4.97%、2.23%、4.28%、3.39%,表明供试品溶液中天麻素等6种成分在8 h内稳定。
2.4.5 加样回收率实验
称取编号为S1的鲜天麻6份,每份7 g,精密称定。分别加入适量对照品,按2.3.2项下方法制成高、中、低3个浓度的供试品溶液,测定并计算 6 份供试品溶液中天麻素等6 种成分的平均加样回收率和相对标准偏差,详见表3。

表3 6种成分加样回收率(n=3)
续表3

化合物样品中量/μg加入量/μg测得量/μg回收率/%平均值/%相对标准偏差/%巴利森苷A4656.737208251.498.5046509276.599.6898.970.63558010105.398.724,4'-二羟基二苄基醚144.8110241.694.82140273.195.8996.061.38170306.897.46
2.5 样品含量测定
取乌、红两个品种的天麻鲜品,每个品种3份,按2.3.2项下方法分别制备供试品溶液,各进样50 μL,以各成分峰面积按外标法对其中的天麻素等6种成分进行测定,并计算每个品种3份的平均含量,结果见表4。
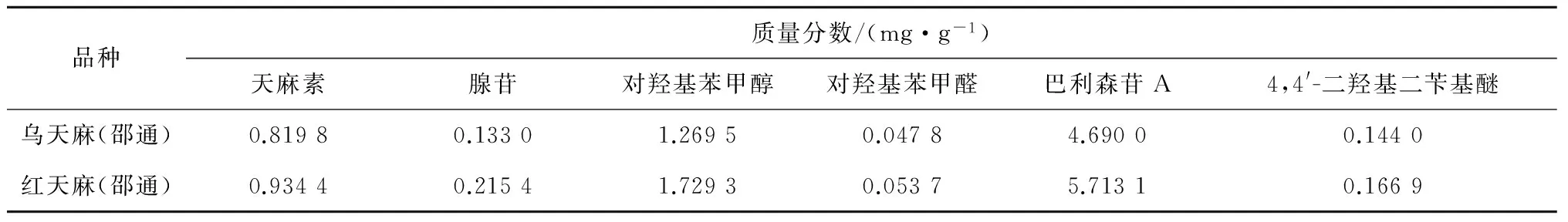
表4 6份鲜天麻中6种成分的平均含量
3 讨论
3.1 鲜天麻的保鲜
将乌、红两个品种的天麻鲜品去除表面土壤,不清洗,装入透明塑料袋内,将空气排出,并淋入少量水,封口,放入冰箱4~5 ℃保存备用[8]。
3.2 检测波长的选择
对天麻素、腺苷、对羟基苯甲醇、对羟基苯甲醛、巴利森苷A、4, 4′-二羟基二苄基醚6 种成分均进行紫外200 nm~400 nm波长扫描,结果显示最大吸收波长分别为220 、260 、225 、270 、220 、225 nm,所以本实验选取两个检测波长对鲜天麻中6种成分进行含量测定,天麻素、对羟基苯甲醇、巴利森苷A、4, 4′-二羟基二苄基醚检测波长为220 nm,腺苷、对羟基苯甲醛检测波长为270 nm。
3.3 流动相的选择
本实验鲜天麻中6种成分极性差异较大,为使各成分基线分离,采用梯度洗脱,流动相比较了乙腈-0.05%磷酸系统[9]和甲醇-0.1%甲酸水系统,结果乙腈系统初始梯度调到2%,天麻素与其前面杂质峰仍不能基线分离,难以再调整;选择甲醇系统进行梯度洗脱程序优化后,各峰可以达到基线分离,故而确定本实验的洗脱系统为甲醇-0.1%甲酸水梯度洗脱,且分离效果良好,重现性好。
3.4 小结
本实验测定了新鲜乌天麻和红天麻中6种成分的含量,就不同品种的新鲜天麻而言,红天麻中天麻素、对羟基苯甲醇、腺苷、对羟基苯甲醛、巴利森苷A、4, 4′-二羟基二苄基醚6种成分含量稍高于乌天麻(本实验乌天麻为二级乌天麻);同一品种天麻中,巴利森苷A成分含量较高,腺苷和4, 4′-二羟基二苄基醚含量均较低。近年来,对天麻化学成分的研究主要是针对炮制后的天麻,且大量研究报道了不同炮制方法对天麻化学成分含量的影响[10],而专门针对鲜天麻的化学成分研究较少,本实验建立了 HPLC 法同时测定鲜天麻药材中天麻素、对羟基苯甲醇、腺苷、对羟基苯甲醛、巴利森苷A、4, 4′-二羟基二苄基醚6种成分的含量,该方法简便、可行、重现性好,能够为客观、全面地评价天麻药材的质量提供参考。另外,在实验中还存在一些结构尚未确定的化合物,总样图中亦可见其有较高含量,因此,需进一步探索这些化合物的结构及其对天麻药理药效作用的贡献。
[1]中国科学院中国植物志编辑委员会. 中国植物志第十八卷[M]. 北京:科学出版社, 1999: 31.
[2]国家药典委员会. 中华人民共和国药典2015年版一部 [M]. 北京: 中国医药科技出版社, 2015: 58-59.
[3]张勤, 杨云梅, 余国友. 天麻素注射液对老年难治性高血压患者血压和血管活性物质影响的随机对照研究 [J]. 中西医结合学报, 2008, 6(7): 695-699.
[4]郭驹, 马晓俞, 于朝霞, 等. 养血清脑颗粒、天麻素联合尼莫地平治疗偏头痛60例 [J]. 中国药业, 2014, 23(6): 70-71.
[5]苗凯, 王美, 谢祎. 天麻素治疗冠心病心绞痛临床效果的观察 [J]. 天津药学, 2009, 21(6): 26-27.
[6] SUN W, MIAO B, WANG X C, et al. Gastrodin inhibits allodynia and hyperalgesia in painful diabetic neuropathy rats by decreasing excitability of nociceptive primary sensory neurons [J]. PLoS One,2012,7(6):e39647.
[7] 朱会朋. 三种邵通产药用植物的化学成分研究 [D]. 昆明:云南中医学院,2013.
[8] 杨顺强,武婷,吴珊珊.不同包装方式对鲜天麻保鲜效果的比较 [J]. 湖北农业科学, 2015, 54(13): 3221-3224.
[9] 单鸣秋, 张丽, 于生, 等. HPLC-MS法同时测定天麻饮片中8种活性成分 [J]. 中草药, 2015, 46(14): 2087-2091.
[10] 毕荣璐,倪兆武,李德勋,等.不同炮制方法对天麻素及天麻苷元含量的影响[J].云南中医学院学报,2015,38(1):34-37.
HPLC determination of multi index components in rawGastrodiaelataBlume
LI Yun1,2, WANG Zhi-wei2, LIU Da-hui3, ZHOU Hong-lei1, WANG Xiao1,2*
(1.Shandong Provincial Key Laboratory of TCM Quality Control Technology, Shandong Analysis and Test Center, Jinan 250014, China; 2.College of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250014, China; 3.Medicinal Plant Research Institute of Yunnan Academy of Agricultural Sciences,Kunming 650231,China)
∶A HPLC method for determination of the contents of six components in rawGastrodiaelata, such as gastrodin, p-hydroxybenzyl alcohol, p-hydroxybenz aldehyde, adenosine, parishin A and 4, 4′-dihydroxydibenzyl ether, was presented. The analysis was performed on an Agilent 1120 HPLC system with YMC-PEAK ODS-A column (250 mm × 4.6 mm, 5 μm). The six components were separated in 80 mins with gradient elution using mobile phase composed of 0.1% CH3COOH—H2O (A) and CH3OH (B): 0~5 min, 5% B; 5~65 min, 5%~40% B; 65~80 min, 40%~100% B. The flow rate of carrier gas was set at 1 mL/min, the column temperature was set at 25 ℃, and the injected sample volume was 50 μL. Six ingredients showed a good linear relationship (R≥0.999 2) within the linear range, and the average recovery rates were in the range of 94.20%~99.68%,and the relative standard deviation was less than 1.96. There were differences in the amounts of six ingredients among different varieties of rawGastrodiaelata, for instance, the contents of the six ingredients inGastrodiaelataf.elatawere slightly higher than those inGastrodiaelataf.glauca. In the same variety, the content of parishin glycosides was higher while the contents of adenosine and 4, 4′-dihydroxydibenzyl ether were lower. The six ingredients such as gastrodin extracted from fresh gastrodin were stable within 8 hours. This method has the advantage of good separating effect and repeatability, rapid and simple, which could provide references for objective and comprehensive researches on the Rhizoma Gastrodiae.
∶Gastrodiaelata; gastrodin; p-hydroxybenzyl alcohol; parishin A; determination of content
10.3976/j.issn.1002-4026.2017.02.002
2016-09-09
山东省科技发展计划(2014GZX219003)
李 云(1990—),女,硕士在读,研究方向为中药及复方活性成分质量控制研究。E-mail: liyun137934@163.com
*通信作者, 王晓(1972—),男,研究员,研究方向为天然产物分离纯化与功能食品。E-mail:wangx@sdas.org
R284.1
A
1002-4026(2017)02-0007-06
