恶性卵巢肿瘤保留生育功能治疗远期疗效
2017-05-10龙起珏马耀根袁琳苏小菊
龙起珏+马耀根+袁琳+苏小菊


(1.北海市人民医院妇科;2.北海市人民医院中医科,广西北海 536000)
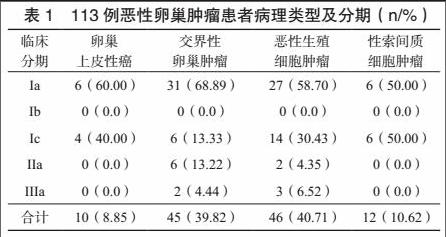
[摘 要] 目的:分析恶性卵巢肿瘤保留生育功能治疗远期疗效,为保留生育功能治疗方案的选择提供参考。方法:以我院2009年4月~2011年4月收治的113例接受保留生育功能治疗且随访资料完整的恶性卵巢肿瘤患者为研究对象,进行回顾性分析,记录其手术情况、术后化疗情况、术后月经及妊娠情况,并比较不同手术方案、病理类型、化疗对患者远期预后的影响。结果:113例患者中,卵巢上皮性癌10例(8.85%)、交界性卵巢肿瘤45例(39.82%)、恶性生殖细胞肿瘤46例(40.71%)、性索间质细胞肿瘤12例(10.62%);34例(30.09%)接受全面分期手术,26例(23.01%)接受不全面分期手术,其余53例(46.90%)未行分期手术;61例(53.98%)接受术后化疗,52例(46.02%)未接受术后化疗;患者随访时间60~108个月,平均随访时间(72.03±6.04)个月,其中15例复发,复发率为13.27%,复发患者病理类型均为交界性卵巢肿瘤。交界性卵巢肿瘤患者复发率为33.33%(15/45),其复发率高于其他病理类型,差异有统计学意义(P<0.05)。113例患者中,死亡4例,死亡率为3.54%,死亡患者病理类型均为恶性生殖细胞肿瘤。手术情况对患者术后月经情况无明显影响,接受术后化疗的患者,其月经异常率有所升高,差异有统计学意义(P<0.05);术后化疗的61例患者中,33例患者共妊娠37次,其中1次稽留流产,1次早产;术后未化疗的52例患者中,29例患者共妊娠32次,其中1次早产;患者子代均健康无畸形。患者月经恢复后FSH、LH均较停经期间降低,其E2较停经期间升高,差异有统计学意义(P<0.05)。结论:恶性卵巢肿瘤保留生育功能治疗具有良好的安全性与远期疗效,对患者妊娠及妊娠结局无明显影响,术后化疗可能对患者卵巢功能存在一定影响,但该影响具有可逆性,患者月经恢复后激素水平亦可有效恢复。
[关键词] 恶性卵巢肿瘤;保留生育功能;远期疗效;妊娠
中图分类号:R737.31 文献标识码:A 文章编号:2095-5200(2017)04-100-03
DOI:10.11876/mimt201704040
由于卵巢位置特殊且病变早期症状不明显,故尽管恶性卵巢肿瘤的发病率不及其他生殖系统恶性肿瘤,但其死亡率却居女性生殖系统肿瘤首位[1]。子宫、附件切除联合腹腔冲洗、化学治疗是临床治疗恶性卵巢肿瘤的传统方案,但该类治疗方案会造成患者生育功能完全丧失、生活质量受到严重影响,增加骨质疏松、认知功能障碍等疾病发生风险[2]。随着近年来恶性卵巢肿瘤发病年龄逐渐趋于年轻化,治疗后生育功能及卵巢内分泌功能的保留成为多数患者的迫切愿望[3]。本研究对113例患者进行了回顾性分析,旨在明确保留生育功能治疗恶性卵巢肿瘤的远期疗效。
1 资料与方法
1.1 选取标准与排除标准
自我院2009年4月—2011年4月收治的恶性卵巢肿瘤患者中进行筛选。选取标准:1)参照世界卫生组织(WHO)制定的诊断标准,经术后病理学检查确诊恶性卵巢肿瘤[4];2)国际妇产科联盟(FIGO)恶性卵巢肿瘤临床分期明确;3)接受保留生育功能治疗;4)随访资料完整且随访时间≥5年。排除合并其他类型恶性肿瘤患者。(共选取符合条件的患者113例,进行回顾性分析。
1.2 治疗方案
113例患者均接受手术治疗及辅助化疗,手术治疗:需保留子宫及至少一侧卵巢,手术方案包括单侧附件切除(UO)、UO+对侧肿物切除(CC)、单侧肿物剥除(UC)及双侧肿物剥除(UC),手术同期行腹腔冲洗液、对侧卵巢活检,大网膜切除,腹膜多点活检,盆腔和主动脉旁淋巴结切除等,粘液性肿瘤患者联合阑尾切除[5]。化疗包括顺铂腹腔化疗以及TC、PE/VB方案静脉化疗[6]。
1.3 研究方法
采用电话随访、门诊随诊、家庭访视等形式,对患者实施跟踪随访,随访截止日期为2016年6月。记录患者术后妊娠及月经情况。
对本临床研究的所有数据采用SPSS18.0进行分析,计数资料以(n/%)表示,并采用χ2检验,计量资料以(x±s)表示,满足正态分布且方差齐性则采用独立样本t检验,若方差不齐,则采用校正t检验,以P<0.05为差异有统计学意义。
2 结果
患者发病年龄18~42岁,平均(26.11±3.47)岁,其病理类型及分期情况见表1。113例患者中,34例(30.09%)接受全面分期手术,26例(23.01%)接受不全面分期手术,其余53例(46.90%)未行分期手术。113例患者中,61例(53.98%)接受术后化疗,其中卵巢上皮性癌10例、交界性卵巢肿瘤14例、恶性生殖细胞肿瘤26例、性索间质细胞肿瘤11例,治疗疗程3~9疗程,平均(5.01±0.95)疗程。
2.1 复发及生存情况
随访时间60~108个月,平均随访时间(72.03±6.04)个月,其中15例复发,复发率为13.27%,复发患者病理类型均为交界性卵巢肿瘤。交界性卵巢肿瘤患者复发率为33.33%(15/45),其复发率高于其他病理类型,差异有统计学意义(P<0.05)。
113例患者中,死亡4例,死亡率为3.54%,死亡患者病理类型均为恶性生殖细胞肿瘤。恶性生殖细胞肿瘤患者死亡率为8.70%(4/46),与其他病理类型比较,差异有统计学意义(P<0.05)。
2.2 术后月经及妊娠
手术情况对患者術后月经情况无明显影响,接受术后化疗的患者,其月经异常率有所升高,差异有统计学意义(P<0.05),见表2。月经异常患者停经3~9个月,平均停经时间(5.74±0.95)个月。术后化疗的61例患者中,33例患者共妊娠37次,其中1次稽留流产,1次早产;术后未化疗的52例患者中,29例患者共妊娠32次,其中1次早产;患者子代均健康无畸形。
2.3 术后激素水平变化
患者月经恢复后FSH、LH均较停经期间降低,其E2较停经期间升高,差异有统计学意义(P<0.05)。见表3。
3 讨论
据报道,年龄低于35岁且尚未完成生育的恶性卵巢肿瘤患者中,约有75%的患者具有生育愿望 [7]。但有学者认为,实施保留生育功能的保守治疗,虽然对患者近期预后无明显影响,但具有较高的远期复发风险,临床价值有待商榷[8]。
本研究113例患者均接受保留生育功能治疗,其中约有半数接受术后辅助化疗,结果表明,患者5年复发率为13.27%,与Lambertini等[9]报道接近,其死亡率为3.54%,说明保留生育功能治疗不会导致患者5年复发率的大幅升高,对其生存质量的保证亦具有一定作用。与此同时,可以发现,无论是否进行术后辅助化疗,患者妊娠功能及子代健康均未受到明显影响,仅卵巢生理功能出现了一定程度的损害,且治疗后一段时间内可恢复至正常水平,其机制考虑为:卵巢组织对某些化疗药物十分敏感,化疗药物可增强神经酰胺、鞘氨醇磷酸介导的卵母细胞凋亡,继而导致卵泡减少、消失甚至卵巢组织纤维化等改变[10]。但Chevalier等[11]发现,化疗药物对始基卵泡等不可再生细胞损伤作用不明显,且多数患者年龄较低,其卵巢内始基卵泡数量较为丰富,故卵巢发生损伤后仍具有一定的自我修复能力。本研究患者月经恢复后FSH、LH均较停经期间降低,其E2较停经期间升高,亦印证了上述结论。需要注意的是,尽管化疗药物对卵巢造成的损害是可逆的,仍应注重化疗药物的选择及合理治疗方案的制定,尽可能避免化疗药物毒性叠加、降低肿瘤细胞耐药性,从而根除肿瘤细胞、进一步降低复发风险。此外,Farthmann等[12]指出,腹腔内化疗虽然可针对卵巢肿瘤腹腔内转移的生物特性,提升治疗效果,但其导致化学性腹膜炎、继发性感染、脏器损伤等并发症发生风险较高,临床应用时应慎重考虑。 在生育状况的观察方面,可以发现,不同病理类型及分期患者在接受保留生育功能治疗后,均可获得较高的妊娠率,且多数学者认为,随着医疗技术的不断成熟,即便患者临床分期较高,采取保留生育功能治疗并尽量将肿瘤病灶切除干净,并于患者月经规律正常后尽快受孕,有望在保证其妊娠结局的前提下,为二次手术提供充裕的空间,亦可有效保证患者生存质量[13-15]。然而,过往文献多注重于妊娠结局的观察,对整个妊娠过程的细节关注较少[16],故总体而言,保留生育功能治疗恶性卵巢肿瘤的妊娠率值得肯定,但亦应注重生殖助孕技术的应用,必要时采取卵泡冷冻保存、胚胎冷冻保存等措施,保证妊娠率。
与此同时,本研究结果显示,交界性卵巢肿瘤患者复发率为33.33%(15/45),其复发率高于其他病理类型,考虑与交界性卵巢肿瘤细胞对化疗药物敏感性较低有关,但多数学者均认为,由于交界性卵巢肿瘤生长缓慢、转移率低,预后一般较好,故即便肿瘤复发,仍可再次行保留生育功能手术治疗[17-18]。
综上所述,恶性卵巢肿瘤保留生育功能治疗是安全、可行的,对保证患者妊娠率具有积极意义,且不会导致复发率、生存率显著变化,但化疗可能造成卵巢功能可逆性损害,应谨慎制定化疗方案。
参 考 文 献
[1] Loren A W, Mangu P B, Beck L N, et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update[J]. J Clin Oncol, 2013, 31(19): 2500-2510.
[2] 陈惠祯. 卵巢恶性肿瘤[M]. 湖北科学技术出版社, 2003.
[3] Solheim O, Tropé C G, Rokkones E, et al. Fertility and gonadal function after adjuvant therapy in women diagnosed with a malignant ovarian germ cell tumor (MOGCT) during the “cisplatin era”[J]. Gynecol Oncol, 2015, 136(2): 224-229.
[4] 刘小媛, 张蔚, 黄玥, 等. 保留生育功能手术在晚期卵巢交界性肿瘤中可行性的meta分析[J]. 现代妇产科进展, 2015, 24(11): 832-835.
[5] Salama M, Woodruff T K. New advances in ovarian autotransplantation to restore fertility in cancer patients[J]. Cancer Metastasis Rev, 2015, 34(4): 807-822.
[6] Chung K, Donnez J, Ginsburg E, et al. Emergency IVF versus ovarian tissue cryopreservation: decision making in fertility preservation for female cancer patients[J]. Fertil Steril, 2013, 99(6): 1534-1542.
[7] 韋任姬, 李力, 张洁清, 等. 影响卵巢恶性生殖细胞肿瘤保留生育功能手术患者预后的因素分析[J]. 肿瘤防治研究, 2014, 41(9): 962-966.
[8] Anderson R A, Rosendahl M, Kelsey T W, et al. Pretreatment anti-Müllerian hormone predicts for loss of ovarian function after chemotherapy for early breast cancer[J]. Eur J Cancer, 2013, 49(16): 3404-3411.
[9] Lambertini M, Ginsburg E S, Partridge A H. Update on fertility preservation in young women undergoing breast cancer and ovarian cancer therapy[J]. Curr Opin Obstet Gyn, 2015, 27(1): 98-107.
[10] 汪丽. 卵巢上皮性癌化疗新进展[D]. 兰州:兰州大学, 2013.
[11] Chevalier N, Paris F, Fontana S, et al. Postpubertal Persistent Hyperestrogenemia in McCune-Albright Syndrome: Unilateral Oophorectomy Improved Fertility but Detected an Unexpected Borderline Epithelial Ovarian Tumor[J]. J Pediatr Adol Gynec, 2015, 28(6): e169-e172.
[12] Farthmann J, Hasenburg A, Weil M, et al. Quality of life and sexual function in patients with borderline tumors of the ovary. A substudy of the Arbeitsgemeinschaft Gynaekologische Onkologie (AGO) study group ROBOT study[J]. Support Care Cancer, 2015, 23(1): 117-123.
[13] Anderson R A, Mitchell R T, Kelsey T W, et al. Cancer treatment and gonadal function: experimental and established strategies for fertility preservation in children and young adults[J]. Lancet Diabetes Endo, 2015, 3(7): 556-567.
[14] 孙璐, 李艺, 崔恒. 卵巢上皮性癌保留生育功能手术的研究进展[J]. 中华妇产科杂志, 2014, 49(8): 9.
[15] 徐晓菲, 王辉, 张雯柯, 等. 年轻卵巢恶性肿瘤患者139例临床分析[J]. 中国妇产科临床杂志, 2016, 17(1): 18-20.
[16] Wong M, ONeill S, Walsh G, et al. Goserelin with chemotherapy to preserve ovarian function in pre-menopausal women with early breast cancer: menstruation and pregnancy outcomes[J]. Ann Oncol, 2013, 24(1): 133-138.
[17] Wallace W H B, Smith A G, Kelsey T W, et al. Fertility preservation for girls and young women with cancer: population-based validation of criteria for ovarian tissue cryopreservation[J]. Lancet Oncol, 2014, 15(10): 1129-1136.
[18] Turner N H, Partridge A, Sanna G, et al. Utility of gonadotropin-releasing hormone agonists for fertility preservation in young breast cancer patients: the benefit remains uncertain[J]. Ann Oncol, 2013, 24(9): 2224-2235.
第一作者:龍起珏,在读硕士,主治医师,研究方向:妇科临床,Email:1838623666@qq.com。
