不同栽培措施对白肋烟TSNAs及其前体物的影响
2017-05-10周开绪杨兴友何正川张艳敏程新胜
陈 翔,周开绪,杨兴友,向 杰,何正川,刘 丽,张艳敏,程新胜*
不同栽培措施对白肋烟TSNAs及其前体物的影响
陈 翔1,2,周开绪3,杨兴友3,向 杰3,何正川4,刘 丽1,张艳敏1,程新胜1*
(1.中国科学技术大学烟草与健康研究中心,合肥 230052;2.安徽农业大学农学院,合肥 230036;3.四川省烟草公司达州分公司,四川达州 635000;4.四川省宣汉县烟草公司,四川宣汉 636150)
为揭示不同栽培措施对白肋烟烟草特有亚硝胺(TSNAs)及其前体物的影响,采用正交试验研究了施氮量(210、255和300 kg/hm2)、打顶时间(扣心打顶、现蕾打顶和初花打顶)和BSM剂量(0.1、0.3 μmol/L和清水涂抹)3因素组合对上部烟叶TSNAs、生物碱和硝酸盐含量的影响。结果表明,施氮量是影响TSNAs及其前体物生物碱、硝酸盐含量的主要因素,施氮量210 kg/hm2的上部烟叶中TSNAs及其前体物含量均较低。打顶时间对上部叶TSNAs含量影响差异极显著,现蕾打顶TSNAs含量极显著低于扣心和初花打顶。打顶后涂抹BSM,烟叶中生物碱、硝酸盐和TSNAs的含量均较低。综合认为,在本试验条件下,施氮量210 kg/hm2+现蕾打顶+0.3 μmol/L BSM制剂的组合可有效降低上部烟叶TSNAs含量。
白肋烟;施氮量;打顶时间;BSM;TSNAs
白肋烟(Burley tobacco)属浅色晾烟,因其独特的烟叶结构、物理性能和特殊的香味,被广泛用于混合型卷烟生产中[1]。烟草特有亚硝胺(tobacco-specific N-nitrosamines, TSNAs)是烟草生物碱与亚硝基反应生成的存在于烟叶及烟气中的亚硝胺类化合物[2],其中N-亚硝基降烟碱(NNN)与4-(N-甲基亚硝基胺)-1-(3-吡啶基)-1-丁酮(NNK)被国际癌症研究机构(IARC)认定为I类致癌物[3]。近年来,研究人员为寻求有效降低TSNAs含量的方法,从品种的选育、田间栽培措施以及调制等方面进行了深入的研究,如Conkling[4]报道利用遗传工程技术培育低烟碱品种,其烟叶加工成的烟草制品中TSNAs和烟碱含量均较低;宫长荣等[5]研究发现,烟叶中TSNAs含量随着施氮量的增加而增加,适当的控制施氮量有助于TSNAs含量的降低;韩锦峰等[6]研究发现,打顶时间对TSNAs前体物生物碱、硝酸盐含量有较大的影响,适时打顶可以使TSNAs前体物的含量处于较低水平。大量研究表明,众多栽培措施均可不同程度的影响生物碱、硝酸盐含量,继而影响TSNAs的形成和积累,尤其是施氮量和打顶时间[5-10]。本研究根据四川达州白肋烟生产实际情况,通过正交试验将几种对TSNAs有较大影响的技术因素进行耦合,探讨不同栽培措施组合对白肋烟上部叶TSNAs及其前体物的影响,为达州地区优质低害白肋烟生产提供参考。
1 材料与方法
1.1 试验地点和材料
试验于2014年在四川省达州市宣汉县东林乡进行(31.27°N,107.7°E,海拔545 m),当地属亚热带湿润季风气候,年均气温14.7 ℃,多年平均降雨量1199 mm,试验地约0.3 hm2,供试品种为达白1号,土壤类型为棕壤土,基本理化性状为pH 6.50,有机质12.69 g/kg,碱解氮135.0 mg/kg,速效磷95 mg/kg,速效钾110.0 mg/kg。试验中所用仿生型信号分子(Bionics Signal Molecule,BSM)是本试验室根据昆虫口腔分泌物抑制烟草创伤胁迫相关机制而研制[11-13],是一种羟基苯甲酸类衍生物,含量5%的水溶性粉状物质。
1.2 试验设计
试验采用正交L9(34)设计,三因素分别是施氮量(A)、打顶时间(B)、BSM剂量(C)。试验设9个处理组合(表1),随机区组排列,重复3次,计27个小区,每小区120株烟。

表1 正交试验表
1.3 田间管理和取样方法
烟苗于2014年4月25日移栽,移栽密度1200株/667m2,行距×株距为1.2 m×0.5 m,所有肥料在移栽前一次性做基肥施用,肥料配比(N):(P2O5):(K2O)=10:10:28,其他栽培技术按当地白肋烟生产技术规范进行。BSM在烟叶打顶时使用,即在打顶后1~2 h内将不同浓度BSM水溶物用毛笔涂抹到主茎顶端伤口断面处。各小区烟叶分别采收,并挂牌标记,调制方法同一般大田。调制结束后,取上部叶(第16~18片叶)为供试样品,用于烟叶化学成分测定。
1.4 测定方法
按照YQ/T 29—2013采用高效液相色谱-串联质谱联用法测定TSNAs含量;按照YC/T 383—2010 采用气相色谱-质谱联用法测定生物碱含量;NO3–-N和NO2–-N含量利用紫外-可见分光光度计用比色法进行测定[14]。
1.5 数据分析
采用SPSS 17.0进行数据处理和统计分析。
2 结 果
2.1 不同栽培措施对TSNAs含量的影响
经方差分析和多重比较可知(表2),施氮量对亚硝基假木贼碱(NAB)和NNK含量影响极显著,对亚硝基新烟草碱(NAT)、NNN、TSNAs总量影响显著,A1(施氮量210 kg/hm2)、A2(施氮量255 kg/hm2)的4种TSNAs及其总量(极)显著低于A3(施氮量300 kg/hm2),且A1的4种TSNAs及其总量均最低。打顶时间对NNN、NAT、NAB、NNK和TSNAs总量影响差异极显著,B2(现蕾打顶)的4种TSNAs及其总量(极)显著低于B1(扣心打顶)、B3(初花打顶),尤其是NNN、NNK和TSNAs总量最低,优于B1和B3。BSM同样对4种TSNAs及其总量影响差异极显著,C2的4种TSNAs及其总量最低,表现最佳。据此组合A1B2C2应是最优组合,各TSNAs组分及其总量均最低,尤其是NNN和NNK。
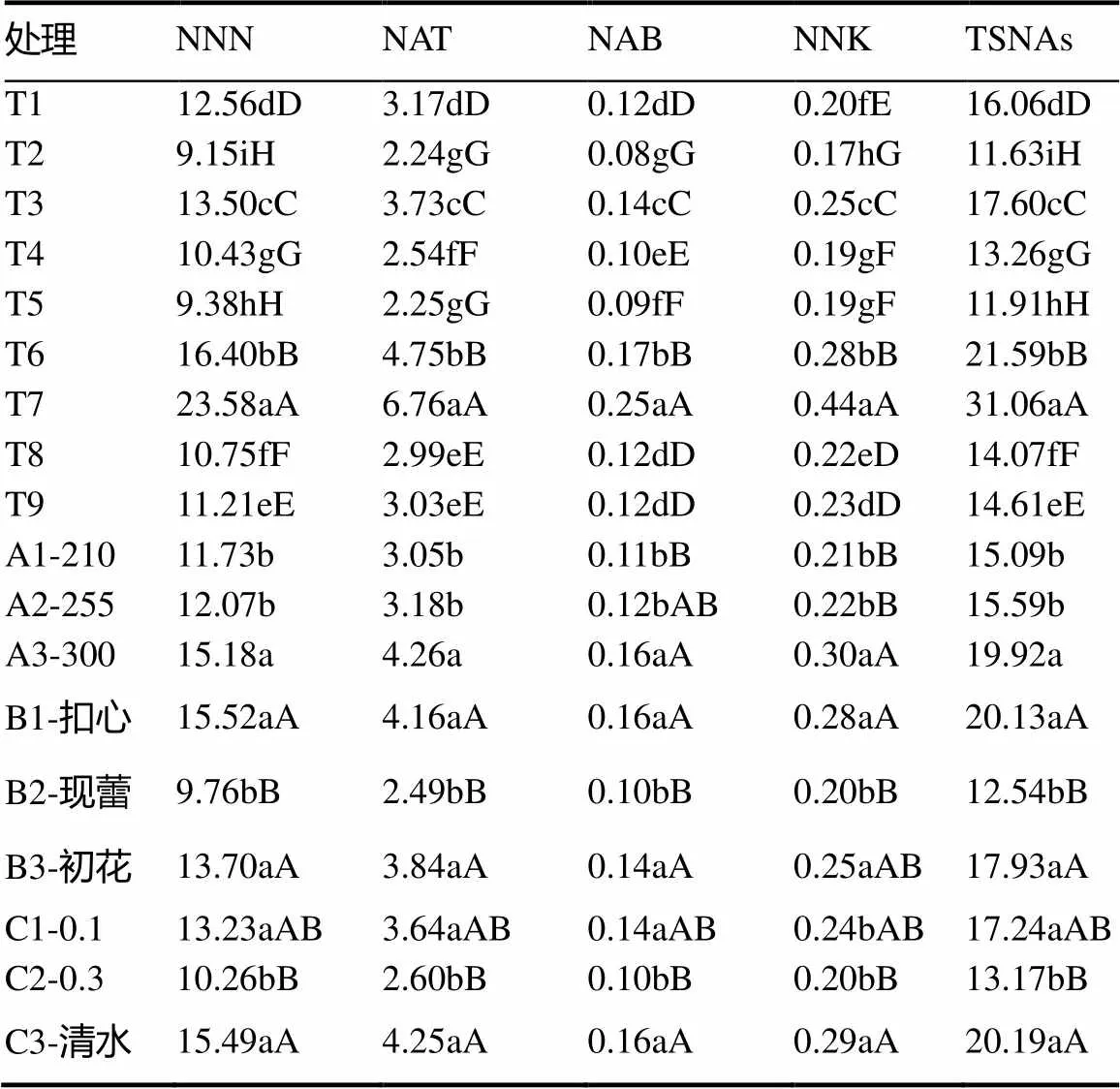
表2 不同处理组合TSNAs含量
注:不同大小写字母表示各处理在0.01和0.05水平差异显著,下同。
2.2 不同栽培措施组合对生物碱含量的影响
从表3可以看出,施氮量对4种生物碱及其总量的影响达(极)显著水平,且是影响降烟碱、烟碱、总生物碱含量的主要因素,A1(施氮量210 kg/hm2)的降烟碱、烟碱、总生物碱含量最低且极显著低于A2和A3。打顶时间对新烟草碱含量影响极显著,B2(现蕾打顶)的降烟碱含量最低且其他生物碱含量适宜。BSM对降烟碱含量影响极显著,对烟碱和总生物碱含量影响显著,C2的降烟碱含量显著低于C1和C3,由于降烟碱对烟叶吸味的负作用大且是NNN重要的前体物[15],对烟叶品质和安全性具有重要影响,白肋烟生产上要求其含量越低越好,据此组合A1B2C2的降烟碱含量最低且生物碱组成比例适宜。
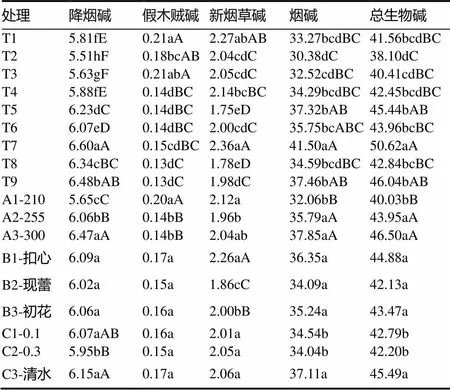
表3 不同处理组合生物碱含量
2.3 不同栽培措施组合对NO3–-N和NO2–-N含量的影响
由表4可知,施氮量对NO3–-N和NO2–-N含量影响极显著,A1(施氮量210 kg/hm2)的NO3–-N和NO2–-N含量最低且极显著低于A2和A3。打顶时间对NO3–-N含量影响极显著,B2(现蕾打顶)的NO3–-N和NO2–-N含量最低。BSM对NO3–-N和NO2–-N含量影响同样极显著,大小均依次为C2<C1<C3,C2时二者含量(极)显著低于C1和C3。因此NO3–-N和NO2–-N含量最低的组合是A1B2C2,这与降低TSNAs含量的最优组合具有一致性。

表4 不同处理组合NO3–-N和NO2–-N含量
2.4 白肋烟TSNAs与生物碱、硝酸盐含量的相关性
由相关性分析可知(表5),达州地区白肋烟上部叶NNN、NAT、TSNAs总量与烟碱、总生物碱、NO3–-N极显著正相关,与降烟碱、NO2–-N显著正相关;NAB、NNK与降烟碱、烟碱、总生物碱、NO3–-N均呈极显著正相关关系,NNK与NO2–-N呈极显著正相关关系。NNN和NNK对人体毒性大且具有较强的致癌性[3],一直是TSNAs降害研究的焦点,通过本试验的相关性分析可知,NNN、NNK、TSNAs总量与降烟碱、硝酸盐呈正相关关系,这与前人的研究结果相一致[15],因此通过田间农艺措施降低TSNAs的前体物生物碱和硝酸盐含量,继而抑制后期TSNAs的形成和积累,对降低TSNAs含量尤其是NNN和NNK含量具有重要意义。
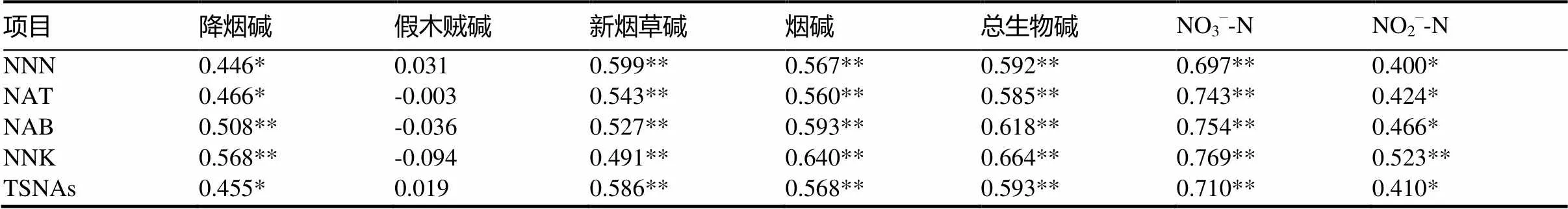
表5 生物碱、硝酸盐与TSNAs的相关系数
注:*表示在0.05水平(双侧)上显著相关;**在0.01水平(双侧)上显著相关。
3 讨 论
田间栽培技术中,氮肥用量对白肋烟产量及品质的影响比其他任何养分都大[1],同时也是影响TSNAs、生物碱、硝酸盐含量的主要因素[5,7-8,16]。本研究结果表明,施氮量对白肋烟上部叶的4种TSNAs及其总量、4种生物碱及其总量、NO3–-N和NO2–-N含量的影响差异达到(极)显著水平,施氮量210 kg/hm2的TSNAs含量最低,且TSNAs及其前体物含量随着施氮量的增加而增加,这与已报道的结果相一致[7]。因为氮元素是构成烟草生物碱、NO3–-N和NO2–-N的必需元素,所以控制施氮量可以有效降低TSNAs前体物的形成和积累,进而减少烟叶在后期调制、复烤、醇化等过程中TSNAs的形成[17-18]。在调查中发现,目前达州白肋烟区田间实际施氮量普遍较高,试验中所用的氮肥最高用量就是该地区多数烟农的实际用量。因此在达州烟区控制氮肥用量,不仅是降低白肋烟上部叶TSNAs含量的需要,也是提高烟叶品质的需要。
打顶改变了烟株生长和物质代谢的中心,并促使烟株体内养分重新调整与分配,是调控烟株营养和烟叶品质的重要栽培措施,尤其对烟株上部烟叶的质量形成具有较大的影响[1]。同时打顶促进了烟株根系的生长发育和对养分的吸收利用,进而对烟碱等次生代谢产物的合成与积累产生较大的刺激作用,不同时期打顶对烟株体内烟碱含量的积累影响不同[6],因此打顶造成的含量变化必将反映到TSNAs的含量上来,适时打顶TSNAs的前体物生物碱和硝酸盐的含量均较低[9-10]。本研究结果表明,打顶时间对上部烟叶的4种TSNAs及其总量的影响差异极显著,现蕾期打顶TSNAs各组分及其前体物生物碱和硝酸盐的含量均较低。因此适时打顶也是白肋烟田间生产实践中降低TSNAs含量和提高烟叶安全性的重要措施。
田间生产中打顶会给烟草造成机械损伤,进而激发烟株的防御性反应,在这一过程中创伤信号的积累和传递起着关键性作用[19]。BSM是本实验室根据食烟性昆虫口腔分泌物研制的一种仿生型信号分子[11-12],前期相关研究表明,BSM可以在信号传导的上游抑制烟草打顶造成的创伤所引发的氧化胁迫[13],影响烟草植株对氮素的吸收、积累与代谢,继而降低了生物碱和硝酸盐在烟株体内的形成与积累,最终降低烟叶中TSNAs含量[14,20-21]。本研究结果也表明,打顶后应用BSM,上部烟叶的TSNAs及其前体物生物碱、硝酸盐含量均较低。
4 结 论
本研究表明,在白肋烟生产中基于田间实际情况合理施用氮肥是降低TSNAs含量的重要措施;在适时打顶、结合应用BSM对降低TSNAs含量也是十分有效的。综合考虑,在四川达州白肋烟产区目前生产条件下,采用施氮量210 kg/hm2+现蕾打顶+0.3 μmol/L BSM这一栽培技术组合,可有效降低上部烟叶TSNAs含量,有利于卷烟工业对白肋烟的可持续利用。
[1] 刘国顺. 烟草栽培学[M]. 北京:中国农业出版社,2003:277-281,252-261.
[2] 王瑞新. 烟草化学[M]. 北京:中国农业出版社,2003:80-83,145-158,165-168,170-174.
[3] IARC.Evaluation of the carcinogenic risk of chemicals to humans: tobacco habits other than smoking: betel-quid and areca nut chewing and some related nitrosamines[R]. Lyon: International Agency for Research on Cancer Scientific Publications, 1985.
[4] CONKLING M. Making blended reduced nicotine tobacco or tobacco specific nitrosamine tobacco, by blending first tobacco with second tobacco produced from genetically modified tobacco plant with reduced quinolate phosphoribosyl transferase level:ΜS2006 237025-A1[P]. 2006-10-26.
[5] 宫长荣,王娜,司辉,等. 氮素形态对烤烟烟叶中TSNA含量的影响[J]. 河南农业大学学报,2003,37(2):111-114.
[6] 韩锦峰,韩富根,刘华山,等. 打顶时间对烤烟特有亚硝胺前体物的影响[J]. 河南农业科学,2009(7):58-60.
[7] CHAMBERLAIN W J, CHORTYK O T. Effects of curing and fertilization on nitrosamine formation in bright and burley tobacco[J]. Beitrage Zur Tabakforschung International, 1992, 15(2): 87-92.
[8] 彭丽丽,韩富根,解莹莹,等. 氮用量对烤烟叶片TSNAs前体物含量及硝酸还原酶活性的影响[J]. 中国烟草学报,2009,15(3):35-38.
[9] 汪安云,秦西云. 打顶留叶数与烤烟品种TSNA形成累积的关系[J]. 中国农学通报,2007,23(8):161-165.
[10] 郭鹏飞,朴龙铁,金玉善,等. 打顶调控对白肋烟主要化学成分及烟草特有亚硝胺含量的影响[J]. 延边大学农学学报,2015,37(1):25-30.
[11] 宗娜,王琛柱. 三种夜蛾科昆虫对烟草烟碱的诱导及其与昆虫下唇腺葡萄糖氧化酶的关系[J]. 科学通报,2004,49(14):1380-1385.
[12] GUAN L M, SCANDALIOS J G. Hydrogen peroxide-mediated catalase gene expression in response to wounding[J]. Free radical biology and medicine, 2000, 28(8): 1182-1190.
[13] 李影,王程辉,周初跃,等. 打顶及仿生信号分子对不同烤烟品种氧化胁迫的影响[J]. 中国烟草科学,2013,34(6):20-23.
[14] 华煜,林国平,黄文昌,等. 仿生型信号分子对烟草硝酸盐、亚硝酸盐的抑制作用[J]. 烟草科技,2010(4):51-53.
[15] 史宏志. 烟草烟碱向降烟碱转化[M]. 北京:科学出版社,2013:16-193.
[16] 谢志坚,涂书新,张嵚,等. 影响烤烟烟碱合成与代谢的因素及其机理分析[J]. 核农学报,2014,28(4):0714-0719.
[17] 边文杰,郭东锋,姚忠达,等. 打叶复烤白肋烟叶 TSNAs 含量变化分析[J]. 安徽农业大学学报,2014,41(3):523-527.
[18] SHI H Z, WANG R Y, BUSH L P, et al. Changes in TSNA contents during tobacco storage and the effect of temperature and nitrate level on TSNA formation[J]. Journal of Agricultural & Food Chemistry,2013,61(47):11588-11594.
[19] 程新胜,沈嘉,曹流俭. 分子信号调节物对烟草上部叶烟碱及其他化学成分影响研究初报[J]. 热带作物学报,2008,2(3):333-337.
[20] 黄兰,王正刚,舒俊生,等. 仿生型信号分子对烟草主要生物碱的抑制作用[J]. 中国烟草学报,2010,16(2):1-5.
[21] LI Y, BIAN W J, YAO Z D, et al. Reduce Tobacco-specific Nitrosamines in Burley Tobacco Using Glucose Oxidase [J]. Tobacco Science & Technology, 2010, 47(1): 13-17.
Effects of Different Cultivation Measures on TSNAs and their Precursors in Burley Tobacco
CHEN Xiang1,2, ZHOU Kaixu3, YANG Xingyou3, XIANG Jie3, HE Zhengchuan4, LIU Li1, ZHANG Yanmin1, CHENG Xinsheng1*
(1. Research Center of Tobacco and Health, University of Science and Technology of China , Hefei 230052, China; 2. College of Agronomy, Anhui Agriculture University, Hefei 230036, China; 3.Dazhou Tobacco Research Institute of Sichuan, Sichuan Dazhou 635000, China; 4. Xuanhan Tobacco Company, Xuanhan, Sichuan 636150, China)
To reveal the effects of different cultivation measures on TSNAs and their precursors in burley tobacco, an orthogonal experiment was conducted with different nitrogen application rates (210, 255 and 300 kg/ha), topping time (topping at buttoning stage, topping at budding stage and topping at initial flower stage) and BSM doses (0.1, 0.3 and 0.0 μmol/L). Contents of TSNAs, alkaloids and nitrate nitrogen were analyzed. The results showed that nitrogen application rate was the main influencing factor of the contents of TSNAs, alkaloids, nitrate-nitrogen and nitrite-nitrogen. Contents of TSNAs and their precursors of upper burley leaves were lower at 210 kg/ha nitrogen fertilizer. Topping time had an extremely significant effect on TSNA contents of upper leaves. When topping at budding stage TSNA contents were significantly lower than that of topping at buttoning stage and topping at initial flower stage. The contents of TSNAs, alkaloids, nitrate-nitrogen and nitrite-nitrogen with BSM treatment after topping were lower. At the conditions of this experiment, the optimal combination to reduce TSNAs is 210 kg/ha nitrogen application rate, topping at budding stage and 0.3 μmol/L BSM.
burley tobacco; nitrogen application rate; topping time; BSM; TSNAs
S572.062
1007-5119(2017)02-0014-05
10.13496/j.issn.1007-5119.2017.02.003
四川省烟草公司项目“基于前体物控制的降低白肋烟TSNAs关键技术研究与集成”(201304);中国烟草总公司重大专项“利用仿生型信号分子降低白肋烟叶TSNAs关键技术研究”(JH-04)
陈 翔(1990-),男,在读博士研究生,研究方向为烟草栽培生理与减害技术研究。E-mail:1012791799@qq.com
,E-mail:xscheng@ustc.edu.cn
2016-06-14
2016-12-29
