成人葡聚糖体疾病的研究进展
2017-05-10露综述肖哲曼审校
雷 露综述, 肖哲曼审校
成人葡聚糖体疾病的研究进展
雷 露综述, 肖哲曼审校
糖原贮积病(glycogen storage disease,GSD)是一组少见的遗传性糖原代谢异常性疾病[1~3]。根据酶缺陷或转运体的不同可分为多个类型。其中GSDⅣ型是由糖原分支酶(the glycogen branching enzyme,GBE)缺乏引起的罕见的常染色体隐性疾病[4]。GSDⅣ型具有临床异质性,影响不同年龄的不同器官,伴随内脏和(或)神经肌肉受损。根据残余GBE酶活性的量,临床上可区分的疾病形式[4]包括:完全丧失GBE酶活性,一般发生在胎儿期或婴儿期,主要影响肌肉和肝脏,为致死性;而低至5%~20%的残余酶活性会影响中枢和周围神经系统及肌肉,导致在幼年或成年发病[4],后者称为成人葡聚糖体疾病(adult polyglucosan body disease,APBD)。
1 糖原贮积病的分型
根据组织分布的特异性,糖原贮积病可分为[3]:(1)不累及肌肉的类型有GSDⅠ型(葡萄糖-6-磷酸酶缺乏症)和GSDⅥ型(肝磷酸化酶缺乏症);(2) 单纯累及肌肉的类型有GSDⅤ型(肌磷酸化酶缺乏症)、GSDⅦ型(肌磷酸果糖激酶缺乏症);(3)既累及肌肉又累及心脏、肝脏、周围神经的有GSDⅦ型(肌磷酸果糖激酶缺乏症)、 GSDⅧ型(磷酸化酶b激酶缺乏症)、GSDⅨ型(磷酸甘油酸激酶缺乏症)、GSDⅩ型(磷酸甘油酸变位酶缺乏症)、GSDⅪ型(肌乳酸脱氢酶缺乏症)、GSDⅫ型(醛缩酶A缺乏症)、GSD型(β-烯醇化酶缺乏症)。根据运动症状,糖原贮积病可分为[5]:(1)急性反复发作的运动症状:运动不耐受,运动相关的肌痛、肌痉挛;反复发作运动诱发的急性肌球蛋白尿/横纹肌溶解,常见于GSDⅤ型(肌磷酸化酶缺乏症)、GSDⅦ型(肌磷酸果糖激酶缺乏症)、 GSDⅧ型(磷酸化酶b激酶缺乏症)、GSDⅨ型(磷酸甘油酸激酶缺乏症)、GSDⅩ型(磷酸甘油酸变位酶缺乏症)、GSDⅪ型(肌乳酸脱氢酶缺乏症)、GSDⅫ型(醛缩酶A缺乏症)、GSD型(β-烯醇化酶缺乏症);(2)持续的进行性肌无力症状:常见于GSDⅡ型(酸性麦芽糖缺乏症)、GSDⅢ型(脱支酶缺乏症)、GSDⅣ型(分支酶缺乏症)。
2 成人葡聚糖体疾病的病因和发病机制
2.1 病因研究 GBE1在糖原生物合成中扮演着重要角色。GBE1通过产生糖原分支,从而产生亲水表面来增加糖原聚合物的溶解度[6],用作主要碳水化合物及跨越多重梯度的能量储存[7]。而Tyr329是GBE1催化结构域中的表面暴露的残基,当Tyr329因突变成为较小的丝氨酸(Ser329)后形成由p.Y329S取代的GBE1构建体,该构建体重组表达使蛋白不稳定和蛋白活性的缺失,从而影响GBE1蛋白结构和功能,导致不良支化形式的糖原积累(即polyglucosan PS)[8~10]。Akman等人的相关研究表明APBD常表现为GBE活性的部分丧失,并在大脑、心脏、肝脏和肌肉的糖原积累更明显[4]。
2.2 发病机制 GBE1缺乏引起神经障碍的机制是未知的[11],有假说表明,葡聚糖包涵体破坏正常的细胞功能,如通过细胞内转运;另一假说是,减少的糖原降解导致星形胶质细胞和神经元的能量缺乏,因为星形胶质细胞主要参与糖原的合成和利用[12]。
3 成人葡聚糖体疾病的临床表现
APBD多见于拥有犹太血统的人群,但在其他种族中也不应完全排除[13,14],男女发病率无明显差异。在家族发病中,受影响的兄弟姐妹总体上遵循相同的疾病过程。最常见的特征是神经源性膀胱、痉挛性截瘫、轴突性多发性神经病变[13,15~18],大多数情况下会出现痴呆。也有三分之一的患者会出现直立性低血压。
3.1 神经源性膀胱 通常为首发症状[13],发病年龄多在50岁之后,表现为痉挛性神经源性膀胱,临床上以尿频、尿急、夜尿增多以及间歇性尿失禁等为主。
3.2 痉挛性截瘫 多在患者出现排尿障碍后数年出现,多呈现进行性锥体束性截瘫,开始时出现步态困难,往往表现为痉挛和无力,腱反射减弱,还可呈现出帕金森病样的晚期阶段,之后可能需要助行器,甚至需要坐轮椅。
3.3 痴呆 患者会出现注意力和记忆力的缺陷,在超过一半的病例中都已注意到认知功能的损害,其与皮质萎缩和白质异常相关。通过早期进行神经心理测试,可有助于早期发现,若APBD患者伴有MRI的特异表现,则可增强神经心理测试的可用性[16]。
3.4 轴突性多发性神经病变 常表现为振动觉的缺失,浅感觉障碍表现为手套-袜套样改变。在随访的大多数患者中,会很快出现感觉异常和(或)感觉减低,一般下肢症状显著。会合并有下肢股四头肌及其他大腿肌群的肌容积减少,在缓慢的功能恶化后继续发展可累积上肢。
4 成人葡聚糖体疾病的辅助检查
4.1 影像学检查 APBD患者往往具有非常相似的MRI表现,头部及脊髓的MRI表现主要包括[13]:(1)脑部皮质及脊髓萎缩几乎存在于所有的患者中。在大多数患者中,有不同程度的小脑蚓部和较不常见的半球萎缩,伴轻微的胼胝体变薄(见图1);(2)脑白质的异常改变,APBD患者的脑白质会出现异常高信号:一般在T2加权像和T2FLAIR上出现,在T1加权像上为正常或低信号(见图2);白质病变部位一般对称出现,主要累及锥体束和大脑半球靠内侧部。通常在脑室周围区域并且大部分在枕叶,颞叶也常累及;外囊和内囊的后肢常受影响,前肢常不受侵犯。病灶融合或多灶,但通常两者同时存在(见图2)。
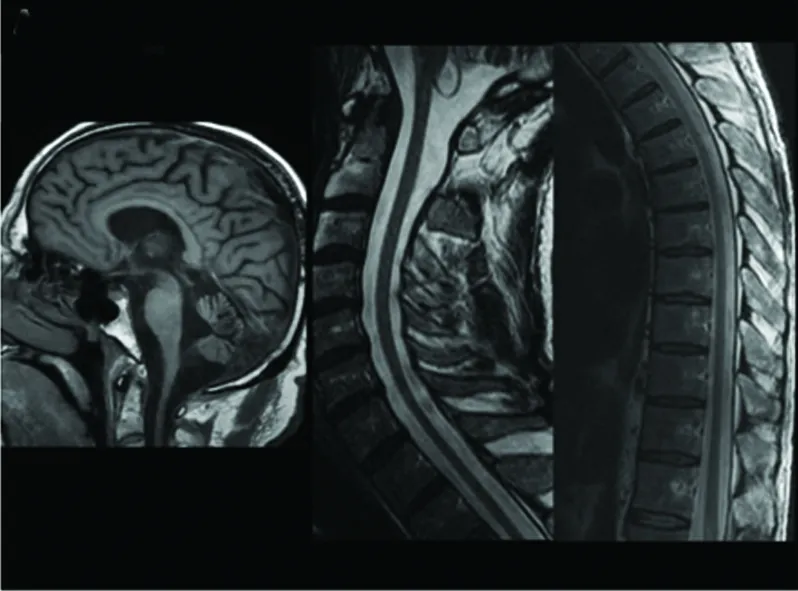
图1 成人葡聚糖体疾病的患者T1加权像显示脑萎缩(左图);T2加权像矢状位显示脊髓萎缩(右图)
4.2 电生理检查 通常是非特异性的。主要表现为:(1)轴索性腰骶神经根病:神经传导速度和肌电图显示轴突腰骶多发性神经根神经病变;(2)感觉运动性多发性神经病[15]:特征在于显著降低的符合运动动作电位和感觉神经动作电位,有传导速度减慢,在胫前肌、腓肠肌、股外侧肌群表现明显。还可发现有f波潜伏期延长的表现;(3)自主神经功能检查:温控排汗试验(thermoregulatory sweat tests)和自主神经反射试验(autonomic reflex testing)显示特定脊髓节段的汗液排泌异常。
4.3 活检 腓神经活检显示神经管内的特征性多聚葡萄糖体。所检测出来的聚葡萄糖体的多寡和特征通常将他们与正在老年个体中发现的罕见多聚葡萄糖区分开。在APBD中具有病理性聚葡萄糖聚集的其他组织:(1)肌肉:不易被淀粉酶消化、PAS阳性是特征性的;(2)肌肉和神经:小的炎症浸润可见于两者;(3)腋下皮肤:在顶分泌腺管腔细胞内,在电子显微镜下聚葡萄糖体的特征是散在的丝状和颗粒状胞质内含物。
4.4 实验室检查 外周血白细胞或皮肤成纤维细胞中GBE酶活性降低,低至对照组的25%或鉴定GBE1突变。GBE1基因检测发现致病性基因突变。
5 成人葡聚糖体疾病的诊断依据
5.1 临床特点 在40岁以上的个体中诊断成人葡聚糖体疾病,包括以下临床特点:(1)进行性神经源性膀胱;(2)由混合的上下运动神经元参与的步态困难(即痉挛和无力);(3)主要发生在下肢远端的感觉丧失;(4)轻度的认知障碍(常常是执行能力障碍);(5)通常见于拥有犹太血统的人群,少数也可见于其他种族;(6)有常染色体隐性遗传的家族史。
5.2 典型的头部及脊髓MRI 脑部皮质及脊髓的萎缩,主要累及锥体束及大脑半球内侧的脑白质的异常高信号影。
5.3 实验室检查 在具有特征性临床表现和脑和脊髓MRI发现的个体中,推荐分子遗传检测;如果分子遗传检测的结果需要明确,则测定皮肤成纤维细胞或肌肉组织中的GBE活性,一般会有GBE活性降低;如果GBE活性的结果需要明确,则进行腓神经活检。
6 成人葡聚糖体疾病的鉴别诊断
6.1 多发性硬化 首先,多发性硬化在全球的发病率及在犹太人中53.7/100 000的患病率远高于APBD的患病率[19]。此外,APBD中进行性痉挛性截瘫、尿失禁及相关的脑白质病变和脊髓萎缩等表现与原发性进行性多发性硬化症高度相似,且发病年龄上也重叠[20]。两种疾病进行区分的关键在于APBD在T2加权像上没有局灶性的脊髓损伤、脑脊液检查寡克隆区带多为阴性[21]。
6.2 脊髓型颈椎病 虽然两者可能共存,但脊髓型颈椎病常表现为亚急性发作的麻木、感觉异常和颈部疼痛,通常有手腕部的症状[22],而APBD一般首先累积下肢,上肢或症状轻或发展至晚期出现症状。
6.3 良性前列腺肥大 该病在60岁以上的男性中估计患病率为50%[23],可与APBD共存。大多数有前列腺肥大者会选择进行前列腺切除术,但若长期无法改善症状,应认为他们的下尿路障碍不仅是由这一种疾病引起,若伴有相关的勃起功能障碍、便秘、常伴有溢流大便、大便失禁及神经系统症状尚不能由前列腺肥大解释时,因进行进一步的病因诊断。
6.4 遗传性痉挛性截瘫、遗传性周围神经病变等一些与APBD症状类似的家族遗传性疾病主要通过基因检测进行鉴别。还有与之鉴别的其他疾病如肾上腺脊髓神经病、老年患者中由严重高血压病或NOTCH3突变引起的脑白质病变、多系统萎缩(运动迟缓、直立性低血压和小脑症状额偶然发生)等;还有一些报道类似于肌萎缩侧索硬化,但仍未发现APBD中任何呈现运动神经元病的表现。
7 成人葡聚糖体疾病的治疗
主要以延缓疾病的发展、改善症状为主,目前有关于免疫抑制剂雷帕霉素对治疗APBD的相关研究,但尚未有进一步的临床研究。
7.1 雷帕霉素及其类似物 为一种抗真菌、抗肿瘤的大环内酯类药物,在此主要作为mTOR(mammalian target of rapamycin)抑制剂,抑制聚葡萄糖聚集和损伤[24];APBD的神经元模型,其可减少葡聚糖的累积,并抵消了其相关的细胞凋亡,但此方法缺乏特异性,作为合成代谢开关,mTOR不仅激活糖原合酶和促进糖异生,而且分解代谢自噬。因此,预期抑制自噬抑制剂mTOR也预期诱导自噬。
7.2 考虑膀胱功能障碍的患者若药物治疗无效,并严重影响日常生活,可考虑膀胱内导尿术及留置导尿管。
7.3 延缓行为及认知障碍的进一步发展。
7.4 预防并发症 防止跌倒,保持排尿通畅,避免泌尿系统疾病发生,因为严重者可能导致尿毒症。
7.5 监测 定期评估膀胱功能、步态、下肢远端的感觉及认知功能。
[1]Dimauro S,Spiegel R.Progress and problems in muscle glycogenoses[J].Acta Myol,2011,30(2):96-102.
[2]Lucia A,Nogales-Gadea G,Perez M,et al.McArdle disease:what do neurologists need to know[J].Nat Clin Pract Neurol,2008,4(10):568-577.
[3]Ozen H.Glycogen storage diseases:new perspectives[J].World J Gastroenterol,2007,13(18):2541-2553.
[4]Orhan AH,Emmanuele V,Kurt YG,et al.A novel mouse model that recapitulates adult-onset glycogenosis type 4[J].Hum Mol Genet,2015,24(23):6801-6810.
[5]Dimauro S,Lamperti C.Muscle glycogenoses[J].Muscle Nerve,2001,24(8):984-999.
[6]Thon VJ,Khalil M,Cannon JF.Isolation of human glycogen branching enzyme cDNAs by screening complementation in yeast[J].J Biol Chem,1993,268(10):7509-7513.
[7]Roach PJ.Glycogen and its metabolism[J].Curr Mol Med,2002,2(2):101-120.
[8]Massa R,Bruno C,Martorana A,et al.Adult polyglucosan body disease: proton magnetic resonance spectroscopy of the brain and novel mutation in the GBE1gene[J].Muscle Nerve,2008,37(4):530-563.
[9]Ziemssen F,Sindern E,Schroder JM,et al.Novel missense mutations in the glycogen-branching enzyme gene in adult polyglucosan body disease[J].Ann Neurol,2000,47(4):536-540.
[10]Froese DS,Michaeli A,Mccorvie TJ,et al.Structural basis of glycogen branching enzyme deficiency and pharmacologic rescue by rational peptide design[J].Hum Mol Genet,2015,24(20):5667-5676.
[11]Akman HO,Raghavan A,Craigen WJ.Animal models of glycogen storage disorders[J].Prog Mol Biol Transl Sci,2011,100:369-388.
[12]Allaman I,Belanger M,Magistretti PJ.Astrocyte-neuron metabolic relationships:for better and for worse[J].Trends Neurosci,2011,34(2):76-87.
[13]Mochel F,Schiffmann R,Steenweg ME,et al.Adult polyglucosan body disease:Natural History and Key Magnetic Resonance Imaging Findings[J].Ann Neurol,2012,72(3):433-441.
[14]Bruno C,Servidei S,Shanske S,et al.Glycogen branching enzyme deficiency in adult polyglucosan body disease[J].Ann Neurol,1993,33(1):88-93.
[15]Colombo I,Pagliarani S,Testolin S,et al.Adult polyglucosan body disease:clinical and histological heterogeneity of a large Italian family[J].Neuromuscul Disord,2015,25(5):423-428.
[16]Rifai Z,Klitzke M,Tawil R,et al.Dementia of adult polyglucosan body disease.Evidence of cortical and subcortical dysfunction[J].Arch Neurol,1994,51(1):90-94.
[17]Lossos A,Meiner Z,Barash V,et al.Adult polyglucosan body disease in Ashkenazi Jewish patients carrying the Tyr329Ser mutation in the glycogen-branching enzyme gene[J].Ann Neurol,1998,44(6):867-872.
[18]Sagnelli A,Savoiardo M,Marchesi C,et al.Adult polyglucosan body disease in a patient originally diagnosed with Fabry’s disease[J].Neuromuscul Disord,2014,24(3):272-276.
[19]Alter M,Kahana E,Zilber N,et al.Multiple sclerosis frequency in Israel's diverse populations[J].Neurology,2006,66(7):1061-1066.
[20]Lossos A,Klein CJ,Mcevoy KM,et al.A 63-year-old woman with urinary incontinence and progressive gait disorder[J].Neurology,2009,72(18):1607-1613.
[21]Rice CM,Cottrell D,Wilkins A,et al.Primary progressive multiple sclerosis:progress and challenges[J].J Neurol Neurosurg Psychiatry,2013,84(10):1100-1106.
[22]Flanagan EP,Krecke KN,Marsh RW,et al.Specific pattern of gadolinium enhancement in spondylotic myelopathy[J].Ann Neurol,2014,76(1):54-65.
[23]Lepor H.Pathophysiology,epidemiology,and natural history of benign prostatic hyperplasia[J].Rev Urol,2004,6(Suppl 9):S3-S10.
[24]Kakhlon O,Glickstein H,Feinstein N,et al.Polyglucosan neurotoxicity caused by glycogen branching enzyme deficiency can be reversed by inhibition of glycogen synthase[J].J Neurochem,2013,127(1):101-113.

图2 成人葡聚糖体疾病患者T2FLAIR显示异常高信号的白质区域:脑室周围,以枕部为主;外囊及内囊后肢(虚圆线);小脑脚中下部的内侧缘(箭头所指);锥体束及脑桥白质的内侧隆起(圆线)
1003-2754(2017)04-0375-03
R745.1
2016-12-09;
2017-01-30
国家自然科学基金资助项目(No.81471133,30900459);湖北省自然科学基金(No.2014CFB734);国家教育部新教师基金(No.200804861046);武汉大学协同创新项目
(武汉大学人民医院神经内科,湖北 武汉 430060)
肖哲曼,E-mail:zmxiao@whu.edu.cn
