海人藻酸致急慢性癫痫模型中Nrf2的变化及其对神经元的影响
2017-05-10向绍杰李纪彤秦文艳刘小虎张冰冰
齐 越, 向绍杰, 姜 鸿, 李纪彤, 秦文艳, 刘小虎, 韦 丹, 张冰冰, 贾 冬
海人藻酸致急慢性癫痫模型中Nrf2的变化及其对神经元的影响
齐 越1, 向绍杰1, 姜 鸿1, 李纪彤3, 秦文艳1, 刘小虎1, 韦 丹2, 张冰冰2, 贾 冬2
目的 探讨海人藻酸致急慢性癫痫模型中Nrf2的变化及其对神经元的影响。方法 大鼠海马内注射浓度为(1 μg/μl)海人藻酸(KA)1.0 μl后,随机分为模型24 h组(急性模型组)及模型28 d组(慢性模型组),假手术组注射等体积的生理盐水,每组10只。尼氏染色法观察神经元的变化;免疫组化及免疫印迹法测定Nrf2的表达。结果 尼氏染色结果显示,与假手术组相比,模型24 h组与模型28 d组尼氏小体均减少,但以模型28 d组减少显著;免疫组化及免疫印迹结果表明,模型24 h组的表达增加,模型28 d组表达则减少。结论 Nrf2在急性模型表达上调,具有抗氧化作用,进而保护神经元;慢性模型中则不具有抗氧化作用,神经元受损。
癫痫; 海人藻酸; Nrf2
氧化应激是指体内的氧化作用与抗氧化作用失衡所致,目前许多疾病的发生均与氧化应激有关,如:癫痫、多发性硬化、帕金森病及肌萎缩性侧索硬化等。大量研究发现,癫痫发生时常伴有非常活跃的自由基活动[1~3]。因此,清除自由基成为阻断癫痫发生的又一新领域。Nrf2-ARE通路是体内内源性抗氧化的一条重要通路,Nrf2是参与调节机体抗氧化应激过程重要转录因子,研究证明,激活Nrf2-ARE信号通路可以有效地减轻氧化应激损伤从而保护神经元。因此本实验考察了Nrf2对海人藻酸致急慢性癫痫模型中神经元的影响,为阐明癫痫的病理生理机制提供实验依据。
1 材料与方法
1.1 实验动物与试剂 选择健康雄性SPF级Wistar大鼠40只,体重180~200 g,辽宁长生生物技术有限公司提供[动物许可证号:SCXK(辽)2010-0001]。动物于辽宁中医药大学附属第二医院实验动物中心饲养,许可证号:SYXK(辽):2010-0003。饲养室温度:20 ℃~23 ℃,饲养室湿度:50%~60%。海人藻酸(KA)(Sigma公司),一抗(Nrf2,北京博奥森生物试剂公司),免疫组化试剂盒(武汉博士德生物技术有限公司),甲苯胺蓝,Nonident P40,EGTA,HEPES,DTT(Solarbio公司),EDTA(Amresco公司)。
1.2 模型制备及分组 参考文献并进行改进[4~6],大鼠腹腔注射水合氯醛(350 mg/kg)麻醉后,固定于脑立体定位仪上,碘酒、酒精消毒,沿颅顶正中线做3~4 cm的手术切口,逐步分离骨膜,寻找囟门位置,以囟门为零点,向后5.7 mm,中线旁开4.6 mm,深约4.3 mm。牙科钻刺破颅骨后,微量进样器垂直进针,缓慢匀速地注射浓度为(1 μg/μl)KA 1.0 μl,留针5 min,待KA充分弥散后缓慢撤针(假手术组大鼠注射等体积的生理盐水),碘伏酒精再次消毒后,缝合皮肤。从注入脑内KA后的时间点算起,4 h内大鼠达到Racine分级的Ⅳ以上为造模成功。判断癫痫发作程度按照Racine[7]制定的分级法:0级:正常,无任何反应;Ⅰ级:面部出现抽搐、眨眼、咀嚼、哈欠、胡须颤抖;Ⅱ级:出现点头动作、颈部肌肉抽动、频繁的出现“湿狗样动作”;Ⅲ级:出现一侧前肢阵挛;Ⅳ级:出现双侧前肢阵挛、后肢站立;Ⅴ级:双侧前肢阵挛、后肢站立、失去平衡、跌倒。将造模成功的大鼠随机分为急性模型组(模型成立后24 h)及慢性模型组(模型成立28 d后,每组10只,假手术组10只。
1.3 标本制备 各组大鼠分别于模型成立24 h及28 d后,冰上取脑,快速分离出海马,称重,液氮冷冻后,用于免疫印迹检测;余下大鼠腹腔注射水合氯醛(350 mg/kg)实施麻醉后,将其固定在手术台上,暴露心脏,预冷的生理盐水心脏灌流,待流出的血液呈无色澄清时,换成4%多聚甲醛进行灌流,直至大鼠身体变僵硬为止,取脑,放入4 ℃的4%多聚甲醛固定,用于HE染色、尼氏染色及免疫组化检测。
1.4 HE染色 按常规方法对脑组织标本进行HE染色。
1.5 尼氏染色 将石蜡切片标本常规脱蜡至水后,浸入到10 g/L 的甲苯胺蓝溶液中染色6 min,蒸馏水浸泡5 min,用于去除浮色,再依次放入70% 乙醇2 min,95%乙醇乙醇5 min,无水乙醇3 min;二甲苯透明两次,每次5 min,中性树胶封片[8]。显微镜下观察各组大鼠海马CA1区神经细胞尼氏小体的染色情况。
1.6 免疫组化染色 石蜡切片常规脱蜡,脱水后,按照DBA 试剂盒说明书进行免疫组化染色,显微镜下观察大鼠海马区的病理变化,并使用Image J 软件对经免疫组化染色的大脑切片海马区40倍放大图片进行灰度值分析。
1.7 Western blot 印迹法检测海马Nrf2的表达 各组大鼠的海马组织按照10 ml/g的比例加入全细胞裂解液,组织进行匀浆、超声破碎后,加入400 μl Buffer A(1 mol HEPES 400 μl,pH 7.9;1 mol KCl 400 μl,0.1 mmol EDTA 40 μl;0.1 mmol EGTA 40 μl;加入去离子水39.12 ml。临用前加入50 μl 10% NP-40,20 μl 0.1 mol DTT/1 ml buffer A和1× PMSF)液,移液器反复吹打混匀,冰上裂解15 min,震荡10 s,12000 ×g,离心3 min,转移上清(即胞浆蛋白),加入30 μl Buffer B(1 mol HEPES 800 μl,pH 7.9;5 mol NaCl 3.2 ml,0.1 mmol EDTA 400 μl;0.1 mmol EGTA 400 μl;加入去离子水35.2 ml。临用前加入10 μl 0.1 mol DTT/1 ml buffer B和1× PMSF,3倍沉淀体积)液到沉淀中,重新悬浮细胞核,冰上裂解30 min,12000×g,离心15 min,取上清,即为核蛋白[9]。BCA 法蛋白定量,12% SDS-PAGE 凝胶电泳,转膜到PVDF 膜。PVDF膜经过5% 脱脂牛奶封闭2 h后,与Nrf2一抗( 1∶500)进行杂交反应,4 ℃过夜后,PBS漂洗3 次,每次10 min。加入相对应的二抗( 1∶3000),杂交反应2 h。Tris-Nacl 漂洗3 次,每次10 min,加入ECL 发光液,反应5 min,暗室内进行X 线胶片曝光、显影和定影。同一张PVDF 膜再次经过一二抗去除液去除后,再与β-actin ( 1∶500 ) 进行杂交反应。Western blot 印迹条带经Gel-oc凝胶成像分析系统扫描处理。
2 结 果
2.1 HE染色 假手术组可见神经元完整,细胞排列整齐且有层次,细胞核及核仁清晰,形态完整,与假手术组相比,模型24 h组可见,神经元细胞排列较疏松,形态欠完整,层次感稍差;模型28 d组表现为神经元细胞排列疏松无层次感,完整的神经元细胞较少,呈空泡样的神经元细胞较多,核仁不清,固缩神经元细胞较多,可见大量坏死神经元细胞,细胞与细胞间的缝隙较大(见图1)。
2.2 尼氏染色 假手术组大鼠海马CA1区神经元细胞结构清晰、排列整齐,染色质分布均匀,可见丰富蓝色颗粒状的尼氏小体,与假手术组相比,模型24 h组可见,神经元细胞排列稍松散,尼氏小体减少;模型28 d组可见,神经元细胞结构明显改变,数目减少,核内染色质凝集,尼氏小体显著减少(见图2)。
2.3 各组大鼠Nrf2免疫组织化学表达结果 Nrf2 免疫反应在大鼠脑内锥体细胞的胞浆和胞核均可见其表达,可见棕黄色颗粒(见图3)。对3组大鼠脑内 Nrf2 表达的平均光密度值(OD)测量,与假手术组相比,模型24 h组内的Nrf2表达增加,模型28 d组Nrf2表达则显著减少(P<0.05,见表1)。
2.4 Nrf2免疫蛋白印迹 KA模型大鼠24 h组海马组织胞核内的 Nrf2 的表达明显增强,而在假手术组和模型大鼠28 d组 Nrf2 表达相对较弱,且模型大鼠28 d组 Nrf2 表达更弱于假手术组(见图4),Nrf2 与 β-action 免疫印迹条带相对吸光度比值,假手术组比模型28 d组增加显著,模型24 h组比假手术组明显增加,具有明显统计学意义(P<0.01,见表2)。

表1 不同组别小鼠海马组织Nrf2免疫组织化学 染色结果
与对照组比较*P<0.05;与模型组比较#P<0.05
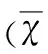
表2 各组小鼠海马组织Nrf2蛋白表达水平±s)
与对照组比较*P<0.05;与模型24 h组比较#P<0.05

A:假手术组;B:模型24 h 组;C:模型28 d组
图1 各组大鼠HE染色结果( ×10)
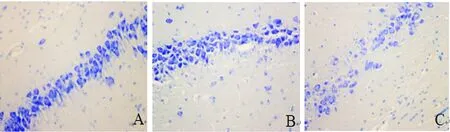
A:假手术组;B:模型24 h 组;C:模型28 d组
图2 各组大鼠造模后海马CA1区的尼氏染色(×20)

A:假手术组;B:模型24 h组;C:模型28 d组
图3 各组大鼠造模后大脑皮质Nrf2免疫组织化学染色(×40)

模型24 h组 假手术组 模型28 d组
图4 各组大鼠海马组织Nrf2蛋白表达水平
3 讨 论
研究发现,癫痫大鼠海马CA3区的钙超载现象在癫痫发病机制中起到了重要的作用。CA3区钙超载可破坏膜电位的稳定性,从而导致病灶向周围正常组织放电,如CA1区,此发病机制与癫痫大发作的发病机制相同。此外,海马 CA3区神经元凋亡也是海人藻酸颞叶癫痫模型的一个显著的病理特点[10,11]。另外,我们前期的预实验表明,浓度为(1 μg/μl)的KA 1.0 μl注入到海马CA1区时可造成大鼠过半的致死量,而同样剂量注入到海马CA3区时致死量则大大降低,且癫痫发作程度与其无差异,因此,我们选用(1 μg/μl)的KA 1.0 μl单次注入海马CA3区,致痫潜伏期短,癫痫发作率高。
中枢神经系统在遭受外界药物或内毒素侵害时,其抗氧化系统就会发生紊乱,产生大量的活性氧。过多的活性氧可引起脂质过氧化并且造成DNA损伤,从而引发神经系统变性疾病,不断发展的神经系统变性疾病则有可能诱导其痫性发作。有文献报道,大鼠海马CA3区注射海人酸可导致其痫性发作,同时对其脑内生化指标进行检测时发现有大量的活性氧生成。另有研究表明,匹罗卡品制备的癫痫模型中发现,大鼠脑内发生了明显的氧化应激损伤,有大量的氧自由基存在[12]。由此我们可知,氧化应激参与了癫痫的发生与发展。
Nrf2-ARE信号通路可编码的内源性保护基因超过200个,分别起到抗氧化、抗炎及抗凋亡等作用。生理状态下,Nrf2存在于细胞浆中与Keap1紧密结合,处于低活性状态,并且此复合物很容易被泛素蛋白酶迅速降解,当机体受到外界刺激和内源性毒素侵害时,Nrf2与Keap1解离,解离后的Nrf2转位进入细胞核,在细胞核中与Maf等小分子物质结合形成异二聚体,此异二聚体又可以与抗氧化元件ARE结合,诱导其下游的抗氧化蛋白及解毒酶的基因表达,以此来抵抗外界刺激和内毒素的侵害[13,14]。激活Nrf2-ARE信号通路则可以有效地减轻氧化应激损伤从而保护神经元。
但是,目前关于Nrf2-ARF信号通路在癫痫发病过程中的表达改变尚未有明确相关报道。本研究结果显示,急性癫痫(模型24 h组)发作后,海马组织细胞核内Nrf2表达明显增加,说明急性癫痫发作激活了Nrf2信号通路;慢性癫痫(模型28 d组)发作则细胞核内Nrf2表达显著减少,说明Nrf2信号通路失活;与此同时,神经元HE染色及尼氏染色结果表明,与假手术组比较,模型24 h组及模型28 d组的神经元受损,尼氏小体减少,但以模型28 d组神经元损伤较重,尼氏小体减少的更为突出。以上实验结果说明,急性癫痫发作可激活Nrf2信号通路,进而发挥抗氧化作用,保护神经元,减少海马损伤;而慢性癫痫发作时,由于大量自由基的长期作用,可使Nrf2-ARE信号通路失活,无法发挥其抗氧化作用,从而诱导神经元发生凋亡或坏死。
因此,激活Nrf2-ARF信号通路,诱导其编码的内源性保护基因产物的生成,能够有效减少癫痫后氧化应激损伤,可能是癫痫治疗的潜在靶点。
[1]唐雄林,黄瑞雅,黄建敏,等.红藻氨酸致病大鼠海马突触素的表达变化及辛醇的干预作用[J].中国神经免疫学和神经病学杂志,2009,16(5):348-355.
[2]李志梅,赵永青.颞叶癫痫患者认知功能及其影响因素的研究[J].脑与神经疾病杂志,2009,17:405-408.
[3]王笑亮.Nrf2在中框神经系统疾病中的神经保护作用[J].医学研究生学报,2011,24(7):754-757.
[4]韦 丹,齐 越,贾 冬,等.白细胞介素-4水平在海人藻酸致痫大鼠海马内表达动态规律变化研究[J].辽宁中医杂志,2015,42(3):648-650.
[5]康 凯,齐 越,贾 冬,等.癫痫清颗粒对海人藻酸致痫大鼠海马内肿瘤坏死因子及白细胞介素-4表达的影响[J].辽宁中医杂志,2015,42(10):1996-1998.
[6]张冰冰,齐 越,贾 冬,等.癫痫清颗粒对海人藻酸癫痫大鼠脑组织氨基酸类神经递质含量及学习记忆能力的影响[J].中华中医药学刊,2016,34(3):609-611.
[7]Costello DJ,Cole AJ.Treatment of acute seizures and status epilepticus[J].Intensive Care Med,2007,22(6):319-347.
[8]刘小虎,向绍杰,齐 越,等.戊四唑急性癫痫模型海马病理组织的变化[J].中国药理学通报,2015,31(4):514-518.
[9]Yue Qi,Li-Bo Zou,Li-Hua Wang,et al.Xanthoceraside inhibits pro-inflammatory cytokine expression in Aβ25-35/IFN-γ-stimulated microglia through the TLR2 receptor,MyD88,nuclear factor-κB,and mitogen-activated protein kinase signaling pathways [J].J Pharmacol Sci,2013,122(4):305-317.
[10]隋宏锦,张力琴,洪昭雄,等.海人酸诱导癫痫模型海马的形态学改变[J]. 解剖科学进展,1997,3(2):103-108.
[11]杨忠旭,栾国明,阎 丽,等.颞叶癫痫大鼠模型的建立及长期癫痫敏感性的研究[J].中华医学杂志,2004,84(2):152-155.
[12]Jabs R,Seifert G,Steinhauser C.A strocytic function and its alteration in the epileption brain[J].Epilepsia,2008,49(2):3-15.
[13]Van Cott AC.Epilepsy and EEG in the elderly[J],Epilepsia,2002,43:94-102.
[14]钟 敏.Nrf2 -Keap1 抗氧化系统研究进展[J].中国公共卫生杂志,2006,22(3):360-362.
Expression of Nrf2 on epileptic rat model induced by kianic acid and effect on neuron
QIYue,XIANGShaojie,JIANGHong,etal.
(LiaoningProvinceChineseMedicineResearchInstitute,Shenyang110034,China)
Objective To investigate the expression of Nrf2 in epileptic rat model induced by kianic acid and its effect on neuron.Methods Rats were injected kianic acid (1 μg/μl)1.0 μl into hippocampal,and divided randomly into model 24 h (acute model group),model 28 d (chronic model group),sham group were inject equal volume saline,10 for each group.We observed the change of neuron by using Nissl staining; Immunohistochemistry and Western blotting were to measure the expression of Nrf2.Results Compared with sham,the results of Nissl staining suggested that Nissl bodies in nervous cells decreased in model 24 h group and model 28 d group,and especially in model 28 d group;the results of Immunohistochemistry and Western blotting demonstrated that the expression of Nrf2 increased in model 24 h group,decreased in model 28 d group.Conclusion Nrf2 had possible neuroprotective effect in acute kianic acid model and the mechanism was probably related to the upregulation the expression of Nrf2.
Epilepsy; Kianic acid; Nrf2
1003-2754(2017)04-0328-04
2016-12-09;
2017-03-30
国家科技部“十二五”“重大新药创制”专项课题(2012ZX09102201-005);辽宁省科技厅基金资助项目(2004226010-6)作者单位:(1.辽宁省中医药研究院,辽宁 沈阳 110034; 2.辽宁中医药大学,辽宁 沈阳 110847;3.辽宁中医药大学附属第三医院,辽宁 沈阳 110032)
贾 冬,E-mail:jiadg2003@126.com
R742.1
A
