促红细胞生成素对新生大鼠皮质神经元体外缺氧缺糖损伤的保护作用研究
2017-05-10杜和谦吕晓红
王 妮, 郝 宁, 杜和谦, 吕晓红
促红细胞生成素对新生大鼠皮质神经元体外缺氧缺糖损伤的保护作用研究
王 妮, 郝 宁, 杜和谦, 吕晓红
目的 研究rhEPO对新生大鼠皮质神经元氧糖剥夺(OGD)损伤的保护作用及rhEPO的作用剂量及作用时间。方法 新生Wistar大鼠皮质神经元原代培养7 d~11 d,随机分为正常对照组、OGD损伤组和rhEPO处理组。(1)建立皮质神经元的OGD模型,给予不同剂量的rhEPO(0.1、1、10、100 U/ml);(2)在不同时间(OGD损伤后0 h、24 h、48 h)给予10 U/ml rhEPO。观察各组细胞形态学改变,MTT法检测细胞存活率。结果 与OGD损伤组比较,rhEPO(0.1、1、10 U/ml)处理可增加OGD损伤的皮质神经元的存活率(P<0.05),且浓度为10 U/ml时rhEPO保护作用最强(P<0.05)。皮质神经元OGD损伤后立即加入rhEPO(10 U/ml)保护作用最强(P<0.05),损伤后24 h及48 h给药没有增加皮质神经元存活率。结论 rhEPO对体外缺氧缺糖损伤的大鼠皮质神经元具有保护作用,rhEPO有效浓度为0.1~10 U/ml,且其浓度为10 U/ml时保护作用最强;rhEPO 在神经元损伤后立即给药保护作用最强。
促红细胞生成素; 皮质神经元; 缺氧缺糖损伤; 保护作用
促红细胞生成素(erythropoietin,EPO)主要由肝脏和肾脏合成,能够促进红细胞生成。重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)在脑缺血损伤中的保护作用和保护机制已经被大量研究证实,但众多研究未明确rhEPO在脑缺血性损伤中的有效剂量及作用时间窗。为避开动物实验中药代动力学的影响,本实验建立体外新生大鼠脑皮质神经元氧糖剥夺(oxygen-glucose deprivation,OGD)损伤模型,研究EPO对缺血性脑损伤的保护作用,为临床应用rhEPO治疗急性脑梗死提供实验依据。
1 材料和方法
1.1 材 料
1.1.1 动物 24 h内新生健康清洁级Wistar大乳鼠,雌雄不限,由吉林大学实验动物中心提供,动物许可证号:SCXK(吉)2013-0001。
1.1.2 主要试剂 rhEPO由沈阳三生制药股份有限公司提供(10000 kU/L,生产批号:201506114V);DMEM/F12培养基、Neurobasal-A培养基、B27、L-谷氨酰胺购自美国Gibco公司;青霉素/链霉素(160 万U/100ml)、噻唑蓝(MTT)、DMSO购自美国Sigma公司;胰酶购自美国Difco公司;胎牛血清购自杭州四季青公司;兔抗鼠神经元特异烯醇化酶(NSE)、山羊抗兔免疫组化试剂盒、DAB显色试剂盒购自武汉博士德公司。
1.1.3 实验设备 由吉林大学第一医院转化医学研究院神经内科实验室提供。
1.2 实验方法
1.2.1 原代皮质神经元的培养 取2只新生Wistar大鼠于75%酒精中浸泡消毒,无菌分离大脑皮质,剪碎脑组织,加入8 ml浓度为0.25%的胰酶37 ℃消化20 min;用含20%胎牛血清的DMEM/F12终止消化,吸量管吹打30~40次;用200目滤网过滤2次,离心后弃上清液;加入2~4 ml含10%胎牛血清的DMEM/F12,吹打制成细胞悬液,细胞计数后以1×106/L、5×105/L的密度分别接种在96孔板和24孔板的细胞爬片上(96孔板及24孔板的细胞爬片预先以1%的多聚赖氨酸包被过夜),置于37 ℃、体积分数为5%CO2、95% N2的培养箱内培养;种板4 h后全量换液,更换为神经元专用培养基(内含48.5 ml Neurobasal-A培养基、1 ml B27、0.5 ml L-谷氨酰胺、313 μl青链霉素);种板48 h后加入5-溴-2’-脱氧尿苷(终浓度为5 μmol/L);种板72 h后全量换神经元专用培养液,以后每72 h半量换液,倒置显微镜下定期观察细胞形态变化(见图1)。
1.2.2 体外培养神经元纯度鉴定 培养7 d后取出细胞爬片,用NSE抗体进行免疫细胞化学染色,阴性对照用PBS代替一抗。胞浆或突触内含棕黄色颗粒为神经元,高倍镜下每张细胞爬片随机选取5个视野,阳性率=神经元数/细胞总数。计数阳性神经元达90%以上,符合实验要求。
1.2.3 神经细胞OGD模型制备 根据我们之前的实验发现神经元培养至第7天~第11天为生长稳定期,且OGD 15 h损伤对神经元生存率的影响适中[1],选取处于稳定期的细胞制备OGD模型。取培养至第7天的神经元,将培养液更换成无糖DMEM液,置于37 ℃含95%N2和5%CO2的缺氧箱中培养15 h。
1.2.4 实验分组
1.2.4.1 不同剂量rhEPO处理与OGD损伤的关系 神经元培养至第7天时取2块96孔板,编号为1、2,分为3组:(1)正常对照组:选择1号板的10孔为正常对照组;(2)OGD损伤组:2号板神经元进行OGD15h,选择10孔(B2-B11)为OGD损伤组;(3)rhEPO处理组:取2号板,OGD15 h后选择C2-C11、D2-D11、E2-E11、F2-F11孔分别给予10 μl/孔rhEPO,使rhEPO终浓度为100 U/ml、10 U/ml、1 U/ml、0.1 U/ml,继续培养24 h,于光镜下观察各组神经元形态变化,噻唑蓝[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]法测量各组光密度(optical delnsity,OD)值,计算神经元存活率。
1.2.4.2 不同时间rhEPO处理与OGD损伤的关系 根据1.2.4.1得最佳剂量为10 U/ml,种板第7天取2块96孔板,编号为A、B,分3组:(1)正常对照组:取A板,选择10孔为正常对照组;(2)OGD损伤组:B板神经元进行OGD15 h,选择10孔(B2-B11)为OGD损伤组;(3)rhEPO处理组:取B板,分别于OGD 15 h后0 h、24 h、48 h选择C2-C11、D2-D11、E2-E11给予终浓度为10 U/ml的rhEPO。最后于光镜下观察各组神经元形态变化,MTT法测量各组OD值,计算神经元存活率。
2 结 果
2.1 神经细胞形态学特征 神经元接种4 h后几乎全部贴壁,并可观察到少数细胞开始长出短小突起,胞体折光性较强,说明细胞活性良好;48 h后,胞体增大,细胞突起增多延长;72 h时,神经元胞体继续增大,突起继续延长且形态多样,胞体折光性强,少数区域出现胞体聚集现象;种板7 d时神经元生长旺盛,细胞突起增多伸长,相互交织成密集的神经细胞网络。
2.2 神经元纯度鉴定 阳性细胞表现为胞体及突触呈棕黄色,细胞核呈蓝紫色,阴性细胞表现为胞体及突触无着色,仅细胞核被染为蓝紫色(见图2)。计数神经元阳性率在90%以上。
2.3 不同剂量rhEPO对OGD损伤后原代皮质神经元存活率的影响 与OGD损伤组相比,rhEPO浓度为0.1~10 U/ml,可提高原代皮质神经元存活率,差异有统计学意义(P<0.05);当rhEPO浓度为10 U/ml时,神经保护作用最强,与其他剂量组比,差异有统计学意义(P<0.05)(见表1)。神经元形态学改变(见图3)。OGD损伤组细胞部分坏死,胞体及胞核肿大并空化,细胞间突触联系减少;少数细胞凋亡,胞体缩小,胞膜尚完整;多数细胞仍存活。rhEPO终浓度0.1 U/ml及1 U/ml组除中央可见皱缩细胞,仍有较多神经细胞存活。rhEPO终浓度10 U/ml组,存活细胞数量最多,细胞形态完整,皱缩细胞散布于正常神经元之间。而rhEPO终浓度为100 U/ml组存活细胞数量最少,有大量细胞碎片分布(如图3F箭头所示)。
2.4 不同时间rhEPO对OGD损伤后原代皮质神经元存活率的影响 与OGD损伤组、OGD损伤后24 h、48 h rhEPO处理组相比,OGD损伤后立即给予终浓度为10 U/ml的rhEPO处理,可提高原代皮质神经元的存活率,差异有统计学意义(P<0.05);与OGD损伤组相比,OGD损伤后24 h、48 h行同样浓度的rhEPO处理,无神经保护作用,其差异有统计学意义(P<0.05)(见表2)。神经元形态学改变(见图4)。OGD损伤后立即给予rhEPO处理,存活细胞数最多,中间散在皱缩细胞。而OGD损伤后24 h、48 h给予rhEPO处理,存活细胞数少,视野内散在大量细胞碎片。

表1 不同剂量rhEPO对神经元存活率的影响
OGD损伤组及rhEPO处理组1、2、3、4与正常对照组相比#P<0.05;rhEPO处理组2、3、4与OGD损伤组相比*P<0.05;rhEPO处理组2与其余各组相比ΔP<0.05
表2 不同时间rhEPO对神经元存活率的影响
OGD损伤组及rhEPO处理组与正常对照组相比#P<0.05;rhEPO处理组与OGD损伤组相比*P<0.05
3 讨 论
脑卒中是导致死亡和残疾的主要原因之一。目前脑梗死的治疗手段非常有限,在急性缺血性卒中动物模型中超过1000种有效的化合物已经开发出来,但几乎没有一个被批准用于临床[2]。重组组织型纤溶酶原激活物(recombinant tissue plasminogen activator,rtPA)是目前唯一被批准在临床使用的药物。但rtPA的治疗范围相对狭窄,并非每位患者都适用,且增加了脑出血的风险,对白色血栓的治疗效果不佳。因此,开发更安全、更有效的治疗方法十分必要。
EPO在中枢神经系统是一个很有发展前景的神经保护剂,其神经保护作用和机制已经被大量研究证实,EPO主要的作用机制包括抗炎症反应、抗氧化作用、抗神经元凋亡、促进血管生成等[3,4]。最近一项研究发现,rhEPO对于白色血栓即血小板血栓诱导的局部缺血性卒中也可以发挥神经保护作用[5]。然而,EPO可以促进红细胞增殖,导致在系统性应用EPO时可能产生许多副作用,如血栓形成、高血压、肿瘤进展或癫痫。因此研究EPO的有效剂量及有效作用时间十分必要。
本研究通过建立体外新生大鼠皮质神经元OGD模型,发现rhEPO(0.1~10 U/ml)可增加OGD损伤的皮质神经元的存活率,且浓度为10 U/ml时rhEPO神经保护作用最强。当rhEPO浓度大于10 U/ml时,rhEPO保护作用消失。Souvenir R在NGF诱导PC12细胞系分化的神经元中,OGD后即给予0 U/ml、3 U/ml、10 U/ml、30 U/ml的rhEPO,发现10 U/ml的剂量时保护作用最强,30 U/ml时无神经保护作用[6]。本研究结果与之大致相同,提示rhEPO对神经细胞的活性可能呈双向调节作用,高浓度EPO可能抑制神经细胞活性,这与我们之前的研究结果一致[1]。高剂量的EPO丧失神经保护作用可能的机制为:EPO可以结合两种受体,即高亲和性的同源二聚体(EPOR/EPOR)和低亲和性的异源二聚体(CD131/EPOR)受体。在大多数非造血细胞,EPO通过结合低亲和性的异源二聚体受体发挥神经保护作用,如CD131基因敲除的小鼠表现出正常的造血功能而缺乏组织保护作用[7]。另一个证据是氨基甲酰化的促红细胞生成素(carbamylated erythropoietin,CEPO),一种EPO衍生物,由于其不刺激红细胞生成的神经保护作用而引起广泛关注。Liu X等通过糖尿病视网膜病变动物模型的研究发现CEPO通过CD131发挥神经保护作用,进一步说明EPO通过结合低亲和性的异源二聚体受体发挥神经保护作用[8]。高剂量的EPO产生不利影响可能涉及下调异源二聚体受体,EPOR会增加而相应的CD131没有增加,导致异源二聚体CD131/EPOR的比例下降。同源二聚体EPOR以高亲和力与EPO结合,使EPO介导的神经保护作用减弱或消失[9,10]。另外,Ehrenreich发现血小板生成素(thrombopoietin,TPO)在神经系统可以诱导神经细胞凋亡,由于EPO和TPO的受体结合区域结构相似,因此,高浓度的EPO可能与神经系统的血小板生成素受体(thrombopoietin receptor,TPOR)结合,在神经细胞内引发强大的凋亡信号,进而促进细胞凋亡[11]。
通过实验我们发现皮质神经元OGD损伤后立即给予rhEPO保护作用最强,损伤后24 h、损伤后48 h给药没有增加皮质神经元存活率。Gao Y等在沙鼠脑缺血模型中的研究结果提示10 min~1 h为急性损伤到早期恢复阶段的转变时间,1 d~3 d是从早期恢复阶段到晚期恢复阶段的转变时间,而前者可能是EPO治疗的“黄金时间”[12]。一项研究结果与之相符,在制备新生大鼠脑缺血缺氧模型后分别于0 h、1 h、3 h给予单剂量rhEPO治疗,通过比较快速听觉处理能力和脑室的大小发现0 h组、1 h组、3 h组的疗效依次减弱,其中缺血损伤后立即给予rhEPO疗效最明显,1 h组、3 h组的治疗甚至无保护作用[13]。在该模型中,以往有研究曾发现脑缺血缺氧损伤6 h~12 h大脑皮质、纹状体、苍白球、CA1区的凋亡细胞数量呈现出高密度分布,而rhEPO腹腔内注射后,在脑内达到峰值的时间是脑缺血损伤后10 h,这提示了缺血缺氧损伤后立即腹腔注射单剂量rhEPO,可在大量神经元凋亡之前起到保护作用[14]。以上研究结果大致相同,但是Reitmeir R等在小鼠脑局部缺血性损伤72 h后开始给予脑室内注射EPO 10 U/d直到第30天,发现EPO也可以明显改善神经功能的恢复[15]。Cramer SC等[16]在临床研究中也提出了治疗的时间窗,但他认为缺血性脑卒中发病24 h~48 h后接受EPO治疗较发病6 h内即开始接受EPO治疗的有效性和安全性可能更好,但尚有待证实。以上研究结果不尽相同,需要更多的实验研究去探索EPO的作用时间窗。
本研究结果表明,rhEPO 对急性缺血性脑损伤有明确的治疗作用,但目前有关rhEPO的研究大部分为动物实验,要实现其临床应用仍需要开展大量临床试验。且需要解决如rhEPO的作用时间、有效剂量、安全性等问题,随着临床研究的深入,rhEPO有望成为治疗急性脑梗死的新方法。希望本研究结果能为今后临床应用rhEPO治疗急性脑梗死提供实验和理论依据。
[1]王晓芳,王 妮,吕晓红.促红细胞生成素预处理在脑缺血性损伤中神经保护作用的体外研究[J].中风与神经疾病杂志,2016,33(7):584-587.
[2]O'Collins VE,Macleod MR,Donnan GA,et al.1,026 experimental treatments in acute stroke[J].Ann Neurol,2006,59(3):467-477.
[3]Lombardero M,Kovacs K,Scheithauer BW.Erythropoietin:a hormone with multiple functions[J].Pathobiology,2011,78(1):41-53.
[4]Merelli A,Czornyj L,Lazarowski A.Erythropoietin as a new therapeutic opportunity in brain inflammation and neurodegenerative diseases[J].Int J Neurosci,2015,125(11):793-797.
[5]Theriault P,Le BA,ElAli A,et al.Sub-acute systemic erythropoietin administration reduces ischemic brain injury in an age-dependent manner[J].Oncotarget,2016,7(24):35552-35561.
[6]Souvenir R,Fathali N,Ostrowski RP,et al.Tissue inhibitor of matrix metalloproteinase-1 mediates erythropoietin-induced neuroprotection in hypoxia ischemia[J].Neurobiol Dis,2011,44(1):28-37.
[7]Brines M,Grasso G,Fiordaliso F,et al.Erythropoietin mediates tissue protection through an erythropoietin and common beta-subunit heteroreceptor[J].Proc Natl Acad Sci USA,2004,101(41):14907-14912.
[8]Liu X,Zhu B,Zou H,et al.Carbamylated erythropoietin mediates retinal neuroprotection in streptozotocin-induced early-stage diabetic rats[J].Graefes Arch Clin Exp Ophthalmol,2015,253(8):1263-1272.
[9]Bahrer C,Felderhoff-Mueser U,Wellmann S.Erythropoietin and ischemic conditioning-why two good things may be bad[J].Acta Paediatrica,2007,96(6):787-789.
[10]Weber A,Dzietko M,Berns M,et al.Neuronal damage after moderate hypoxia and erythropoietin[J].Neurobiol Dis,2005,20(2):594-600.
[11]Ehrenreich H,Hasselblatt M,Knerlich F,et al.A hematopoietic growth factor,thrombopoietin,has a proapoptotic role in the brain[J].Proc Natl Acad Sci USA,2005,102(3):862-867.
[12]Gao Y,Mengana Y,Cruz YR,et al.Different expression patterns of Ngb and EPOR in the cerebral cortex and hippocampus revealed distinctive therapeutic effects of intranasal delivery of Neuro-EPO for ischemic insults to the gerbil brain[J].J Histochem Cytochem,2011,59(2):214-227.
[13]Alexander ML,Hill CA,Rosenkrantz TS,et al.Evaluation of the therapeutic benefit of delayed administration of erythropoietin following early hypoxic-ischemic injury in rodents[J].Dev Neurosci,2012,34(6):515-524.
[14]Statler PA,McPherson RJ,Bauer LA,et al.Pharmacokinetics of high-dose recombinant erythropoietin in plasma and brain of neonatal rats[J].Pediatr Res,2007,61(6):671-675.
[15]Reitmeir R,Kilic E,Kilic U,et al.Post-acute delivery of erythropoietin induces stroke recovery by promoting perilesional tissue remodelling and contralesional pyramidal tract plasticity[J].Brain,2011,134(1):84-99.
[16]Cramer SC,Fitzpatrick C,Warren M,et al.The beta-hCG+erythropoietin in acute stroke (BETAS) study:a 3-center,single-dose,open-label,noncontrolled,phase IIa safety trial[J].Stroke,2010,41(5):927-931.

A:培养4 h;B:培养48 h;C:培养72 h;D:培养7 d
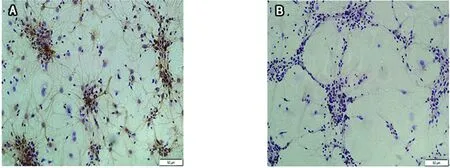
A:阳性细胞 B:阴性细胞

A:正常对照组;B:OGD损伤组;C:rhEPO终浓度0.1 U/ml;D:rhEPO终浓度1 U/ml;E:rhEPO终浓度10 U/ml;F:rhEPO终浓度100 U/ml
图3 不同剂量rhEPO作用下原代皮质神经元的形态学改变(×200)
Study on protection of erythropoietin on oxygen-glucose deprivation induced injury in primary cultured rat cortical neurons
WANGNi,WANGXiaofang,HAONing,etal.
(DepartmentofNeurologyandNeuroscienceCenter,FirstHospitalofJilinUniversity,Changchun130021,China)
Objective To explore the protective effects of rhEPO against oxygen-glucose deprivation(OGD) in rat primary cortical neurons and the effective dose and duration of action of rhEPO.Methods Cortical neurons of neonatal Wistar rats after 7~11 days’ primary culture were randomly divided into control group,OGD group and rhEPO treatment group.The OGD model of cortical neurons was established.After OGD,cortical neurons were treated with different doses of rhEPO(0.1 U/ml、1 U/ml、10 U/ml、100 U/ml) and were given with 10 U/ml rhEPO on each time point after OGD 0 h,24 h,48 h.The changes of morphology of the cells were observed under microscope.Then detected cells’ survival rate by MTT assay.Results Compared with OGD group,the survival rate of neurons was higher in the rhEPO treatment group (0.1 U/ml、1 U/ml、10 U/ml)(P<0.05).The protection was the most significant when the concentration of rhEPO was 10 U/ml (P<0.05).And the cortical neurons’ survival rate was the highest when given with 10 U/ml rhEPO after OGD immediately(P<0.05).Whereas,the survival rate of cells treated with the same dosage were not increased after OGD 24 h and 48 h.Conclusion Erythropoietin protected neonatal rat cortical neurons against injury induced by oxygen-glucose deprivation.And the effective concentration was 0.1~10 U/ml,of which the dose of 10U/ml was the most effective.Moreover,the protection was the most obvious when cortical neurons was given with 10 U/ml rhEPO after OGD immediately.
Erythropoietin; Cortical Neurons; OGD; Protective Effects

A:正常对照组;B:OGD损伤组;C:OGD损伤后0 h;D:OGD损伤后24 h;E:OGD损伤后48 h
1003-2754(2017)04-0299-05
2016-12-07;
2017-03-30
(吉林大学白求恩第一医院神经内科和神经科学中心,吉林 长春130021)
吕晓红,E-mail:lvxiaohong.student@ sina.com
R743.3
A
