高效液相法测定牛奶中4-硝基咪唑抗生素残留
2017-05-09刘奇琳黄祥晖廖素兰
刘奇琳,黄祥晖,廖素兰
(武夷学院茶与食品学院,福建武夷山354300)
高效液相法测定牛奶中4-硝基咪唑抗生素残留
刘奇琳,黄祥晖,廖素兰
(武夷学院茶与食品学院,福建武夷山354300)
建立了一种分子印迹固相萃取(MISPE)-高效液相色谱法同时测定奶粉中4-硝基咪唑抗生素残留的方法,样品经自制磁性分子印迹聚合物富集净化、酸性甲醇-水(9∶1,体积比)洗脱后,用高效液相-紫外检测器测定。检测波长320 nm,色谱柱温39℃,流动相为乙腈-1.0%乙酸/水(体积比),线性范围为20~5 000μg/L,检测限为3.71μg/L,应用此方法对实际奶粉样品中4-硝基咪唑抗生素测定,89.4%~96.6%,相对标准偏差小于10%。该方法具有操作简单便捷、快速、灵敏高效等优点,可满足实际工作的需要。
高效液相;4-硝基咪唑;抗生素;奶粉
硝基咪唑类药物(nitroimidazoles)是一类有硝基咪唑环结构的药物,因为其具有独特的抗菌抗原虫作用,在畜禽等动物养殖领域被较普遍地使用。因其潜在的致畸和致癌性,已经被国际上许多国家列入违禁药物名单[1-3],也被欧盟规定禁止用于食用动物。2002年美国食品与药物管理局(FDA)公布了禁止使用的抗生素名单中就有包括多种硝基咪唑化合物。在我国,农业部和国家药品监督管理局也规定硝基咪唑类药物及其盐、酯及制剂不准添加入动物饲料中,也不允许在食品中使用[4]。
目前,硝基咪唑类抗生素的常用检测方法主要有气相色谱法[5]、液相色谱法[6-12]及免疫分析法[13]等。气相色谱法需衍生,免疫法的检测项目有限,质谱法仪器昂贵。由于在实际样品中硝基咪唑的含量很低且基质的成分复杂,因此在检测之前通常需要对实际样品进行预富集处理。固相萃取(solid phase extraction,SPE)是目前比较常用的预富集方法[14-15],它具有操作简便快速、溶剂用量少等特点。磁性分子印迹聚合物(MMIP)结合了磁性和分子印迹聚合物的优点;采用MMIP固相萃取高效液相紫外(HPLC-UV)测定动物源性食品奶粉中4-硝基咪唑药物残留量;探索简单快捷、灵敏、成本低,可以用来快速检测4-硝基咪唑抗生素的残留。
1 实验部分
1.1 仪器与试剂
高效液相色谱仪:Agilent 1260 LC(配备紫外检测器,二元泵、脱气泵、色谱工作站)、自动进样器和柱温箱,美国安捷伦公司;C18色谱柱(150 mm×4.6 mm,5 μm);超声清洗器:上海跃进医用光学器械厂;水浴恒温摇床:上海博讯实业有限公司医疗设备厂;pH计:哈纳沃德仪器有限公司;干燥烘箱:上海精宏实验设备有限公司;分析天平。
4-硝基咪唑(4-nitroimidazole,4-NMZ)标准品,百灵威科技有限公司;乙腈,色谱纯,Sigma公司;氯化钠,冰醋酸,分析纯,西陇化工股份有限公司;纯净水,娃哈哈;甲醇,分析纯,广东光华科技股份有限公司;盐酸,分析纯,天津市北方天医化学试剂厂;柠檬酸、磷酸二氢钠、氢氧化钠,分析纯,上海展云化工有限公司;有机相针式滤膜、一次性有机相针式过滤器,天津市津腾实验设备有限公司;一次性无菌注射器,山东新华安得医疗用品有限公司;硝唑磁性分子印迹聚合物。
1.2 溶液的配制
0.1 mol/L柠檬酸-McIlvaine缓冲液:将21 g柠檬酸溶于水,并定容到1 L;将1 L的0.1 mol/L柠檬酸和625 mL 0.2 mol/L磷酸二氢钠混合均匀(调节pH到5)。
准确称取4-NMZ 50.0 mg,用甲醇溶解并定容至50 mL,配制成质量浓度为1.0 mg/mL的标准储备液,放置4℃冰箱中避光保存。临用时取标准储备液,配制成一系列质量浓度的混合标准液。
1.3 色谱条件
色谱柱:Agilent C18柱(250 mm×4.6 mm,5μm);流动相:乙腈-1%乙酸水溶液;流动相流速:1mL/min;柱温:39℃;进样量:8μL;紫外检测波长:320 nm;梯度洗脱程序见表1。

表1 梯度洗脱程序Table 1 Program of gradient elution
1.4 标准曲线及定量参数
用流动相溶液将硝基咪唑标准工作液稀释成20~5 000μg/L系列浓度的混合工作液,如前所述的色谱条件对混合标准工作液依次进样3次,分别以各种物质的质量浓度C(μg/L)对峰面积A进行线性回归分析。并测定检出限(instrument detection limit,IDL)。
1.5 样品前处理方法
将100mg MMIPs加入到烧杯中,分别用5mL甲醇、去离子水活化;取5 mL乙腈奶样加入20mL纯净水和20mL柠檬酸-Mcllvaine缓冲溶液,混合后在25℃,300 r/min振荡萃取,再与活化的MMIPs混合,以300 r/min的转速在25℃条件下振荡;提取完成后,磁场分离;加入90%甲醇水溶液(pH=2)3mL洗涤MMIPs;磁场分离,收集洗脱液,用0.45μm滤膜过滤,待测。
2 结果与讨论
2.1 色谱条件的选择
2.1.1 检测波长的选择
对4-硝基咪唑抗生素进行紫外全波长扫描,结果显示其在310~320 nm范围内有最大紫外吸收波长,因此选择320 nm的波长检测。
2.1.2 流动相的选择
试用了乙腈-1.0%乙酸水溶液作为流动相,发现分离效果较好。酸性条件下硝基咪唑类药物呈离子状态,便于分离,峰型尖锐,峰型较好,改变出峰时间,改善峰型前沿和抑制拖尾的现象,提高了分离度。通常流动相乙酸的浓度对目标物质的保留有很大的影响。考察了0.5%、0.8%、1.0%以及1.2%的乙酸对4-硝基咪唑色谱保留的影响,实验结果发现随着乙酸浓度的增加,4-硝基咪唑出峰时间缩短;考虑到色谱柱使用寿命,不宜使用过低的pH溶液,选择1.0%为实验流动相浓度。
2.1.3 柱温的选择
改变柱温,对色谱保留造成一定的影响。考察了不同柱温(37、38、39、40、41℃)对色谱保留的影响,综合考虑39℃时色谱保留较为理想,因此选择39℃为实验柱温。
2.1.4 流速的选择
提高流速可以加快物质的出峰速度,降低流速会延长出峰时间、降低柱效。改变流速对目标物质的保留有一定作用。一般用来对色谱图做精细调节。
在其他最优色谱条件下考察了0.8、0.9、1.0、1.1、
1.2 mL/min这5个流速对4种抗生素的分离效果,发现实验范围内的流速混合标准液均能完全分离,随着流速的增加,混合标准液的分离时间缩短。综合考虑流速为1mL/min时的效果最为理想,柱子压力小。
2.1.5 标准溶液色谱图
综合上述因素,最终采用1%乙酸/水(体积比)为流动相,采用梯度洗脱程序,实现了4 min内4-硝基咪唑快速分离检测,标准色谱图如图1所示,峰形尖锐,峰对称性好。
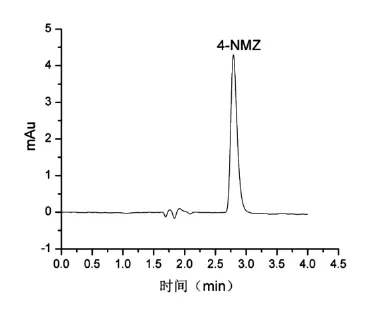
图1 4-硝基咪唑抗生素标准溶液色谱图Figure 1 4-nitro imidazole antibiotic standard solution chromatograms
2.2 标准曲线的线性范围、检出限、精密度
定量采用外标法,所得标准曲线和相关参数见表2。从表中可知,4-硝基咪唑抗生素在20~5 000μg/L浓度范围内具有极好的线性,相关系数R2为0.999 99。经测定标样的检出限为3.71μg/L,相对标准偏差3.2%。

表2 标准曲线和相关参数Table 2 Standard curve and calibration parameters
2.3 实际牛奶粉样品的测定
采用磁分散固相萃取-HPLC方法对实际奶粉样品中的4种硝基咪唑抗生素残留进行检测,奶粉中均未检出这4种物质,实际奶粉样品测定色谱图见图2。对实际奶粉样品的加标回收率为89.4%~96.6%,相对标准偏差小于10%。加标奶粉样品色谱图见图3。实际奶粉样品测定的前处理过程中采用90%的甲醇水溶液(pH=2)3.0 mL洗涤MMIPs,洗脱液未经氮气吹干和进一步浓缩,简化了前处理步骤,节约了时间与成本。
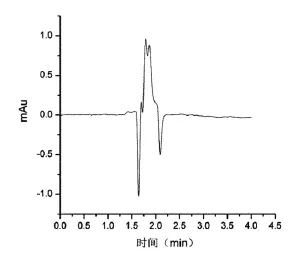
图2 空白奶粉样品色谱图Figure 2 Blank milk powder sample chromatograms
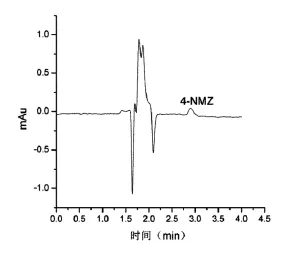
图3 加标奶粉样品色谱图Figure 3 Add themilk powder sample chromatograms
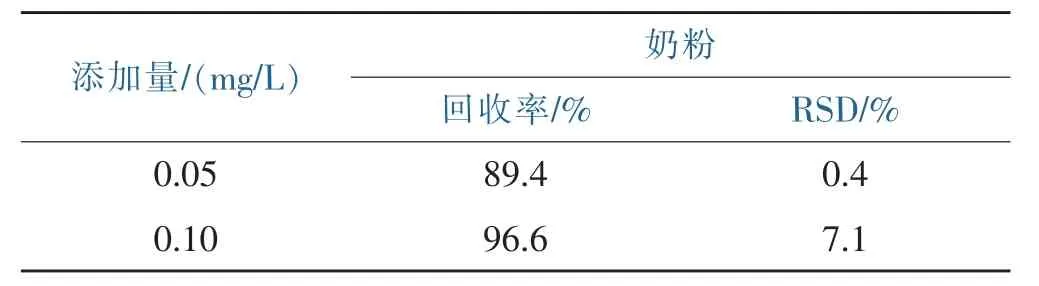
表3 4-硝基咪唑抗生素在奶粉中的平均回收率及精密度Table 3 The recovery and RSD of 4-NMZ standard addition for realmilk power samples
3 结论
建立了一种磁性固相微萃取-HPLC法同时测定奶粉中4-硝基咪唑抗生素的方法,该方法对奶粉中的4-NMZ的回收率进行测定,回收率89.4%~96.6%,相对标准偏差小于10%。证明建立的方法可对奶粉中的硝基咪唑药物进行检测,且具有简便、成本低、较高的特异性和灵敏性。
参考文献:
[1]MUDRY M,CARBALLO M,DE V M,et al.Mutagenic bioassay of certain pharmacological drugs:III.Metronidazole (MIZ)[J].Mutation Research/Fundamental and Molecular Mechanisms ofMutagenesis,1994,305(2):127-132.
[2]CAVALIERE A,BACCIM,AMOROSIA,et al.Induction of lung tumors and lymphomas in BALB/c mice by metronidazole[J].Tumori,1983,69(5):379-382.
[3]POLZER J,GOWIK P.Validation of a method for the detection and confirmation of nitroimidazoles and corresponding hydroxylmetabolites in turkey and swinemuscle bymeans of gas chromatography-negative ion chemical ionization mass spectrometry[J].Journal of Chromatography B:Bimedical Sciences and Applications,2001,761(1):47-60
[4]黎翠玉,吴敏,严丽娟,等.高效液相色谱-串联质谱测定动物源性食品中硝基咪唑类药物及其代谢物残留量[J].食品安全质量检测学报,2012(1):17-22.
[5]NEWKIRK D,RIGHTER H,SCHENCK F,et al.Gas chromatographic determination of incurred dimetridazole residues in swine tissues[J].Journal-Association of Official Analytical Chemists,1989,73(5):702-704.
[6]SEMENIUK S,POSYNIAK A,NIEDIELSKA J.Determination of nitroimidazole residues in poultry tissues,serum and eggs by high-performance liquid chromatography[J].Biomed Chromatogr,1995,9(5):238-242.
[7]张鸿伟,简慧敏,林黎明,等.液相色谱-四极杆/离子阱质谱快速测定蜂蜜中痕量硝基咪唑类药物及其代谢物残留[J].分析测试学报,2012(7):763-770.
[8]张璐,孔祥虹,王菡,等.在线净化-超高效液相色谱同位素稀释串联质谱法检测蜂蜜中硝基咪唑类及其代谢物的残留[J].分析化学,2014(12):1735-1742.
[9]张璐,孔祥虹,何强,等.超高效液相色谱-串联质谱联用法对奶粉中3种硝基咪唑残留物的测定[J].分析测试学报, 2010(3):306-309.
[10]何强,孔祥虹,李建华,等.超高效液相色谱-串联质谱法同时测定蜂蜜中硝基咪唑类、磺胺类、喹诺酮类兽药残留[J].分析试验室,2010(8):61-65.
[11]王扬,郑重莺,何丰,等.高效液相色谱法测定罗非鱼肌肉中硝基咪唑类多组分残留量[J].食品科学,2011(20):197-199.
[12]陈瑞春,艾连峰,郭春海,等.液相色谱同位素稀释串联质谱法测定牛奶和奶粉中3种硝基咪唑类禁用兽药及其代谢物的残留量[J].中国食品卫生杂志,2011(6):543-549.
[13]STANKER LH,MCKEON C,WATKINSB E,etal.Detection of dimetridazole and other nitroimidazole residues in turkey using an immunoassy[J].Journal Agriculture and Food Chemistry,1993,41(5):1332-1336.
[14]STUBBINGSG,TARBIN J,COOPER A,et al.A multiresidue cation-exchange clean up procedure for basic drugs in produce of animal origin[J].Analytica Chimica Acta, 2005,547(2):262-268.
[15]高小龙,王大菊,汪纪仓,等.蜂产品中硝基咪唑类药物残留高效液相色谱研究[J].湖北大学学报(自然科学版),2008, 30(1):71-75.
(责任编辑:叶丽娜)
Determ ination of 4-Nitroim idazole Antibiotic in M ilk Sam ples Using High Performance Liquid Chromatography
LIU Qilin,HUANG Xianghui,LIAO Sulan
(School of Tea and Food Science,Wuyi University,Wuyishan,Fujian 354300)
Amolecularly imprinted solid-phaseextraction(MISPE)-high performance liquid chromatography(HPLC)method hasbeen developed for determination of4-nitroimidazole antibiotic inmilk power.The analyteswere firstenriched and purified through amagnetic MISPE,and elutedwith acidmethanol-watersolution(9∶1,V/V),then detected by a HPLCwith a UV detector.The detectionwavelengthwas320 nm and the column temperaturewas39℃,usinggradientelution processwith acetonitrile-1.0%aceticacid/water(V/V)as themobilephase.The linearity rangewas 20~5 000μg/L,the limitof detection was 3.71μg/L.The recovery ranges of standard addition for realmilk power sampleswere 89.4%~96.6%,RSD less than 10%.Proving thismethod iseasy,rapid,sensitiveand efficienttomeettheneedsofactualwork.
high performance liquid chromatography(HPLC);nitroimidazoles;antibiotics;milk power
O657.72
A
1674-2109(2017)03-0017-04
2016-12-30
国家自然科学基金项目(201407118);武夷学院科技项目(XL201303)。
刘奇琳(1974-),男,汉族,讲师,主要从事化学工程食品安全的研究。
