人脐带间充质干细胞分离、鉴定方法及其治疗难治性免疫性血小板减少症的有效性及安全性研究
2017-05-04黄斯勇白喜龙伍艳兰王刚锋罗红香梁英民
黄斯勇,白喜龙 ,伍艳兰,胡 彬,王刚锋,王 颖,张 蓉,罗红香,徐 静,梁英民
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)是从人脐带华通胶中分离出来的一种基质细胞,在疾病治疗方面具有广阔的应用前景,已成为国内外研究热点之一。免疫性血小板减少症(immune thrombocytopenia,ITP)是一种自身免疫系统疾病,其主要发病机制是机体对自身抗原的免疫失耐受,导致免疫介导的血小板破坏增多及巨核细胞生成血小板减少,是临床常见的出血性疾病之一。目前,临床治疗ITP以皮质激素、免疫抑制剂及脾切除为主,但复发率较高,且长期使用皮质激素的不良反应较多,尤其是难治性ITP,尚缺乏有效的治疗手段[1-2]。近年有研究显示,脐带间充质干细胞(UC-MSCs)具有低免疫原性和免疫调节性,为ITP的治疗提供了新思路[3]。本研究旨在探讨hUC-MSCs分离、鉴定方法及其治疗难治性ITP的有效性及安全性,现报道如下。
1 对象与方法
1.1 研究对象 选取2016年12月—2017年7月西安高新医院收治的难治性ITP患者6例,均符合ITP诊断标准[2],且经糖皮质激素、免疫球蛋白、免疫抑制剂或促血小板生成素等治疗无效、复发,或不能耐受免疫抑制剂维持治疗。排除标准:(1)合并严重心、肺、肾等重要脏器疾病者;(2)合并3级及以上心肺功能不全者;(3)对间充质干细胞或制备试剂过敏者;(4)合并肿瘤或肿瘤高危风险者。本研究经西安高新医院医学伦理委员会审核批准,所有患者及其家属自愿参加并在充分了解治疗方案前提下签署知情同意书。
1.2 hUC-MSCs分离、鉴定方法
1.2.1 主要试剂 DMEM/F12细胞培养基、磷酸盐缓冲液(PBS)(美国Thermo Fisher Scientific公司)、胎牛血清(美国Gemini公司)、胰蛋白酶消化液、左旋谷氨酰胺、β-巯基乙醇(β-ME)、二甲基亚砜(DMSO)、青链霉素混合液(北京鼎国昌盛生物技术有限公司)、重组人碱性成纤维细胞生长因子(bFGF)、丁基羟基茴香醚(BHA)、Forskolin腺苷酸环化酶激活剂(美国Aladdin公司)、全反式维甲酸(美国Sigma公司)、氢化可的松、胰岛素、氯化钾、氯化钠、HEPES、氯化镁、氯化钙、Glucose、Glycine(北京索莱宝科技有限公司)、表皮细胞生长因子(EGF)、B-27添加剂(美国Gibco公司)。
1.2.2 hUC-MSCs组织来源 脐带取自足月剖宫产健康产妇,且产妇乙型肝炎病毒(HBV)抗原、抗丙型肝炎病毒(HCV)抗体、抗人类免疫缺陷病毒(HIV)抗体、抗梅毒螺旋体抗体、支原体、抗EB病毒抗体、抗巨细胞病毒抗体等检测均为阴性。经产妇或其亲属授权同意并签署知情同意书,留取新鲜脐带,并立即放入盛有DMEM/F12细胞培养基的容器中密封。在容器外贴上标签,注明产妇姓名、住院号和新生儿出生时间、性别、体质量。
1.2.3 hUC-MSCs分离和培养 由陕西圆梦生命科学研究院干细胞与转化研究中心依据《干细胞制剂质量控制及临床前研究指导原则(试行)》《人体细胞治疗研究和制剂质量控制技术指导原则》《细胞移植治疗技术规范》(征求意见稿)等相关法律法规要求,参照文献[4],采用酶消化法在无菌条件下于超净台内用含100 U青链霉素混合液的PBS充分冲洗脐带,尽量清除残留积血。用无菌组织剪将脐带剪成1~2 mm3大小的组织块,随后将组织块悬液转移至50 ml离心管中,加入终浓度为0.1%的胶原酶Ⅱ,37 ℃条件下消化1 h。将组织块悬液转移至离心管内,室温条件下2 000 r/min离心30 min,弃去上清液,采用PBS重悬组织块,加入终浓度为0.125%胰蛋白酶消化液,37 ℃条件下消化30 min,随后加入10%胎牛血清,终止消化。消化混合物经200目细胞筛过滤,滤去未完全消化组织,将滤液收集至离心管中,室温下2 000 r/min离心20 min,弃去上清液,收集细胞。采用DMEM/F12细胞培养基重悬分离细胞,反复吹打混匀,计数细胞。将细胞浓度调整为106/cm2,接种于10 cm培养皿中,置于37 ℃、5%二氧化碳(CO2)培养箱中培养。培养72 h后弃去旧培养基,用无菌PBS轻柔、缓慢冲洗细胞生长表面,去除未贴壁细胞,更换新鲜DMEM/F12细胞培养基。之后每3 d更换1次培养基,倒置相差显微镜下观察各阶段细胞形态变化,并拍照记录。待贴壁细胞生长达80~90%融合度时用0.25%胰蛋白酶消化液消化传代,获得原代细胞。
1.2.4 hUC-MSCs免疫表型鉴定 收集第3代hUC-MSCs,采用含0.1%胎牛血清的PBS洗涤1次,室温条件下1 000 r/min离心5 min,弃去上清。用含0.1%胎牛血清的PBS重悬细胞,并调整细胞密度为106/ml,将细胞悬液转移至流式管,每个流式管加入100 μl细胞悬液。分别加入PE标记的小鼠抗人单克隆抗体CD73、CD90、CD105及APC标记的小鼠抗人单克隆抗体CD3、CD11b、CD19,同时设抗PE小鼠IgG1和抗APC小鼠IgG1为同型对照。加入抗体浓度为100∶5,充分振荡细胞悬液,避光4 ℃孵育30 min。经BD FACSCalibur流式细胞仪检测,采用Cellquest Pro软件分析结果。
1.2.5 成骨诱导分化实验 将生长状态良好的第3代hUC-MSCs以5×104/孔接种于6孔板中,应用DMEM/F12细胞培养基培养12~18 h。待细胞完全贴壁后更换成骨诱导培养基(DMEM/F12细胞培养基、10%FBS、100 U青霉素/链霉素、1 mM丙酮酸钠、2 mM左旋谷氨酰胺、1 μM地塞米松、10 mM β-磷酸甘油和50 μg/ml抗坏血磷酸盐)。每隔3 d更换1次培养基,诱导18 d,对细胞行茜素红染色,显微镜下观察细胞,并拍照记录。以茜素红染色呈红色为阳性。
1.2.6 成脂诱导分化实验 将生长状态良好的第3代hUC-MSCs以5×104/孔接种于6孔板中,应用DMEM/F12细胞培养基培养12~18 h。待细胞完全贴壁后更换成脂诱导培养基(DMEM/F12细胞培养基、10%胎牛血清、100 U青霉素/链霉素、1 mM丙酮酸钠、2 mM左旋谷氨酰胺、1 μM地塞米松、0.5 mM IBMX、0.5 mM消炎痛和10 μM膜岛素)。每3 d更换1次培养基,诱导21 d,行油红O染色,显微镜下观察细胞,并拍照记录。以油红O染色后观察到脂滴为阳性。
1.3 治疗方法 6例患者均输注hUC-MSCs(1×106/kg),输注后1个月如患者血小板计数(PLT)≤50×109/L可重复输注1次。输注途径为通过输血器静脉输注,输注前给予异丙嗪、葡萄糖酸钙预防过敏,输液速度约为60滴/min,输注24 h内严密观察患者生命体征变化。
1.4 观察指标 所有患者至少随访3个月,随访截至2017-11-01,观察临床疗效、复发情况及治疗期间不良反应发生情况。完全反应:治疗后PLT≥100×109/L且无出血;有效:治疗后PLT≥30×109/L且较基础PLT增加≥2倍,无出血;无效:治疗后PLT<30×109/L或较基础PLT增加<2倍或有出血;复发:治疗有效后,PLT降至30×109/L以下或是基础PLT的2倍以下或出现出血症状[2]。需要注意的是评价临床疗效时需至少检测2次PLT,且两次检测时间至少间隔7 d;评价病情是否复发时需至少检测2次PLT,且两次检测时间至少间隔1 d。总有效率=(完全反应+有效)/总例数×100%。

2 结果
2.1 hUC-MSCs形态学鉴定 采用酶消化法分离、培养hUC-MSCs,可见原代细胞贴壁生长并逐渐融合成片状,形态均一,倒置相差显微镜下观察细胞类似于成纤维细胞,成长梭形流水状贴壁生长,细胞形态良好,并随着细胞传代,细胞形态未发生变化(见图1)。
2.2 hUC-MSCs免疫表型 流式细胞术检测结果显示,hUC-MSCs高表达CD73、CD90、CD105,表达量均>98.0%;不表达或低表达CD3、CD11b、CD19(见图2)。
2.3 hUC-MSCs分化能力 正常hUC-MSCs呈长椭圆形(见图3A);第3代hUC-MSCs成骨诱导18 d,细胞聚集汇合且呈多层重叠生长,形成圆形钙化结节沉积,周围折光性增强,茜素红染色着色呈红色(见图3B);第3代成脂诱导21 d,油红O染色,倒置显微镜下观察hUC-MSCs形成较大的脂滴(见图3C)。

注:A为放大40倍,B为放大100倍
图1 倒置相差显微镜下hUC-MSCs形态学表现
Figure1 Morphological features of hUC-MSCs under inverted phase contrast microscope
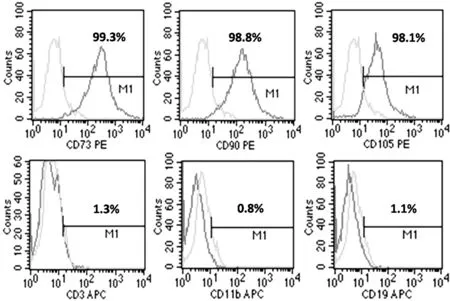
图2 hUC-MSCs免疫表型表达情况
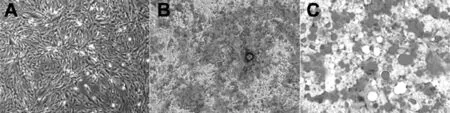
注:A为正常人脐带间充质干细胞(hUC-MSCs)(倒置相差显微镜,×100);B为hUC-MSCs成骨分化(茜素红染色,×100);C为hUC-MSCs成脂分化(油红O染色,×100)
图3 hUC-MSCs分化能力
Figure3 Differentiation ability of hUC-MSCs
2.4 临床特征及临床疗效 本组患者中男2例,女4例;年龄42~73岁,中位年龄63岁;前期治疗包括泼尼松(Pred)、静脉注射丙种球蛋白(IVIg)、重组人促血小板生成素(rhTPO)、环孢素(CyA)、地塞米松(Dex),详见表1。输注hUC-MSCs后,完全反应3例,有效2例,无效1例,总有效率为5/6;中位随访时间为5个月,随访期间复发1例,再次输注hUC-MSCs后仍有效。

表1 6例患者临床特征
注:hUC-MSCs=人脐带间充质干细胞,PLT=血小板计数,Pred=泼尼松,IVIg=静脉注射丙种球蛋白,rhTPO=重组人促血小板生成素,CyA=环孢素,Dex=地塞米松


表2 难治性ITP患者hUC-MSCs输注前后外周淋巴细胞亚群比较Table 2 Comparison of peripheral lymphocyte subsets before and after intravenous infusion of hUC-MSCs in refractory ITP patients
注:NK细胞=自然杀伤细胞,Treg细胞=辅助性T细胞
2.6 不良反应 本组患者治疗期间2例出现轻度发热,对症处理后1~4 h完全缓解,无其他不适感;1例患者输注前出现激素依赖,Pred(50 mg/d)维持治疗过程中出现腹泻、肺部感染,输注后第10天原有肺部感染加重伴气喘,后经支气管镜肺泡灌洗和病毒DNA定量检测证实为巨细胞病毒性肺炎,经抗病毒治疗后痊愈,停用激素治疗后PLT维持正常至随访结束;其余患者hUC-MSCs输注后一般状况良好,生命体征平稳,血生化检查等均未发生明显异常。
3 讨论
1968年,FRIEDENSTEIN等[5]首次报道骨髓标本中小部分贴壁细胞在培养过程中能分化成类似骨、软骨集落,并将之称为骨髓多能间充质干细胞。1997年,PROCKOP等[6]成功分离出骨髓间充质干细胞,并发现其具有多向分化潜能,可分化为成骨细胞、软骨细胞、脂肪细胞、神经样细胞和成肌细胞等。间充质干细胞来源于中胚层,可从脂肪、脐血、羊水、牙体等组织中分离出来。足月产胎儿脐带间充质干细胞含量丰富,羊膜、华通胶、脐血和脐血管内皮下内膜均可分离出间充质干细胞,而脐带华通胶中富含的基质细胞即hUC-MSCs[7]。既往研究结果显示,显微镜下hUC-MSCs呈成纤维细胞样,细胞质丰富,具有贴壁生长特性,增殖率较高,表面均表达CD44、CD73、CD90和CD105,不表达CD34和CD45[8],具有分泌血管内皮生长因子、胰岛素样生长因子1和肝细胞生长因子等能力[9],在不同诱导条件下可分化为骨、软骨和脂肪细胞,在体外或体内均具有低免疫原性,异体移植后不易引起免疫排斥反应。
近年来,随着对间充质干细胞研究的不断深入及临床治疗需要,国际间充质及组织干细胞委员会对人来源间充质干细胞提出最低鉴定标准:(1)在标准培养条件下,间充质干细胞必须具备对塑料底物的贴附特性;(2)通过流式细胞术检测间充质干细胞CD105、CD73、CD90阳性表达率≥95%,且CD45、CD34、CD14或CD11b、CD79a或CD19、人类白细胞抗原-DR(HLA-DR)阴性表达率≥98%;(3)在体外通过标准方法诱导,间充质干细胞必须能分化为成骨细胞、脂肪细胞及软骨细胞[10]。笔者所在医院经医学伦理委员会审核批准,并经产妇或其亲属授权同意,留取足月剖宫产健康产妇的脐带,依据《干细胞制剂质量控制及临床前研究指导原则(试行)》《人体细胞治疗研究和制剂质量控制技术指导原则》《细胞移植治疗技术规范》(征求意见稿)等相关法律法规要求,在无菌条件下采用组织块法分离培养,得到类似于成纤维细胞、成长梭形流水状贴壁生长的原代细胞,并随着细胞传代,细胞形态未发生变化。流式细胞术检测结果显示,hUC-MSCs高表达CD73、CD90、CD105,表达量均>98%;不表达或低表达CD3、CD11b、CD19,符合国际间充质及组织干细胞委员会制定的间充质干细胞的鉴定标准。本研究成骨、成脂诱导分化实验结果显示,第3代hUC-MSCs成骨诱导18 d,细胞聚集汇合且呈多层重叠生长,形成圆形钙化结节沉积,周围折光性增强,茜素红染色呈红色,提示hUC-MSCs可向成骨细胞分化;第3代成脂诱导21 d,油红O染色,倒置显微镜下观察hUC-MSCs形成较大脂滴,提示hUC-MSCs可向脂肪细胞分化。本研究结果提示,陕西圆梦生命科学研究院干细胞与转化研究中心分离的细胞是hUC-MSCs,为下一步临床试验奠定了坚实基础。
大量临床研究和动物实验证实,hUC-MSCs在神经系统疾病、心血管系统疾病、血液系统疾病、免疫系统疾病、糖尿病、肌肉变性疾病、肝脏疾病及慢性疼痛等的治疗中具有广阔的应用前景[11]。hUC-MSCs具有独特的免疫调节能力、较强的免疫抑制性及低免疫原性,对适应性免疫的抑制作用主要表现为对T淋巴细胞和B淋巴细胞的免疫抑制,对固有免疫的抑制作用主要表现为对单核细胞/巨噬细胞、树突状细胞、NK细胞的免疫抑制[12]。
ITP的免疫学发病机制与体液免疫异常和细胞免疫异常均密切相关。既往研究结果显示,50%~70%的ITP患者可检测到血小板自身抗体,大多数ITP患者的血小板相关抗体 IgG(PAIgG)水平升高,且其水平与血小板寿命呈负相关。CHANG等[13]研究表明,ITP患者血小板自身抗体产生受T淋巴细胞及其分泌的细胞因子调控。SEMPLE等[14]研究发现,Th1辅助细胞可增强抗血小板自身免疫反应,而ITP患者Th1/Th2细胞明显升高,下调Th1/Th2细胞可预防ITP的发生,并有助于控制ITP病情。另有研究发现,ITP患者T淋巴细胞凋亡受限,可减少自身反应性T淋巴细胞清除率,从而产生持续的免疫效应,且T细胞可抑制巨核细胞凋亡,减少血小板释放[15-16]。目前,NK细胞对ITP发生、发展的影响尚未明确,可能既有保护作用,也有破坏作用。MA等[17]通过hUC-MSCs与ITP患者外周血单个核细胞(PBMC)和骨髓单个核细胞(BM-MNC)共培养实验发现,hUC-MSCs可抑制ITP患者T淋巴细胞和B淋巴细胞增殖,减少自体血小板破坏,促进血小板生成,并逆转巨核细胞功能障碍。徐淑芬等[18]对12例难治性ITP患者输注hUC-MSCs,每次输注(3~5)×107个细胞,1次/周,共治疗2~3个疗程,4例患者完全反应,4例患者有效,总有效率为8/12。FANG等[19]应用脂肪来源间充质干细胞(adipose tissue-derived mesenchymal stem cell,AMSC)治疗7例成年ITP患者,移植细胞2.0×106/kg,未见明显不良反应,治疗后所有患者PLT有所升高,4例完全反应,且移植后Thl/Th2细胞趋向平衡。

综上所述,采用酶消化法能有效分离、培养hUC-MSCs,流式细胞术及成骨、成脂诱导分化实验能有效鉴定hUC-MSCs分化能力,且hUC-MSCs治疗难治性ITP近期疗效较好,不良反应轻微;但本研究样本量较小且未进行随机对照试验,因此hUC-MSCs最佳输注途径、用量、疗程等问题还需进一步深入探讨。
作者贡献:梁英民进行文章的构思与设计,对文章整体负责,监督管理;黄斯勇、白喜龙进行研究的实施与可行性分析;伍艳兰、胡彬、王颖、徐静进行数据收集、整理、分析;黄斯勇、王刚锋进行结果分析与解释;黄斯勇、伍艳兰负责撰写论文;王颖进行论文的修订;张蓉、罗红香负责文章的质量控制及审校。
本文无利益冲突。
[1]PROVAN D,STASI R,NEWLAND A C,et al.International consensus report on the investigation and management of primary immune thrombocytopenia[J].Blood,2010,115(2):168-186.DOI:10.1182/blood-2009-06-225565.
[2]中华医学会血液学分会止血与血栓学组.成人原发免疫性血小板减少症诊断与治疗中国专家共识(2016年版)[J].中华血液学杂志,2016,37(2):89-93.DOI:10.3760/cma.j.issn.0253-2727.2016.02.001.
[3]朱付云,吴迪炯,孙洁,等.间充质干细胞治疗免疫性血小板减少性紫癜的机制及其研究进展[J].国际输血及血液学杂志,2012,35(2):173-175.DOI:10.3760/cma.j.issn.1673-419X.2012.02.020.
[4]KOÇ O N,GERSON S L,COOPER B W,et al.Rapid hematopoietic recovery after coinfusion of autologousblood stem cells and culture-expanded marrow mesenchymal stem cells in advanced breast cancer patients receiving high-dose chemotherapy[J].J Clin Oncol,2000,18(2):307-316.
[5]FRIEDENSTEIN A J,PETRAKOVA K V,KUROLESOVA A I,et al.Heterotopic of bone marrow.Analysis of precursor cells for osteogenic and hematopoietic tissues[J].Transplantation,1968,6(2):230-247.
[6]PROCKOP D J.Marrow stromal cells as stem cells for nonhematopoietic tissues[J].Science,1997,276(5309):71-74.
[7]BATSALI A K,KASTRINAKI M C,PAPADAKI H A,et al.Mesenchymal stem cells derived from Wharton′s Jelly of the umbilical cord:biological properties and emerging clinical applications[J].Curr Stem Cell Res Ther,2013,8(2):144-155.
[8]FONG C Y,CHAK L L,BISWAS A,et al.Human Wharton′s jelly stem cells have unique transcriptome profiles compared to human embryonic stem cells and other mesenchymal stem cells[J].Stem Cell Rev,2011,7(1):1-16.DOI:10.1007/s12015-010-9166-x.
[9]ZHU S F,ZHONG Z N,FU X F,et al.Comparison of cell proliferation,apoptosis,cellular morphology and ultrastructure between human umbilical cord and placenta-derived mesenchymal stem cells[J].Neurosci Lett,2013,29,541:77-82.DOI:10.1016/j.neulet.2013.03.018.
[10]DOMINICI M,LE BLANC K,MUELLER I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[11]李嘉,尹春艳.人脐带间充质干细胞在临床治疗中的研究进展[J].医学综述,2016,22(10):1931-1934.
[12]易桥,卢燕勤,黄宏宇,等.间充质干细胞在免疫调节过程中的作用与应用进展[J].中国组织工程研究,2016,20(41):6216-6224.
[13]CHANG M,NAKAGAWA P A,WILLIAMS S A,et al.Immune thrombocytopenic purpura(ITP)plasma and purified ITP monoclonal autoantibodies inhibit megakaryocytopoiesis in vitro[J].Blood,2003,102(3):887-895.
[14]SEMPLE J W ,FREEDMAN J.Inereaeed antiplatelet T helper lymphocyte reactivity in patients with autoimmune thrombocytopenia[J].Blood,1991,78(10):2619-2625.
[15]ZHANG F,CHU X,WANG L,et al.Cell-mediated lysis of autologous platelets in chronic idiopathic thrombocytopenic purpura[J].Eur J Haematol,2006,76(5):427-431.

[17]MA L,ZHOU Z,ZHANG D,et al.Immunosuppressive function of mesenchymal stem cells from human umbilical cord matrix in immune thrombocytopenia patients[J].Thromb Haemost,2012,107(5):937-950.DOI:10.1160/TH11-08-0596.
[18]徐淑芬,白海,王存邦,等.脐带间充质干细胞治疗难治性原发性血小板减少性紫癜近期疗效[J].中国现代医学杂志,2014,24(33):35-38.
[19]FANG B,MAI L,LI N,et al.Favorable response of chronic refractory immune thrombocytopenic purpura to mesenchymal stem cells[J].Stem Cells Dev,2012,21(3):497-502.DOI:10.1089/scd.2011.0231.
